乌索酸体外通过激活Nrf2信号通路抑制人肝星状细胞的增殖和细胞外基质相关基因的表达*
白庆云
(宜春学院化学与生物工程学院江西省天然药物活性成分研究重点实验室 宜春 336000)
肝纤维化(hepatic fibrosis,HF)是各种慢性肝病迁延不愈的结果。肝纤维化的发生发展是一个非常复杂的病理生理过程,涉及炎症反应,氧化应激,免疫反应等[1],在此过程中,肝星状细胞(hepatic stellate cells,HSC)起着关键作用[2-3]。在致病因子的作用下肝脏产生并释放多种细胞因子,如脂质过氧化物、蛋白酶、生长因子和炎性因子等,这些细胞因子作用于HSC,使之激活转化为成纤维细胞[4],同时合成大量胶原等细胞外基质(Extracellular matrix,ECM),不断对损伤进行修复,如此反复,终致肝纤维化的形成[5-6]。越来越多的研究表明,肝纤维化的发病机制与氧化应激有关,氧化应激以细胞内过量活性氧(reactive oxygen species,ROS)积累为特征。研究表明ROS参与了肝纤维化的发展,诱导了HSC的活化是致肝纤维化的潜在因素[7-9]。Nrf2是调节机体氧化还原反应的重要转录因子,能调节多种抗氧化基因的表达,如血红素加氧酶1(heme oxygenase-1,HO-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1,NQO1]、谷氨酸半胱氨酸连接酶催化亚基(glutamate cysteine ligase catalytic,GCLC)、谷氨酸半胱氨酸连接酶(glutamate cysteine ligase modifier subunit,GCLM)等[10]。Nrf2信号通路通过调控肝脏的氧化损伤在肝纤维化的防治中发挥重要作用。
肝纤维化属中医“胁痛”、“黄疸”、“积聚”等范畴,主要病机为血瘀阻络、正气虚损和湿热内蕴,治疗上常以活血化瘀为其基本治法[11]。乌索酸(UA),又名熊果酸,乌苏酸,是忍冬科植物蒴藿陆英的主要活性成分。陆英又名接骨草、走马风、七叶麻、蒴藋,为的全草。性温,味苦。具有活血散瘀,祛风活络,发汗利尿之功,用于跌打损伤、风湿痛、脱臼、肾炎水肿、脚气水肿等[12]。研究表明UA具有抗肝纤维化的作用,如Saraswat[13]等报道UA能治疗乙醇所致的慢性肝损伤,减轻肝纤维化程度也明显强于水飞蓟素;Yoshimura[14]和Murakam[15]等发现UA可以抑制TGF-β1的促细胞增殖效应,减少成纤维细胞胶原的分泌,但UA抗肝纤维化的机制尚待进一步阐明。本课题组前期研究发现UA能够抑制TGF-β1-Smads、PDGF-ERK信号通路而抑制HSC-LX2的增殖,诱导其凋亡[16-17]。本研究在前期实验基础上进一步观察UA对氧化应激下LX2的活化和ECM代谢的影响,并探讨Nrf2信号通路在其中的作用,为全面阐释UA的抗肝纤维化和机制提供实验依据。
1 实验材料
1.1 细胞株、药物和试剂
人肝星状细胞HSC-LX2细胞系购自中南大学湘雅医学院医学实验中心,人肝细胞L02细胞系购自上海信裕生物科技有限公司,乌索酸由江西省天然药物活性成分研究重点实验室提供,纯度>95%;细胞培养基DMEM、胎牛血清(FBS)、青链霉素均购自美国Gibco公司;抗体α-SMA、Nrf2、HO-1和内参β-actin,Lamin B均购自美国Cell Signaling Technology公司;NE-PER™蛋白胞浆胞核提取试剂购自Thermo-Fisher Scientific;BCA(bicinchonininc acid)蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;羊抗兔二抗购自美国Abbkine公司;Trizol RNA提取试剂盒购自北京百泰克生物技术有限公司;PrimeScript Master Mix和SYBR Premix Ex Taq购自日本Takara公司;MDA、GSH试剂盒购自南京建成生物工程研究所;MTT试剂盒购自阿拉丁试剂公司;其他试剂均为国产分析纯。
1.2 实验仪器
蛋白垂直电泳仪、转膜仪(美国Bio-Rad);GBOXCHEMI-XX8凝胶成像系统(美国SYNGENE);CFX384™荧光定量PCR仪(美国Bio-Rad);CO2培养箱(新加坡Esco Micro Pte Ltd);生物安全柜(美国Thermo);低温离心机8106(美国Thermo);全自动酶标仪ELX808(美国Bio-Tek)。
2 实验方法
2.1 细胞培养
将细胞培养于含10%灭活FBS、10万U·L-1青霉素和100 mg·L-1链霉素的培养液中(LX2用DMEM培液,L02用1640培液),细胞在37℃,5%CO2的培养箱中培养,取对数生长期的细胞用于实验。
2.2 噻唑蓝(MTT)检测
分别取对数生长的细胞,用0.25%胰酶消化后制成细胞悬液,将细胞以一定的浓度(LX2为5×104个∕mL,L02为1×105个∕mL)接种于96孔板内(每孔200μl细胞悬液,含10%FBS),细胞贴壁后,将培液换成低血清(0.5%,v∕v)的培液培养24 h,设溶剂对照孔、H2O2孔(L02不设)和UA孔。H2O2孔和UA孔加入H2O2和∕或UA,溶剂对照孔加入等体积的含二甲基亚砜(Dimethyl sulfoxide,DMSO)的PBS,继续培养24 h后,加入MTT,再培养4 h,加入200μl DMSO,待甲瓒完全溶解后,用酶标仪在570 nm和630 nm波长处测定OD值,计算细胞存活率。存活率%=给药孔∕对照孔×100%。
2.3 MDA检测
取对数生长的LX2细胞,用0.25%胰酶消化后制成细胞悬液,将细胞以5×104个∕mL接种于培养皿内(2 mL细胞悬液,含10%胎牛血清,fetal bovine serum,FBS),设溶剂对照孔、H2O2孔和UA孔。H2O2孔和UA孔加入H2O2和∕或UA,溶剂对照孔加入等体积的含DMSO的PBS,继续培养24 h。培养结束后吸弃细胞培液,磷酸盐缓冲液(phosphate buffered salin,PBS)润洗2次,用细胞刮将细胞从培养皿上刮下来,用移液枪将细胞转移到离心管中。按试剂盒步骤依次加入反应液,涡旋混匀,95胞水浴40 min,冷却后,4000 r·min-1离心10 min,吸取各管上清250μl加入96孔板,用酶标仪在530 nm处测OD值,按公式计算MDA含量。
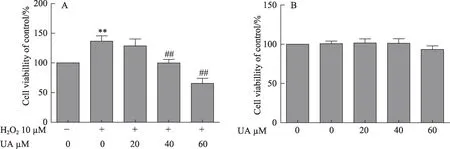
图1 UA对LX2和L02细胞增殖的影响
2.4 GSH检测
LX2细胞分组及前期处理同2.3项下,培养结束后收集细胞于离心管中,加PBS1 mL,超声匀浆,取0.1 mL匀浆液加0.1 mL试剂一混匀,3500 r·min-1离心10 min,取100μl上清液按试剂盒步骤加入各反应液,混匀,静置5 min,于405 nm处测OD值,按公式计算GSH含量。
2.5 总RNA提取
LX2细胞分组及前期处理同2.3项下,培养结束后收集细胞于离心管中,加入1 mL Trizol后超声匀浆,再加入0.5 mL氯仿萃取,4℃,12000 r·min-1离心15 min,转上清液到新的EP管,加入1 mL异丙醇沉淀RNA,离心,沉淀用75%乙醇洗涤,离心后得到的沉淀用DEPC水溶解既得总RNA。
2.6 QT-PCR
将得到的总RNA用PrimerScript Master Mix试剂盒进行逆转录,得到cDNA。然后将cDNA用SYBRgreen premix试剂进行混合后,再进行Real-time PCR扩增。扩增完成后,根据溶解曲线来判断扩增反应的准确性。最后目标基因的相对表达量用相应内参来标准化,采用2-△△Ct法进行计算。本研究使用的引物序列(人源,由上海捷瑞生物工程有限公司合成)如下:α-SMA,(forward primer)5’GGCAACGCCTTAGCACTGTG3’,(reverse primer)5’CGAATTCATAGACTCG TAA3’;COL1A1,(forward primer)5’GCTAATGAAGCTCGCGCATA,(reverse primer)GCATGGATCCCTCATCGTG A;COL3A1,(forward primer)5’ATGCCG TGTGTTAAGTGCT,(reverse primer)GGGCACCATTTTCTCCCTTA;TIMP1,(forward primer)TTCTGGTCTTGGTC GGATTG,(reverse primer)GGTCTGATT CGGTTGTCTTCC;MMP2,(forward primer)GGAACTTTACTCCGCGACTTG, (reverse primer)GCCGCAATAGAAGTTGGTCAG。
2.7 蛋白浓度测定
采用BCA法,按试剂盒说明操作。
2.8 细胞总蛋白提取
LX2细胞分组及前期处理同2.3项下,培养结束后吸弃细胞培液,用PBS润洗细胞2次,吸弃PBS,加一定量的加样缓冲液,用刮子将细胞刮净,收集到离心管内,100℃煮样5 min,冷却,置于-20冰箱备用。
2.9 Western blot检测
将制得的蛋白样本进行12%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,上样量为50μg,湿法转膜,脱脂牛奶封闭,加入相应一抗,4℃孵育过夜,再加入二抗室温孵育1 h,加入ECL发光液,用凝胶成像系统进行成像、灰度扫描和分析。
2.10 统计分析
3 实验结果
3.1 UA抑制LX2的增殖
为了观察H2O2促进HSC增殖的作用,建立了体外氧化应激诱导HSC活化的体外模型[18]。MTT结果显示H2O2可显著促进LX2细胞增殖,而UA(40μM和60μM)可显著抑制LX2的增殖(图1A)。另外,本研究观察了相同浓度的UA对L02细胞的影响,发现UA对L02细胞无明显作用(图1B)。
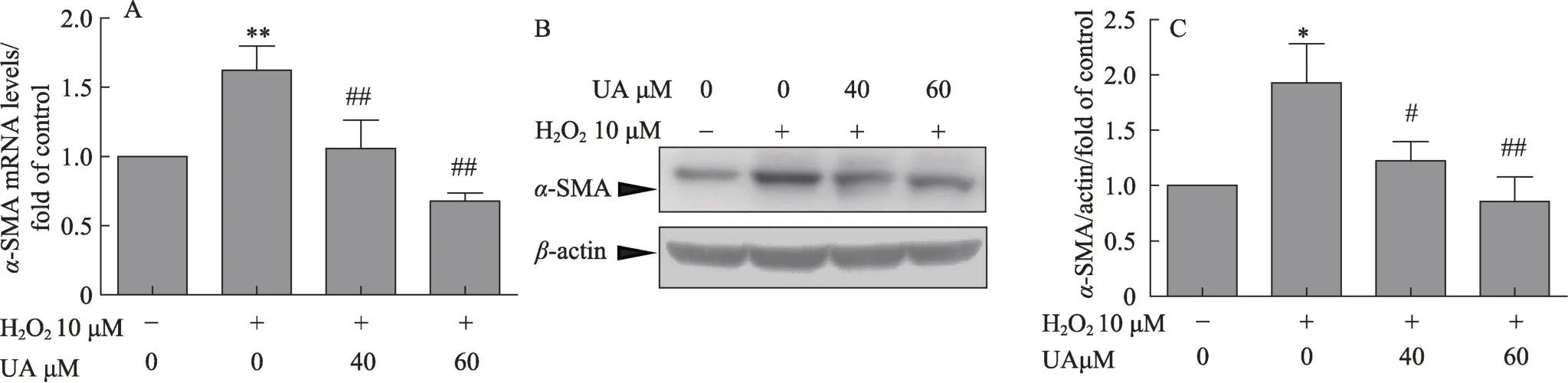
图2 UA减少LX2α-SMA mRNA和蛋白的表达
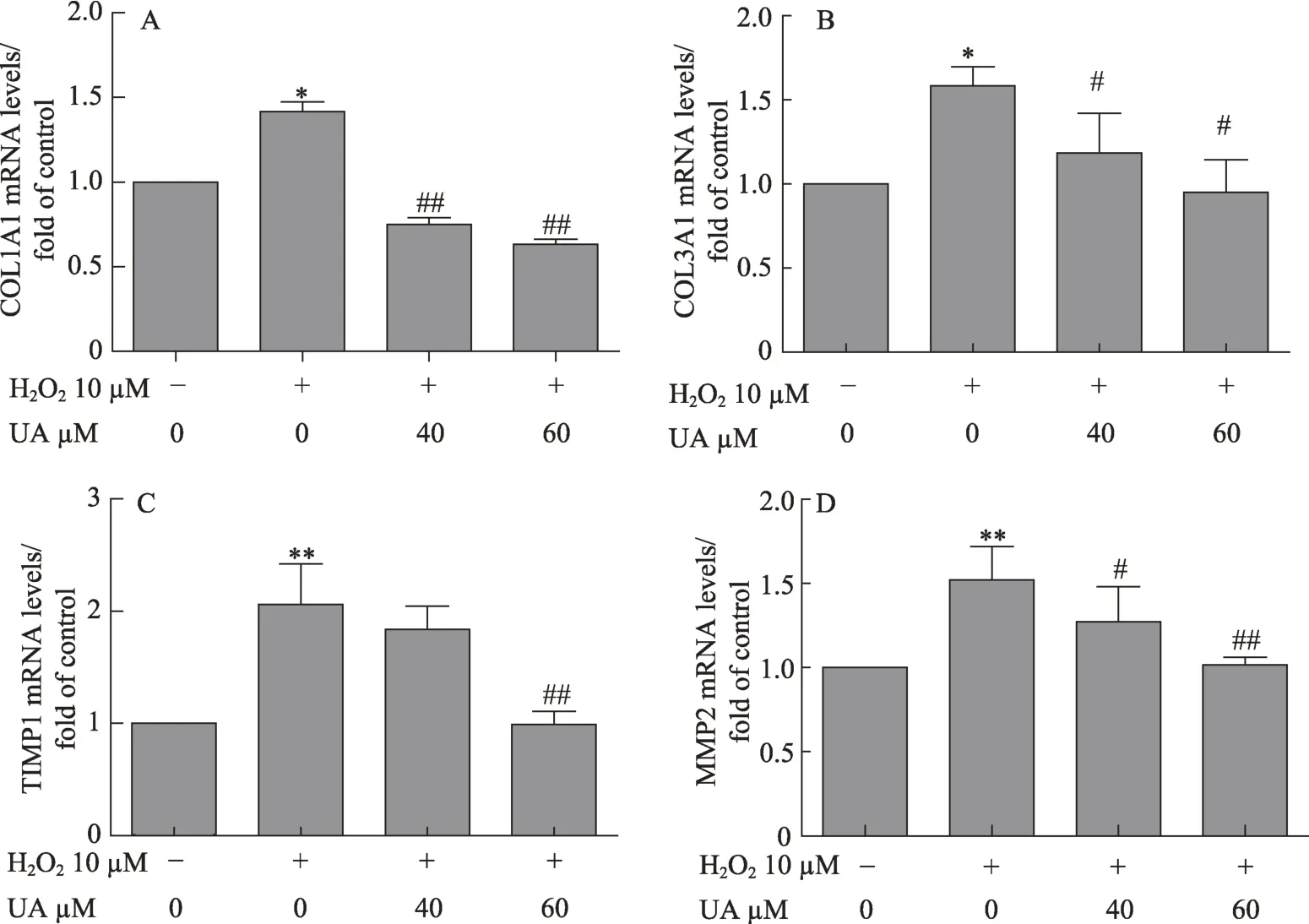
图3 UA减少细胞外基质的基因表达
3.2 UA减少α-SMA的基因和蛋白表达
为了进一步验证UA对LX2细胞的活化作用,本实验检测了α-SMA mRNA和蛋白的表达,实验结果如图2所示,H2O2可使α-SMA mRNA的表达显著增加(图2A)。实验进一步检测了α-SMA蛋白的表达,Western blot检测结果显示H2O2也使α-SMA的蛋白表达增加(图2B,图2C)。UA 40μM和60μM两个剂量均可以降低H2O2引起的α-SMA mRNA(图2A)和蛋白表达的增加(图2B,图2C),其中60μM剂量组更为明显。这说明UA能抑制H2O2诱导的LX2的活化。
3.3 UA减少细胞外基质的基因表达
HSC被激活后活化为成纤维细胞,同时分泌大量细胞外基质。为了探究UA对LX2细胞外基质的影响,本实验检测了Ⅰ型胶原蛋白(Collagen I)、Ⅲ型胶原蛋白(CollagenⅢ)和基质金属蛋白酶(matrix metalloproteinase,MMP)及基质金属蛋白酶的组织抑制剂(tissue inhibitor of metalloproteinases,TIMP)的基因表达。结果如图3所示,LX2经H2O2诱导后COL1A1(图3A)、COL3A1(图3B)、MMP2(图3C)和TIMP1(图3D)mRNA表达均显著增加,而UA可显著降低这些细胞外基质的基因表达,其中60μM剂量组更为明显。

图4 UA减轻H 2O2诱导的氧化应激
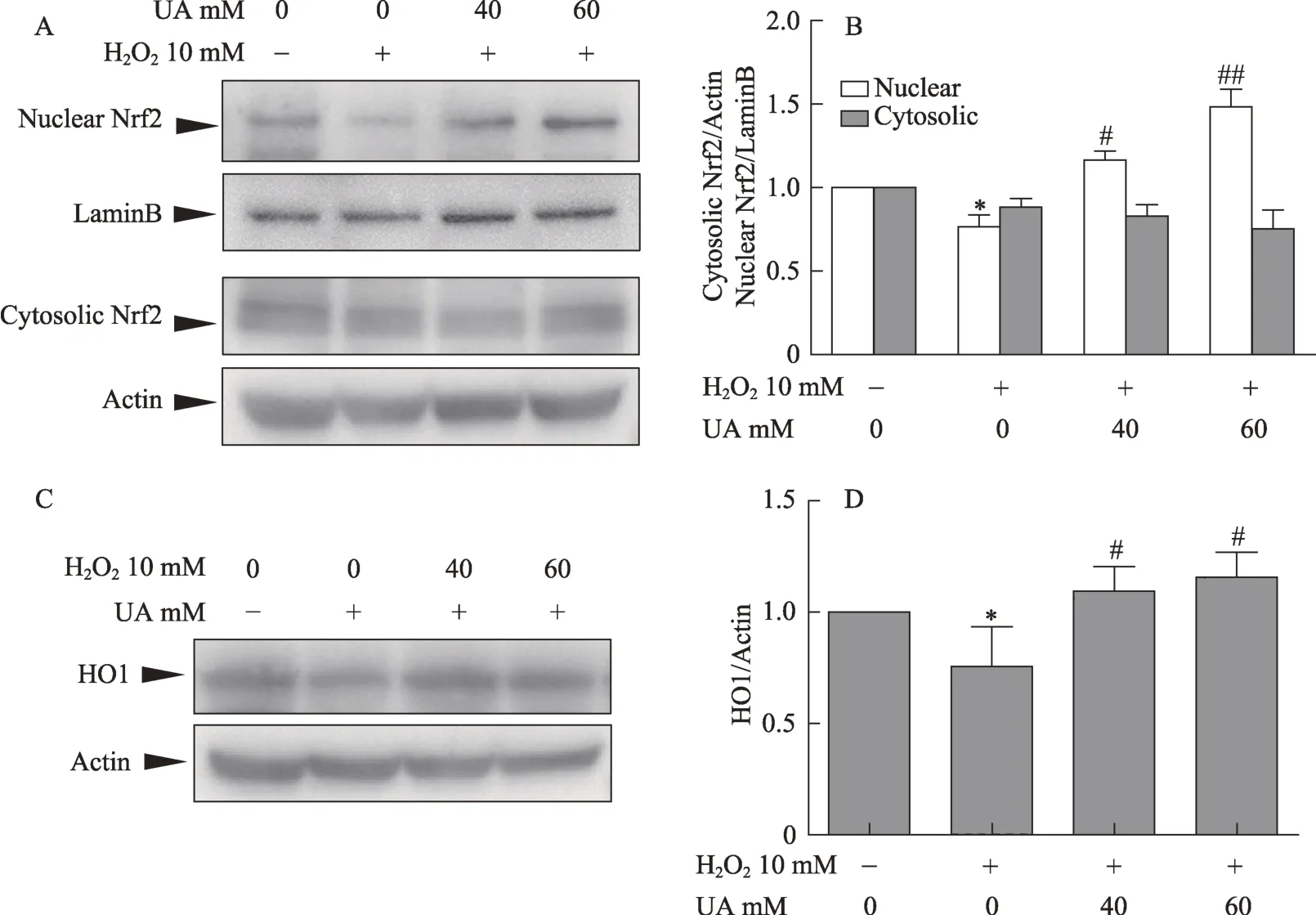
图5 UA增加Nrf2的转核和HO1的蛋白表达
3.4 UA抵御H2O2引起的氧化应激
为了阐明UA抑制LX2活化与抗氧化之间的关系,我们接下来检测了脂质氧化产物丙二醛(MDA)和具有抗氧化作用的还原型谷胱甘肽(GSH)的含量。结果如图4所示,H2O2可使MDA含量升高,同时使GSH含量降低,而UA两个剂量均可降低H2O2诱导的MDA含量的升高(图4A),同时升高GSH(图4B)。
3.5 UA激活Nrf2信号通路
Nrf2是重要的抗氧化应激的核转录因子,为了验证UA抗氧化作用与Nrf2信号通路之间的关系,本研究检测了Nrf2和HO1的蛋白表达。结果如图5所示,H2O2可使核内Nrf2蛋白显著减少,而胞浆内的Nrf2蛋白表达无明显变化(图5A,图5B);同样,H2O2可使Nrf2下游的靶基因HO1的蛋白表达显著减少(图5C,图5D)。而UA两个剂量组的Nrf2的转核增加,HO1的蛋白表达也增加。说明UA可逆转H2O2引起的Nrf2的核内蛋白的减少,同时可增加其下游HO1的蛋白表达。
4 讨论
近年来大量研究表明氧化应激与肝纤维化的发生发展密切相关[19]。肝脏在氧化应激状态下产生的大量活性氧族(reactive oxygen species,ROS)可直接刺激HSC的激活和增殖[20]并获得迁移、侵袭的能力,同时分泌Ⅰ型胶原等细胞外基质,导致肝纤维化的进一步发展[21],而肝星状细胞的活化是肝纤维化发生发展的关键,活化的星状细胞表达大量的α-SMA。本研究结果显示UV可以降低H2O2引起的α-SMA基因和蛋白的表达增加,并减少细胞外基质的mRNA表达。说明UA可抑制HSC的活化和细胞外基质的产生。
MDA和GSH是氧化应激的重要监测指标。MDA是不饱和脂肪酸被氧自由基攻击后,发生脂质过氧化反应而产生的脂质过氧化物,因此当机体发生氧化应激损伤时MDA含量往往升高[22-23]。GSH是一种重要的自由基清除剂,在氧化应激过程中会被大量消耗[24]。实验进一步结果显示UA可降低H2O2引起MDA升高,并逆转降低的GSH,这说明UA可以拮抗H2O2引起氧化应激。这与文献报道的UA具有抗氧化作用的结果一致[25-26]。
Nrf2信号通路在机体抗氧化过程中具有重要作用并与肝纤维化密切相关[27]。本实验结果表明UA可以增加Nrf2的转核,并使其下游靶蛋白HO1表达增加,说明UA能激活Nrf2信号通路,从而发挥抗氧化的作用。
综上所述,UA通过激活Nrf2信号通路抵御H2O2诱导的氧化应激,抑制脂质过氧化产物MDA的产生和HSC的活化,减少细胞外基质的产生,从而发挥抗纤维化的作用。本研究结果将为中药陆英及其主要活性成分UA抗肝纤维化机制的阐明提供实验依据,也为中药防治肝纤维化提供理论基础。

