EML4-ALK融合基因异形及其相关耐药性的研究进展
隋泽森,张建华
(南方医科大学深圳医院胸外科,广东 深圳 518110)
2018年9月国际癌症研究机构发布权威数据统计再一次强调了肺癌是最常见的癌症类型,占全球癌症诊断的13%,是致死率最高的癌症,10年生存率仅为5%[1]。超过80%的肺癌为非小细胞肺癌,其在组织学上多为肺腺癌。2011年美国临床肿瘤学会指出,肿瘤诊疗已进入分子靶向治疗时代[2],基因分析提高了人们对肺腺癌以及相关突变基因的认识,使分子筛查成为非小细胞肺腺癌的常规诊疗手段。肺腺癌中两个最常见的基因驱动靶点是表皮生长因子(epidermal growth factor receptor,EGFR)突变和微管相关蛋白样4-间变淋巴瘤激酶(echinoderm microtubule-associated protein-like 4- anaplastic lymphoma kinase,EML4-ALK)重排,这两者均适用于激酶抑制剂的治疗。基于此,免疫靶向治疗应运而生,且治疗手段也越来越个体化。与常规化疗相比,采用免疫靶向治疗的患者有更长的无进展生存期和更好的生活质量[3]。随着对EML4-ALK融合基因研究的深入,目前已经发现了超过17种EML4-ALK融合异形[4-5]。最近的研究集中探讨特定融合异形是否会影响肺癌的播散和疾病的预后以及不同异形是否会影响ALK靶向治疗的疗效[6]。国内学者研究发现,不同的ALK融合异形与靶向药物的疗效无明显相关性[7-8],但也有研究认为在分子层面,不同异形会通过分子信号通路对靶向药物的治疗产生影响[9-10]。为了更新对EML4-ALK融合异形的认识,获得更好的治疗策略,现就目前所发现的常见的EML4-ALK融合异形的分子生物学特性及其对相关靶向药物的耐药性进行综述。
1 EML4-ALK融合基因
1.1EML家族 1993年,Suprenant等[11]在海胆卵有丝分裂间期发现了一种能与微管蛋白结合的物质,并将其命名为棘皮动物微管相关蛋白(echinoderm microtubule-associated protein,EMAP),这是第1个被确定的EML家族成员蛋白。自此开始,EML家族同源蛋白被逐个发现,其大多助力于有丝分裂时的微管调节,但这些机制尚未完全明晰。人类一共表达6种EML家族成员(EML1~6),根据蛋白结构分为2个亚科[12]。EML1~4这4种微管相关蛋白均由1个N端螺旋卷曲碱基区(N区)、1个疏水的棘皮动物相关蛋白(hydrophobic motif in EML proteins,HELP)域和1个C端色氨酸-天冬氨酸重复序列(tryptophan-aspartic acid,WD)构成[13],四者的区别取决于一个富含色氨酸和苏氨酸的不规则基链。另一个亚科是由EML5和EML6组成,两者没有N区,取而代之的是3个重复的HELP域和WD重复区结合的区域,最初命名为Ropp120[14]。Richards等[15]在探究EML1结构时发现,EML1的C端是一段含非典型螺旋(atypical β-propeller,TAPE)域的EML蛋白,由13个重复的WD片段构成了一个高度有序的结构,这直接导致两个有HELP域的螺旋节段紧密结合起来,组成了EML1疏水结构的核心部分;后续研究发现,EML2~4的螺旋卷曲域是三聚体寡聚化的必要条件,所以这个卷区域被命名为三聚域[16]。通过三聚域和基础域,EML蛋白可与微管连接在一起,但目前的研究尚未明确这种连接是通过直接结合还是通过寡聚化结合。另外,TAPE域也可通过自身的凹面与可溶性微管蛋白异二聚体结合,当然也尚不明确这种结合的具体作用。本文所探讨的EML4如图1所示,其与EMAP有57%的同源性,是目前表达EMAP特性最好的同源蛋白[17]。
1.2ALK与EML4-ALK ALK隶属于胰岛素受体超家族,由Morris等[18]发现。ALK激活致癌信号通路主要依靠酪氨酸激酶(tyrosine kinase,TK)域,而ALK与EML4融合有赖于双方断裂部位均靠近TK域的近膜域,见图2,其激活方式主要包括点突变、基因异常扩增以及基因融合。在基因融合激活中,ALK的后续表达与活动均由其融合伙伴所决定。Soda等[19]发现,EML4-ALK融合蛋白在体内外均有转化特性,接受非小细胞肺癌基因检测的患者中,融合蛋白所致肺癌占比6.7%。目前ALK突变的研究共识与EGFR突变研究共识相互独立[20]。EML-ALK融合蛋白在肺腺癌中的表达仅占2%~9%,其也存在于乳腺癌和结直肠癌中[4]。EML4-ALK的本质是一种臂内倒位造成的易位融合,由EML4和定植在第2号染色体短臂上的ALK基因构成[21]。到目前为止,已经确定了至少17种EML4-ALK融合异形,其中一些融合异形还存在亚型。所有融合异形均包括了ALK的整个激酶相关域,并被外显子编码为20~29号,不同在于融合EML4基因的位点不同。所有的融合突变体都包括了通过寡聚和自我磷酸化使ALK产生活性的EML4的三聚域[4,16]。结构的差异在于不同的融合突变体拥有的连接域和TAPE域所呈现的状态,或无TAPE域或TAPE域的长度不同。总之,这些不同导致了EML4-ALK异形表现出不同的生物和分子特性,不同的特性又影响了不同的药物反应。
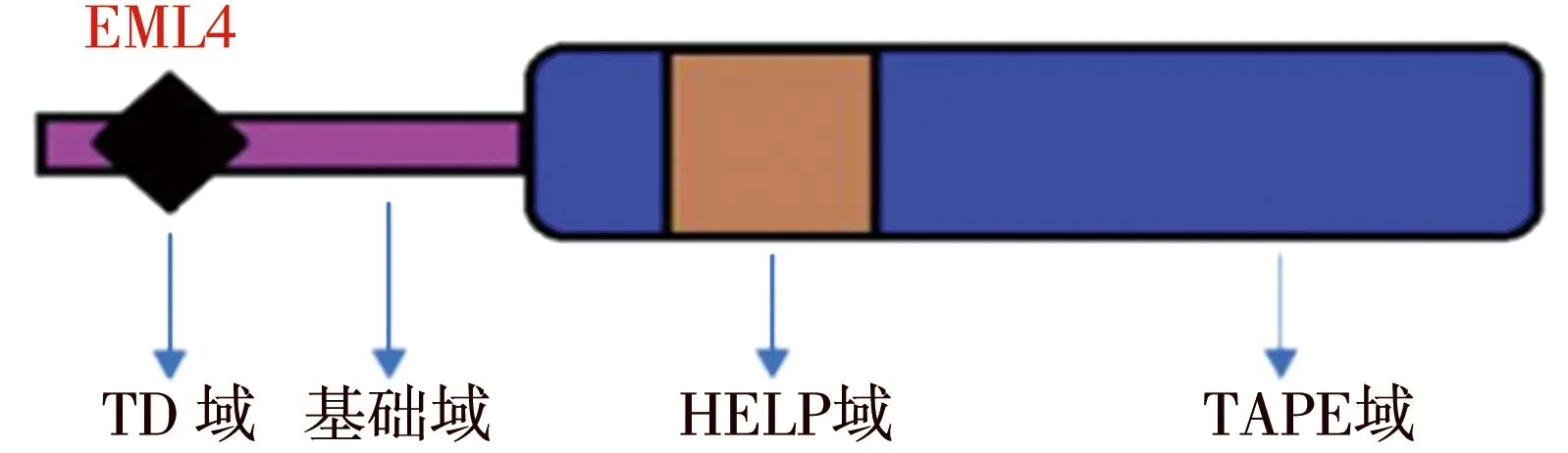
EML4:微管相关蛋白样4;TD域:三聚域;HELP:棘皮动物相关蛋白区;TAPE域:非典型螺旋域
图1 EML4的结构图

ALK:间变淋巴瘤激酶;JM域:近膜域;TK域:酪氨酸激酶域
2 常见的EML4-ALK融合异形
EML4-ALK阳性患者通常具有明显的临床特质,包括发病年龄较小,轻度甚至不吸烟,组织学上大部分属于腺癌[22]。对于晚期患者,细胞毒性化疗是常见的治疗选择,但这种方法表现出高药物毒性和低药物疗效。随着对肺癌分子层面认识的加深,目前几乎所有非小细胞肺癌患者都会进行基因检测以制定更加个性化的治疗方案,如靶向药物治疗,但进行靶向药物治疗时发现,同样都是EML4-ALK阳性患者,但是对于同种靶向药物的应答结果不同。目前发现了17种EML4-ALK融合异形,常见的有1、2、3a/b、4、5a,其中最常见的是1、2和3a/b,占总融合异形的90%[6,23]。
如表1所示,EML4-ALK融合异形1占目前所有融合异形的33%,融合点位在外显子E13;A20上,融合后含有部分TAPE域,多存在于细胞质中[23]。体内研究发现,EML4-ALK融合异形1表达于H3122、STE-1以及DFC1032细胞,其是能进行内源性培养的仅有的两个融合异形之一[24]。EML4-ALK融合异形2的占比为10%,融合点位在外显子E20;A20上,也仅含有部分TAPE域,存在于细胞质中,目前认为异形2是对克唑替尼最敏感的EML4-ALK融合异形[4,7];EML4-ALK融合异形3a/b的占比为29%,但也有研究指出异形3a/b的突变率达到44.4%[6],其融合位点是外显子E6a;A20。EML4-ALK融合异形3a/b的C端没有TAPE域,不仅存在于细胞质中,还存在于细胞核和微管上,其是另一个可通过内源性培养得到的融合异形,表达于H2228细胞[25];EML4-ALK融合异形4因临床病例较少,目前研究较匮乏,Takeuchi等[24]在外显子E14;ins11del49A20上发现并命名,预估占比3%。作为含有部分TAPE域的融合异形,其结合位点在异形1和2之间。EML4-ALK融合异形5占比仅为2%,是目前最短的异形,不仅缺乏TAPE域,甚至缺乏EML4的一部分基本域,但其依然能依靠EML4的三聚域激活ALK,表现出致癌活性,异形5融合点位为外显子E2;A20,存在于细胞质中[26]。
3 EML4-ALK融合异形相关耐药性研究
目前临床用于非小细胞肺癌治疗的激酶抑制剂包括针对EGFR突变的厄洛替尼和EML4-ALK易位激活的克唑替尼、色瑞替尼以及艾乐替尼[27],同时还有8个第2代或第3代ALK抑制剂正在临床研究中[28-29]。EML4-ALK阳性患者对ALK抑制剂的应答率为61%~74%,虽然对很多患者产生了积极影响,但也有部分患者的治疗反应很差甚至无反应[30-31]。对于ALK阳性的肺癌患者在治疗1年内,最初对抑制剂敏感的患者会因二次突变或者其他分子通路的激活而导致复发。目前研究集中在为何同为ALK阳性患者,却对靶向药物的反应不同以及为何同一患者会对靶向药物产生反应衰减,挖掘出药物抵抗背后的分子机制有助于寻找更佳的治疗方式、改善预后。目前研究人员根据不同异形的结构稳定性和敏感性做出了EML4-ALK异形的分型与患者应答之间存在相关性的假设。
2010年发表了第1个确定EML4-ALK融合异形的临床研究,但由于患者群体规模较小,仅1例患者表达了异型2,该患者对克唑替尼的敏感性为57%,对传统化疗药物的敏感性仅为10%[30]。之后几年陆续有其他融合异型被发现。关于不同EML4-ALK融合异形对ALK抑制剂的敏感性,不同学者得出了不同的结论。Lei等[32]和Cha等[33]认为,ALK融合异型对ALK抑制剂的反应并无明显差别。而Yoshida等[34]认为,携带EML4-ALK融合异形1的患者相较于携带其他异形的患者对克唑替尼的反应更加敏感。在一项回顾性研究中,基于之前关于EML4-ALK异形稳定性的数据将受试者分为两组,一组患者携带异形1、2或其他异形,另一组患者携带3a/b或5a。结果发现,缺少TAPE域的比较短的异形(如3a/b或5a)相较于比较长含有TAPE域的异形(如1或2),对酪氨酸激酶抑制剂处理的敏感性降低[35],而EML4-ALK异形1、2患者的2年无进展生存期较3a/b、5a患者更长。以上为缺少TAPE域的变体导致患者出现酪氨酸激酶抑制剂耐药提供了关键证据[36]。这有助于临床工作者根据ALK突变类型对患者进行分类,以便更加准确地制定策略进而预测治疗反应。
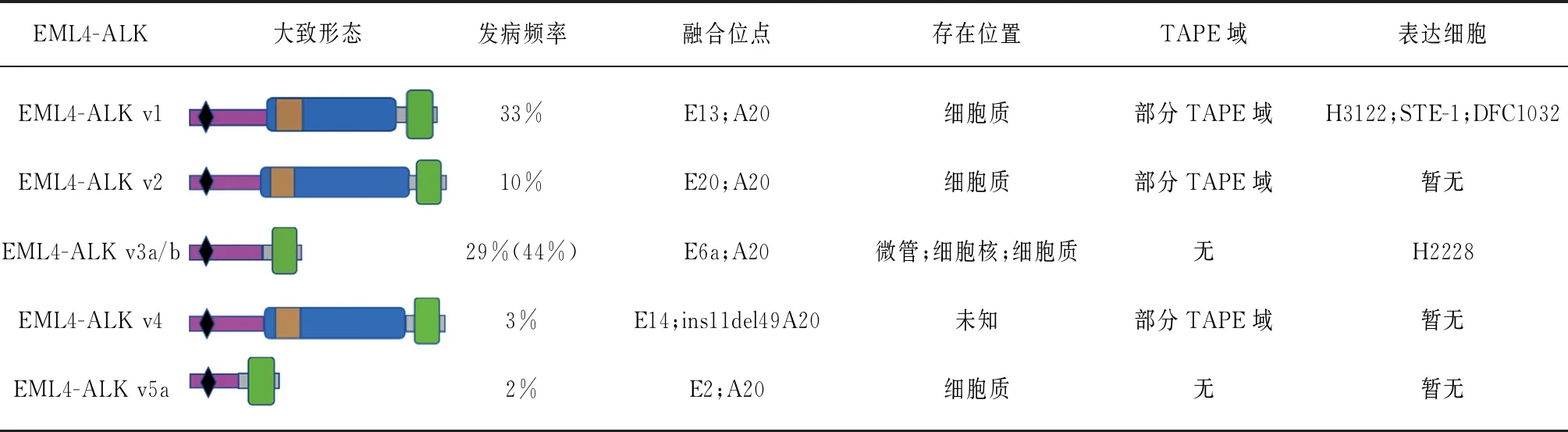
表1 常见的EML4-ALK融合异形
EML4:微管相关蛋白样4;ALK:间变淋巴瘤激酶;TAPE域:非典型螺旋域
克唑替尼作为一线治疗方案,经常会在用药1年内出现治疗耐药,这不仅是因为ALK激酶域的二次突变,在某些情况下还因为ALK融合基因的扩增[22]。许多致癌基因依赖于额外的伴侣蛋白如热激蛋白(heat shock protein,HSP)90以保持稳定,有研究报道EML4-ALK也是如此[9]。有研究人员培育出有克唑替尼抗性的H3122细胞,此细胞对17-ADD敏感,而17-ADD是一种拮抗Hsp90的抑制剂[23]。但同ALK抑制剂一样,不是所有患者都对Hsp90抑制剂敏感。Richards等[15]的研究表明,Hsp90第2代抑制剂ganetespib对结构不稳定的EML4-ALK如异形1表现出明显的癌退化效应;而对完全缺少TAPE域且更稳定的异形3a/b对其具有耐药性。这一点可以帮助区分EML4-ALK患者,有助于找到可能更能受益于Hsp90抑制剂治疗的患者群体。
4 结 语
表达EML4-ALK的非小细胞肺癌患者表现出了对靶向药物敏感性及持续作用时间不同的情况。基于对EML4-ALK分子形态的研究,学者把研究焦点转移到EML4-ALK异形与反应应答的相关性上。在体外研究中,研究人员利用有限的患者标本及其所培养出的细胞株确定了不同异形间存在不同的稳定性以及不同的异形对TKI和Hsp90抑制剂的敏感性不同。EML4-ALK异形在结构方面的不同在于有无TAPE域及完整性,TAPE域部分存在的异形相较于完全缺乏TAPE域的异形对抑制剂有更高的敏感性。目前仅仅是通过回顾性研究分析特定异形表达的差异,且均是针对ALK第一代激酶抑制剂——克唑替尼敏感性的比较。推测EML4-ALK异形差异会成为筛选及评估下一代ALK抑制剂——艾乐替尼或色瑞替尼的条件之一。
目前关于EML4-ALK异形研究的瓶颈也十分突出。首先由于ALK阳性病例较少,即便是多中心大型临床研究所获得的数据也仅能初步明确异形的表达和后续反应,并不能记录长期应答。此外,现在符合实验标准的细胞株也十分有限,由于其是从腺癌患者中获得的,不可避免地表现出遗传背景的差异。因此,制备同基因型的肺腺癌细胞株对于表达EML4-ALK异形是十分必要的,通过对基因型相同的肺腺癌细胞株进行EML4-ALK异形的研究对比较具有相同遗传背景的细胞激活途径非常有利。此外,扩展现有病源细胞数据库的同时,根据现有研究将每种异形分门别类,然后再利用异形特性探索新的治疗方法,有助于改善EML4-ALK肺癌患者的预后。
EML4-ALK融合蛋白不仅具有其亲代蛋白的特性,从EML4上遗传了微管结合性和三聚域,从ALK遗传了激酶活性,而且自身的特性也是独一无二的,如由于TAPE域断裂而产生对Hsp90的依赖。这一新的生化特性在驱动致癌信号的同时,也给研究人员提供了制定新的治疗策略的机会。因此,进一步研究不同EML4-ALK异形的差异,可能会直接影响患者对ALK激酶抑制剂的反应,有助于发现新的非小细胞肺癌治疗策略。
——水芹主要害虫识别与为害症状

