花状Ni(OH)2微球的制备及其对尿酸的快速检测
赵小铷, 闫炳东, 涂进春
(海南大学理学院∥南海海洋资源利用国家重点实验室∥海南大学热带生物资源教育部重点实验室,海口 570228)
尿酸(UA)是人体重要的生理指标,人体内含量过多会诱发痛风、慢性关节炎、肾功能障碍等疾病[1-2]. 由于现有的检测技术尚不完善,因此在临床分析、生物技术、生物化学等领域急需高效的尿酸检测方法. 尿酸的检测方法包括酶技术、伏安法、高效液相色谱法、磷钨酸还原法和酶传感器法[3-4]. 在这些方法中,酶传感器因其选择性高而备受关注,同时这种基于尿酸氧化酶的传感器因其独特的敏感性和特异性而被应用于尿酸检测. 然而,酶只能在有限的条件下发挥作用,这极大地限制了酶传感器的应用[5]. 同时,传感器表面酶的固定是十分复杂的过程,固定后酶的活性降低、易脱落、反应条件苛刻等原因限制了生物传感器的应用,而无酶传感器在以生物组分为敏感材料的检测方面具有优异的性能,成为近年来的研究热点[6].
无酶传感器旨在解决酶生物传感器在化学与热力学方面的不稳定性. 目前,该研究主要集中在各种金属(Cu、Ag、Ni、Au、Pt等)[7-9]、金属合金(Ag-Pt、Ni-Pd、Pt-Pb、Pt-Cu等)[10-11]以及金属氧化物(CuxO、NiO、CoO、MnO2、ZnO等)[12-14]. 在这些材料中,金属氧化物占了绝大多数,尤其是镍氧化物(NiO). NiO是一种p型宽禁带半导体,可用于修饰电极,实现直接、稳定、低成本、低毒的应用目的. 以上优势增强了NiO的适用性,并使其在环境友好型、高效型电化学检测中有良好的应用前景. 然而,合成NiO所需的较高温度和较长时间限制了它的广泛应用. 近年来,基于Ni(OH)2的无酶催化电化学传感器的研究进展迅速,尿酸传感器已被报道[15-16]. 作为无酶催化尿酸传感器的电极材料,纳米形貌的Ni(OH)2具有毒性低、表面积大、自然界含量丰富、电化学活性高、稳定性好等优势. 制备Ni(OH)2的方法主要有溶胶-凝胶法、模板法和水热合成法. 例如,YANG等[17]通过水热法在水和醇的混合溶剂中合成了纳米氢氧化镍,尽管水热法被认为是一种常用且成熟的Ni(OH)2合成方法,但由于耗时长,其应用受到了极大的限制. 微波加热合成法以其独有的快速加热能力而成为近年来许多研究的热点[18].
本研究采用微波辅助水热法制备了花状Ni(OH)2微球. 微球的平均直径约1.6 μm. 校准曲线显示出了较宽的线性范围(0.1~1.5 mmol/L)和较高的灵敏度(475.71 μA·L/(mmol·cm2)),相关系数R2= 0.996 4,检出限为1.8 μmol/L (S/N=3). 微波加热后的产物展现了优异的电化学性能,如良好的再现性、良好的稳定性和优良的抗干扰能力.
1 实验部分
1.1 试剂及仪器
六水合氯化镍和尿素均购自广州化学试剂厂. 无水乙醇购于广东光华科技股份有限公司,所有原料无需进一步提纯.
产物的晶体结构通过X射线衍射仪(D8,德国布鲁克)分析,使用铜(kα=1.540 6)作为靶材,操作电压为40 kV,电流为30 mA . 设置扫描速率为0.02°/s,扫描速率范围为5°~75°. 采用扫描电子显微镜(S-3000,日本日立)观察Ni(OH)2的形貌. 使用透射电子显微镜(JEOL-2100F,日本电子)拍摄显微照片. 样品的拉曼光谱通过反射激光拉曼光谱仪(DXR Smart Raman,美国赛默飞世尔)测得.
循环伏安(CV)曲线和电流-时间曲线(i-t)的测试采用电化学工作站(CHI 660E,上海辰华). 参比电极为Ag/AgCl(饱和KCl溶液)电极,对电极为铂丝.
1.2 Ni(OH)2的制备
将0.93 g六水合氯化镍(NiCl2·6H2O)和0.19 g尿素溶于28 mL蒸馏水和乙醇的混合溶液中,V(乙醇)∶V(H2O)=1∶1. 剧烈搅拌,其中乙醇的作用是改变溶液的极性,有利于Ni(OH)2纳米结构的生成. 将混合物转移到带有容积为88 mL的聚四氟乙烯内衬的高压反应釜中,该反应釜对微波辐射是透明的. 将反应釜密封,在微波箱内以90 ℃恒温加热15 min,自然冷却至室温. 用蒸馏水和无水乙醇洗涤产物并过滤. 最后将得到的纳米颗粒在80 ℃下烘干24 h.
尿素对花状结构的形成起到至关重要的作用[19],在一定的原料配比和适宜的反应条件下可以合成花状Ni(OH)2:
CO(NH2)2+H2O → 2NH3+CO2↑
(1)
(2)
Ni2++2OH-→Ni(OH)2↓.
(3)
尿素在反应体系中逐渐分解为NH3和CO2,温度从室温升高至90 ℃. NH3溶于H2O产生OH-. Ni2+和OH-反应生成Ni(OH)2纳米颗粒. 不稳定的微小Ni(OH)2纳米颗粒很容易聚集成大尺寸的纳米颗粒,此过程仍然保留其原有的晶体结构. Ni(OH)2纳米颗粒表现出一致的行为——由于被水包围的CO2气泡具有较高的表面能,它们自动聚集在水和CO2的气/液相界面周围,这是软模板方法. 游离的、花瓣状的Ni(OH)2纳米结构被CO2吸引并诱导进一步的自组装,最后生成花状Ni(OH)2微球,合成示意图如图1所示.
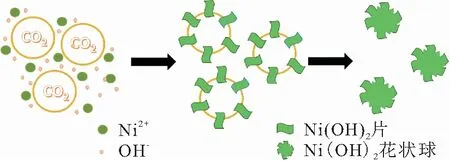
图1 Ni(OH)2的合成示意图
1.3 Ni(OH)2/GCE的制备
用0.05 μm氧化铝粉末抛光玻碳电极(GCEs)表面. 将该电极在乙醇和去离子水中连续超声5 min. 将Ni(OH)2水溶液滴在GCE表面,并在空气氛围下干燥.
1.4 尿酸的检测及抗干扰实验
在0.1 mol/L NaOH溶液中,通过循环伏安(CV)法测定Ni(OH)2氧化尿酸的电化学反应活性,扫描速率为50 mV/s,电位范围为-0.2~0.7 V. 通过电流变化检测Ni(OH)2修饰电极对不同浓度尿酸的响应性能,拟合得到尿酸浓度在0.1~1.5 mmol/L范围的线性函数.
抗干扰实验分别选用0.15 mmol/L多巴胺(DA)、抗坏血酸(AA)、肌酐(Cre)与1.5 mmol/L尿酸混合溶液作为实验组,对照组为不添加干扰物质的1.5 mmol/L尿酸,依次检测电流响应.
1.5 检出限计算
利用公式XL=S/k求得,其中XL为检出限,S为3倍数据波动的标准差,k为响应电流-尿酸浓度拟合曲线的斜率.
2 结果与讨论
2.1 分级Ni(OH)2的形貌表征与分析
通过XRD表征产物的晶体学信息(图2). 在2θ=13.0°、25.5°、33.0°、36.0°、43.0°和60.0°处的衍射峰分别对应于Ni(OH)2的(001)、(002)、(100)、(101)、(102)和(110)晶面(JCPDS No:14-0117). 没有检测到杂质的衍射峰,表明最终产物是纯净的Ni(OH)2,且获得的产物具有高度的结晶性.
扫描电子显微镜(SEM)和透射电子显微镜(TEM)图片表明,微波辅助水热法制备的产物呈花状微球结构(图3). 由Ni(OH)2的SEM图(图3A)可知Ni(OH)2微球的平均直径约1.6 μm. 通过TEM图进一步分析Ni(OH)2的纳米结构(图3B),微球整体是均匀的,这与图3A的SEM图分析结果一致. 在图3B中,可以清楚地观察到花状Ni(OH)2微球是由Ni(OH)2片组成的.
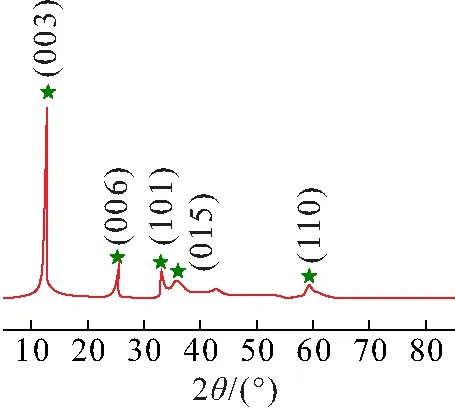
图2 Ni(OH)2的XRD谱

图3 Ni(OH)2的SEM与TEM图
为了探究合成的花状Ni(OH)2微球的比表面积与孔径分布,对实验样品进行比表面积(BET)分析(图4),结果表明:合成样品的比表面积为54.489 m2/g(图4A),且样品的表面孔径分布为5~15 nm(图4B). 这些结果充分证明花状Ni(OH)2微球具有分级多孔的纳米结构.
2.2 Ni(OH)2修饰电极的电化学测试
将Ni(OH)2修饰电极浸入0.1 mol/L的NaOH溶液中,以50 mV/s的扫描速率测试循环伏安(CV)曲线(图5),与无尿酸的循环伏安特征不同,添加0.1 mmol/L尿酸后,在循环伏安曲线中出现一对明显的氧化还原峰,说明Ni(OH)2修饰电极对尿酸有电化学响应. 第一、二圈CV曲线峰形吻合,说明所制备的电极稳定性良好.
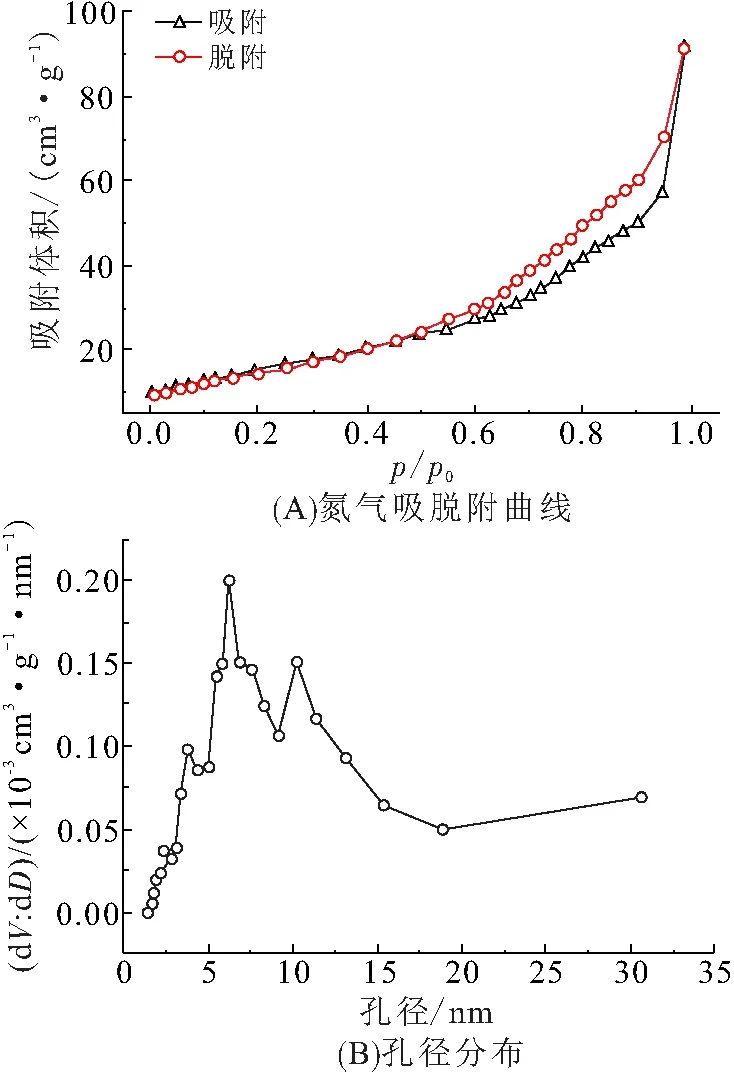
图4 Ni(OH)2的氮气吸脱附曲线和孔径分布
Figure 4 The nitrogen adsorption and desorption curve and pore size distribution of Ni(OH)2
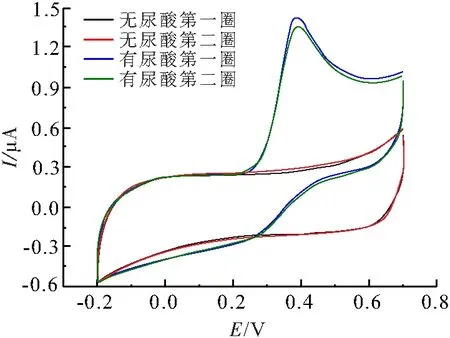
图5 在NaOH溶液中存在和不存在尿酸情况下的循环伏安曲线
Figure 5 The CVs of NaOH solutions in absence and presence of UA
注:NaOH溶液浓度为0.1 mol/L;尿酸浓度为0.1 mmol/L;扫描速率为50 mV/s.
可推测在0.1 mol/L NaOH溶液中,在0.1 mmol/L的尿酸存在情况下,在电位0.3~0.5 V之间出现的一对氧化还原峰是由Ni2+/Ni3+氧化还原反应引起的:
Ni(OH)2+ OH-→ NiOOH + H2O + e-
(4)
在含有0.1 mmol/L 尿酸的NaOH(0.1 mol/L)溶液中,通过不同扫描速率的循环伏安曲线对Ni(OH)2修饰电极反应的控速步骤进行了研究. 图6显示了该电极在扫描速率从10 mV/s到100 mV/s的CV曲线,峰形没有发生明显变化,由此可以判断出修饰电极的循环性能具有较好的可重复性.
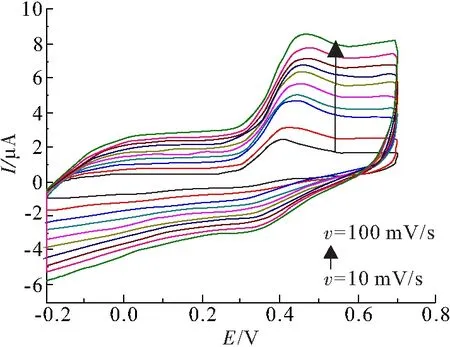
图6 Ni(OH)2电极在0.1 mol/L NaOH溶液中以不同扫描速率(10~100 mV/s)的循环伏安曲线
Figure 6 The CVs of the Ni(OH)2electrode in 0.1 mol/L NaOH solutions at different scan rates(10~100 mV/s)
根据25 ℃时氧化还原峰电流与扫描速率的关系
(5)
探究电极表面控速步骤.
图7中给出了阳极峰值电流与扫描速率的平方根(v1/2)的线性拟合图. 修饰电极的阳极峰值电流与扫描速率的平方根(v1/2)呈线性关系(R2=0.988 0),说明在Ni(OH)2修饰电极上,尿酸的氧化是一个典型的扩散控制过程. 结果表明:制备的修饰电极对尿酸具有较好的电化学催化性能.
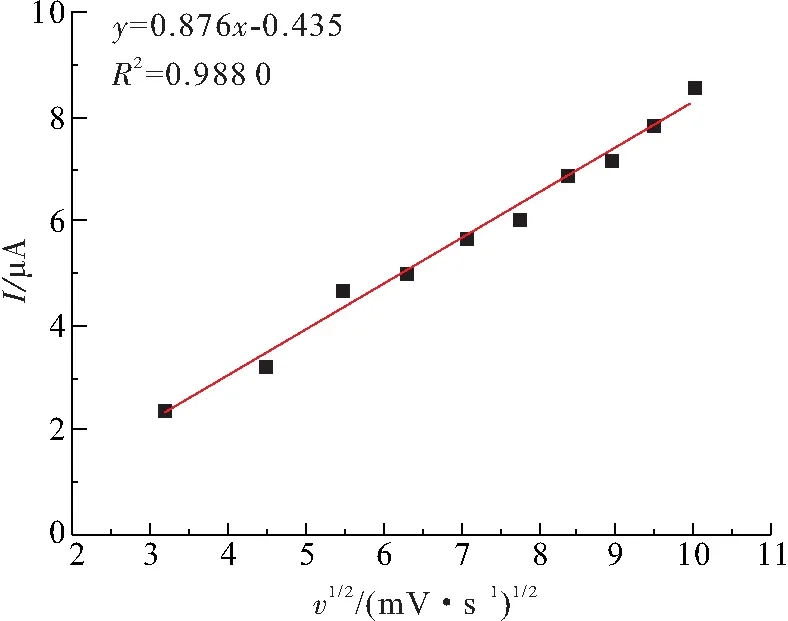
图7 氧化峰值电流与v1/2的线性拟合
Figure 7 The linear fitting curve of oxidation peak current vs. thev1/2
根据Ni(OH)2修饰电极的时间-电流曲线,探讨修饰电极对尿酸的检测性能. 本实验采用0.6 V的工作电位,在0.1 mmol/L的NaOH溶液中加入不同浓度的尿酸,在浓度0.1~1.5 mmol/L的范围内测量修饰电极的响应电流(图8),在添加尿酸后电极几乎立即响应,并在10 s内达到稳态水平,从而显示出对尿酸的快速响应特性,从侧面说明了Ni(OH)2修饰的电极对尿酸具有良好的电化学催化性能.
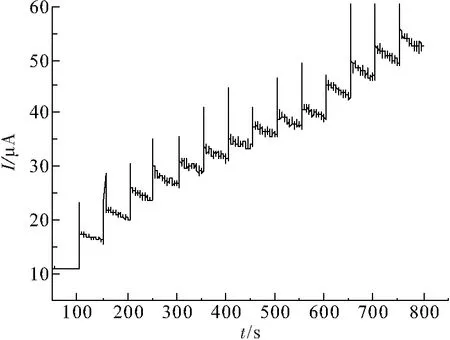
图8 Ni(OH)2电极的稳态响应曲线
Figure 8 The typical steady-state responses of the Ni(OH)2electrode
注:施加电压为0.6 V,将UA连续注入0.1 mol/L NaOH溶液中的同时进行稳态响应测试.
在加入尿酸后电流稳定的台阶中,选取后30 s的数据计算平均值,作为该浓度下的响应电流大小,以加入的尿酸浓度与响应电流作图(图9),从电流强度与尿酸浓度的线性拟合曲线可以看出,电流强度与尿酸浓度在0.1~1.5 mmol/L范围内线性相关,R2=0.996 4. 从拟合直线的斜率计算可知,灵敏度高达475.71 μA·L/(mmol·cm2). 与此同时,取3倍数据波动的标准差(S)除以斜率(k)计算出Ni(OH)2修饰电极的检出限为1.8 μmol/L(S/N=3),与目前的文献相比,本文检测尿酸浓度的检测上限较高[20-21].
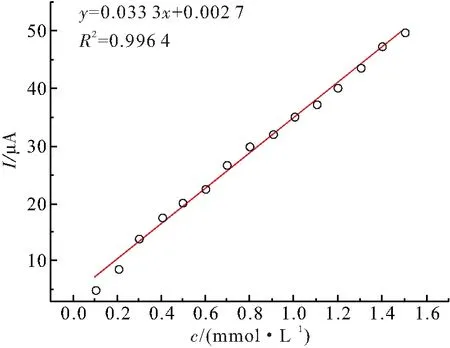
图9 不同浓度UA的电流响应校准曲线
Figure 9 The calibration curve of amperometric responses to different concentration of UA
2.3 Ni(OH)2修饰电极的抗干扰性能测试
在非酶检测中如何避免内源性干扰物是一个重大的挑战. 在尿酸检测中,其他存在的电化学活性物质可能引起干扰. 抗干扰评估结果表明,与尿酸相比,对DA、AA和Cre的反应可以忽略不计(图10),因此所制备的尿酸传感器具有显著的选择性.
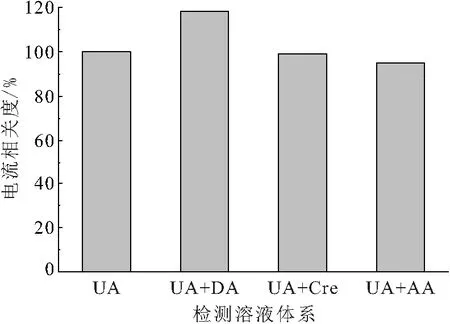
图10 含不同干扰剂的UA溶液中Ni(OH)2电极的电流响应
Figure 10 The amperometric response of the Ni(OH)2electrodes in the UA solution with different interfering agents
注:在1.5 mmol/L UA中分别添加多巴胺(DA,0.15 mmol/L)、抗坏血酸(AA,0.15 mmol/L)和肌酐(Cre,0.15 mmol/L)后进行检测.
3 结论
利用微波辅助水热法制备了Ni(OH)2微球. 所制备的Ni(OH)2由平均直径约1.6 μm的花状微球组成. 修饰电极的阳极峰值电流与扫描速率的平方根(v1/2)呈线性关系(R2=0.988),说明在Ni(OH)2修饰电极上的尿酸氧化是一个典型的扩散控制过程. 电流响应-浓度校准曲线表明,该电极对UA具有较宽的浓度检测线性范围(0.1~1.5 mmol/L),且灵敏度高(475.71 μA·L/(mmol·cm2)),相关系数R2=0.996 4,检出限为1.8 μmol/L (S/N=3). 微波辅助水热法突破了传统水热法耗时长的局限性,且Ni(OH)2修饰电极选择性较好,不易受内源性干扰物的影响. 同时,Ni(OH)2具有应用于无酶生物传感器测定尿酸浓度的潜力,从而开辟了具有实用价值的电化学方法检测尿酸的新途径.

