欧洲鳗鲡T7 噬菌体单链抗体库的构建、淘选及其在大肠杆菌中的高效表达
徐元凯,林 鹏,王艺磊,彭欣慰,冯建军
(集美大学 水产学院/鳗鲡现代产业技术教育部工程研究中心/农业部东海海水健康养殖重点实验室,福建 厦门 361021)
鳗鲡,俗称河鳗、鳗鱼,隶属辐鳍亚纲的鳗鲡目(Anguilliformes),味道鲜美,营养价值高,已成为中国、马来西亚、日本等国家重要的经济养殖鱼类[1]。目前,我国鳗鲡养殖总量约占世界的2/3,但高密度、集约化的养殖模式,引起鳗鲡病害频繁发生,严重制约鳗鲡产业的健康发展[2]。
嗜水气单胞菌(Aeromonas hydrophila)是养殖鱼类中常见的病原菌,能够引起欧洲鳗鲡(Anguilla an⁃guilla)、日本鳗鲡(Anguilla japonica)以及美洲鳗鲡(Anguilla rostrata)败血症、烂鳃病、红体病、肝脏充血等病症发生[2]。在养殖病害的防治过程中,长期使用抗生素和化学试剂会导致细菌耐药性增加、水体污染和鱼体中药物残留等问题,为解决现有养殖技术水平、养殖模式条件下的水产动物病害问题,免疫预防技术受到越来越多的关注[3]。接种疫苗能够有效激发鱼体特异性免疫应答,具有较好的免疫保护作用,是目前免疫防治的主要方法,但其特异性抗体的产生时间较长,一般7 d~14 d 之后才出现特异性抗体,且至少经过4 周后才能达到峰值[4],这对于水产养殖中暴发性的病害,以及免疫系统尚未发育完全的幼苗的免疫保护作用将受到限制。因此,利用基因工程技术大量、快速制备鱼类同源性抗体,包被后以抗体微胶囊的形式通过口服途径对鱼类疾病进行防治,有望为水产动物病害的免疫学防治开辟新思路。
噬菌体抗体库技术是一种新型抗体制备技术,该技术通过PCR 扩增抗体的全套可变区基因,再利用噬菌体展示技术将单链抗体(Single-chainantibody variable fragment,scFv)或Fab 段 展 示 在 噬 菌 体 表面,通过生物淘选和抗体活性检测后获得特异性抗体[5]。目前,构建噬菌体抗体库最常见的方法是目标动物经过抗原免疫后,构建其脾脏或外周血淋巴细胞噬菌体免疫抗体库,利用该方法已成功构建了小鼠[6]、鸡[7]等物种的scFv 库。该方法的特点是能够获得针对特定抗原的高亲和力抗体,但也存在制备周期长、抗体库多样性较低的问题[8]。噬菌体天然抗体库具有抗体库容高、多样性丰富的特点,主要通过未刺激的外周血淋巴细胞、脾脏和骨髓细胞进行构建,通过2~4 轮生物淘洗即可获得针对多种不同抗原的特异性抗体[9]。
scFv 是噬菌体抗体库中抗体形式之一,由抗体重链可变区(VH)和轻链可变区(VL)通过短多肽接头连接而成[7]。其蛋白分子量小、免疫原性低且抗体本身无Fc 结构域,可有效穿透组织屏障达到病灶部位,在人体和动物内不易引起免疫排斥,并与Fc受体的非靶细胞不易结合,在医学诊断和疾病防治等方面有广泛的应用前景[10]。
本研究利用SOE-PCR 技术构建健康欧洲鳗鲡脾脏scFv 基因库,与T7 噬菌体载体进行连接、包装后获得噬菌体scFv 库,通过生物淘洗获得针对鳗鲡主要病原菌嗜水气单胞菌的特异性抗体,克隆其编码基因,并实现在大肠杆菌中高效表达,为养殖鳗鲡病原菌的免疫防治与检测奠定了基础。
1 材料与方法
1.1 主要实验材料 欧洲鳗鲡购自福建省福清养鳗场,平均体重约为50 g。大肠杆菌BL21、载体pGEX-4T-2、嗜水气单胞菌重组外膜蛋白(Outer membrane protein,OMP)、欧洲鳗鲡抗OMP 血清及天然欧洲鳗鲡血清均由本实验室保存;T7 Se⁃lect10-3b Cloning Kit 购 自Novagen 公 司;TRIzol 试剂、限制性内切酶EcoRⅠ、Hind Ⅲ、NotⅠ购自Thermo Fisher Scientific 公司;RT-PCR 试剂盒、胶回收试剂盒、Taq DNA 聚合酶、T4 DNA 连接酶、pMD19-T 载体均购自TaKaRa 公司;辣根过氧化物酶标记山羊抗兔IgG(HRP-IgG)购自Sigma-Aldrich 公司;质粒提取试剂盒购自OMEGA 公司。
1.2 引物的设计与合成 根据GenBank 中登录的欧洲鳗鲡抗体VH 段基因序列(EF062515)、VL 段基因序列(EF031085)设计特异性引物,在VH、VL 扩增引物中引入(Gly4Ser)3Linker 接头序列(下划线部分),在VH 引物上游、VL 引物下游分别引入酶切位点EcoRⅠ、Hind Ⅲ(斜体部分);而用于原核表达的scFv 扩增引物上下游分别引入酶切位点EcoRⅠ、NotⅠ(加粗部分)。引物序列见表1,由上海捷瑞生物工程有限公司合成。

表1 欧洲鳗鲡抗体VH、VL 段及scFv 目的基因片段扩增引物Table 1 Primers sequences used for amplification of Anguilla anguilla VH,VL and scFv
1.3 欧洲鳗鲡scFv 基因的扩增 解剖健康欧洲鳗鲡取脾脏组织100 mg,用液氮研磨成粉末状,利用TRIzol 试剂提取总RNA,利用反转录试剂盒逆转录为cDNA,以此为模板,分别采用VH 引物VH-F/VH-R;VL引物VL-F/VL-R进行PCR扩增,扩增程序为:95 ℃5 min;95 ℃30 s、65 ℃30s(VL 此处为50.3 ℃)、72 ℃1 min,共38 个循环;72 ℃10 min。PCR 产物经2.0%琼脂糖凝胶电泳检测后,胶回收VH、VL 基因片段。
取获得的VH 基因(52 ng)、VL 基因(50 ng)为模板,进行SOE-PCR 扩增,通过(Gly4Ser)3Linker 将VH、VL 段拼接为完整的scFv 基因。程序为:94 ℃2 min;94 ℃30 s、62 ℃30 s、72 ℃1 min,共7 个循环;72 ℃10 min。反应结束后,在产物中各加入1 μL 的VH-F/VL-R 引 物 进 行PCR 扩 增,程 序 为:94 ℃2 min;94℃30 s、58 ℃30 s、72℃1 min,共38个循环;72℃10 min,即得到完整的欧洲鳗鲡scFv基因序列。
1.4 噬菌体scFv 库的构建 参照文献[11]进行噬菌体scFv 库的构建及库容测定。将胶回收纯化的scFv基因序列和T7 Select10-3b 噬菌体载体利用EcoRⅠ/Hind Ⅲ双酶切后进行连接。取5 μL连接产物与25 μL T7 Packaging Extracts(试剂盒提供)室温混合2 h 后加入270 μL LB 液体培养基终止反应,构建获得T7 噬菌体原始抗体库。取少量噬菌体溶液稀释后,通过平板计数法对噬菌体原始抗体库库容进行测定,并随机从平板中挑取10 个噬菌斑接种于宿主菌BLT5403,增殖后提取DNA,以VH-F/VL-R 为引物,通过PCR扩增检测scFv 基因序列与T7 Select10-3b 噬菌体载体的连接情况。宿主菌BLT5403 在含氨苄抗生素的M9TB 液 体 培 养 基 中 培 养 至OD600nm值 约0.8 后 将 剩 余的噬菌体原始抗体库全部加入,继续培养至发生溶菌,10 000 r/min 离心10 min 去沉淀,上清即为初级抗体库,取少量上清稀释后平板计数法测定噬菌体初级抗体库滴度。
1.5 噬菌体scFv 库的淘选 将嗜水气单胞菌重组OMP 用碳酸盐包被液稀释至50 μg/mL,以100 μL/孔加入酶标板4℃过夜包被,PBST 洗涤3 次后加入5%BSA 封闭酶标板1 h,加入10 μL 欧洲鳗鲡噬菌体scFv 库溶液和90 μL TBST,室温静置50 min;PBST洗涤5 次后加入200 μL T7 Elution Buffer,20 min 后将每孔溶液8 000 r/min 离心3 min,取上清于BLT5403菌液进行噬菌体扩增,取扩增后的噬菌体库重复上述淘选过程,淘选4 次后取少量上清液,稀释后铺平板。随机挑取10 个噬菌斑在宿主菌BLT5403 中进行扩增培养,破碎后取上清,即为相应的噬菌体液,命名为T7-OMP-scFv,用于后续试验。
1.6 抗体特异性的阻断ELISA 鉴定 将嗜水气单胞菌重组OMP 作为抗原进行包被,封闭及洗涤步骤同上。实验孔分别加入100 μL 等体积混合的10 个T7-OMP-scFv 噬菌体稀释液(5 倍稀释)和欧洲鳗鲡抗OMP 血清(1∶5),阴性对照孔加入100 μL 等体积混合的培养液和天然欧洲鳗鲡血清(1∶5),阳性对照孔中加入100 μL 等体积混合的培养液和欧洲鳗鲡抗OMP 血清(1∶5),每个样品设置3 个平行孔。随后于各孔中加入兔抗IgM 血清(l∶1 000),以山羊抗免HRP-IgG(l∶6 000)为二抗,进行阻断ELISA。酶标仪测定其OD450nm值,利用公式计算抑制率:抑制率(%)=[1-(实验孔OD450nm-阴性对照OD450nm)/(阳性对照孔OD450nm-阴性对照OD450nm)]×100%。并将抑制率最高的T7-OMP-scFv 噬菌体命名为OMP-scFv。
1.7 原核表达载体的构建及表达 取OMP-scFv 噬菌体稀释液10 μL 加入100 μL 10 mmol/L EDTA(pH 8.0)混匀后65 ℃水浴裂解10 min,14 000 r/min 离心3 min,上清液即为噬菌体DNA。以噬菌体DNA 为模板,通过引物OMP-scFv-F/OMP-scFv-R 进行PCR 扩增。扩增程序为:94 ℃4 min;94 ℃30 s、58 ℃30 s、72 ℃1 min,共30 个循环;72 ℃10 min。纯化回收特异性扩增产物,构建重组质粒pGEX-4T-2-OMPscFv,转化大肠杆菌BL21,并随机挑选9 株单菌落进行PCR 鉴定和测序分析。将测序鉴定正确的重组菌株接种于含有氨苄抗性的LB 液体培养基中,37 ℃180 r/min 震荡培养至OD600nm0.6~0.8,加入IPTG至终浓度1.0 mmol/L,37 ℃诱导5 h,同时设立空白对照组。细菌经超声波破碎后,进行SDS-PAGE 电泳检测目的蛋白的表达情况。
2 结 果
2.1 欧洲鳗鲡VH、VL 及scFv 基因的PCR 扩增以欧洲鳗鲡脾脏cDNA 为模板,PCR 扩增获得欧洲鳗鲡抗体VH、VL 基因,通过SOE-PCR 将VH、VL拼接为完整的scFv 基因序列。结果显示,抗体VH、VL基因大小约为400 bp,scFv大小约为700 bp,均与预期大小一致(图1)。测序结果显示欧洲鳗鲡scFv蛋白质编码序列正确,呈VH-Linker-VL 结构。表明欧洲鳗鲡scFv 基因扩增正确。
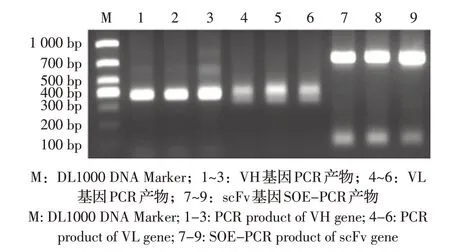
图1 欧洲鳗鲡抗体VH、VL 及scFv 基因的扩增产物Fig.1 Amplifications of Anguilla anguilla VH,VL and scFv genes
2.2 噬菌体scFv 库容测定 取3 个重复平板中噬菌斑数量的平均值,通过公式:滴度(pfu/mL)=对应稀释倍数的噬菌斑数×稀释倍数×10,计算噬菌体scFv 库滴度。结果显示原始噬菌体scFv 库滴度为42×104×10=4.2×106pfu/mL,库容为4.2×106pfu/mL×0.3 mL=1.26×106pfu(图2A);扩增后得到初级噬菌体scFv 库滴度为2.8×109pfu/mL(图2B)。为进一步验证原始噬菌体库中scFv 基因序列的插入情况,从原始噬菌体scFv 库的平板中随机挑取10 个噬菌斑,进行PCR 扩增,结果显示10 个噬菌斑均扩增出约750 bp 的scFv 基因序列(图3)。表明scFv 基因序列同T7 Select10-3b 噬菌体载体的连接效率高,噬菌体scFv 库已构建。
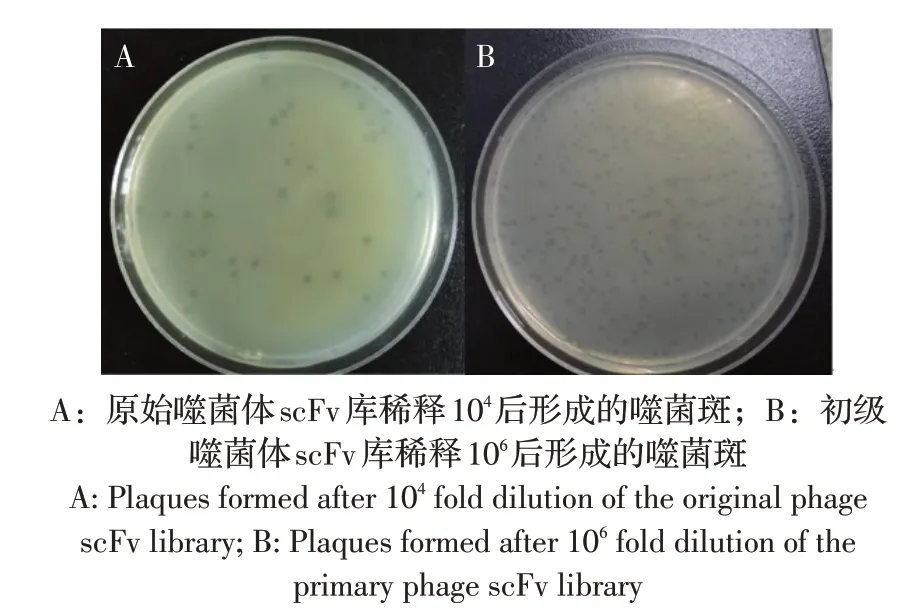
图2 噬菌体scFv 库稀释后形成的噬菌斑Fig.2 Plaques formed after dilution of the phage scFv library
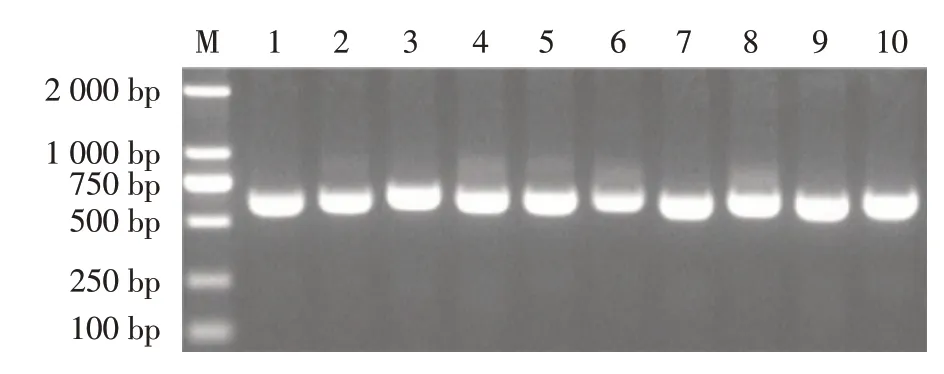
图3 随机10 个原始噬菌体scFv 库噬菌斑的PCR 鉴定Fig.3 Identification of phage scFv library's 10 random plaque by PCR
2.3 特异性scFv 的淘选 以嗜水气单胞菌OMP 作为抗原,对噬菌体scFv 库进行4 次生物淘洗。结果显示,经4 次生物淘洗后仍有较多的噬菌斑产生(图4),表明通过淘选获得了含有特异性scFv 的噬菌体。
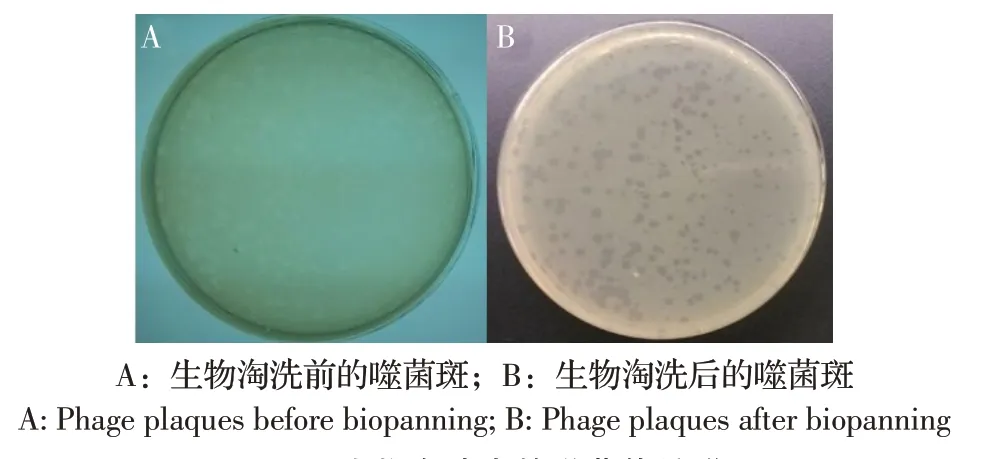
图4 生物淘洗中的噬菌体扩增Fig.4 Phage amplification in biopanning
2.4 特异性scFv 的阻断ELISA 检测结果 利用阻断ELISA 检测scFv 特异性,结果显示,随机挑取的10 个特异性噬菌体scFv 的抑制率最高达81.7%,最低为68.2%(表2)。表明淘选获得的scFv 具有较强的特异性,同时具有高亲和力。
2.5 pGEX-4T-2-OMP-scFv 的鉴定及原核表达结果 将pGEX-4T-2-OMP-scFv 转化大肠杆菌BL21,随机挑选9 株重组菌进行PCR 检测分析。结果显示,9 株菌株均扩增得到约750 bp 的scFv 目的片段(图5)。结果表明,重组质粒pGEX-4T-2-OMPscFv 构建正确。
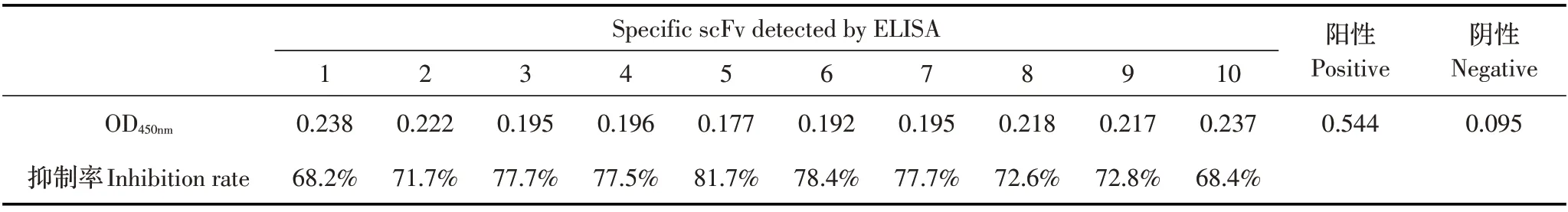
表2 阻断ELISA 检测结果Table 2 Results of blocking ELISA test
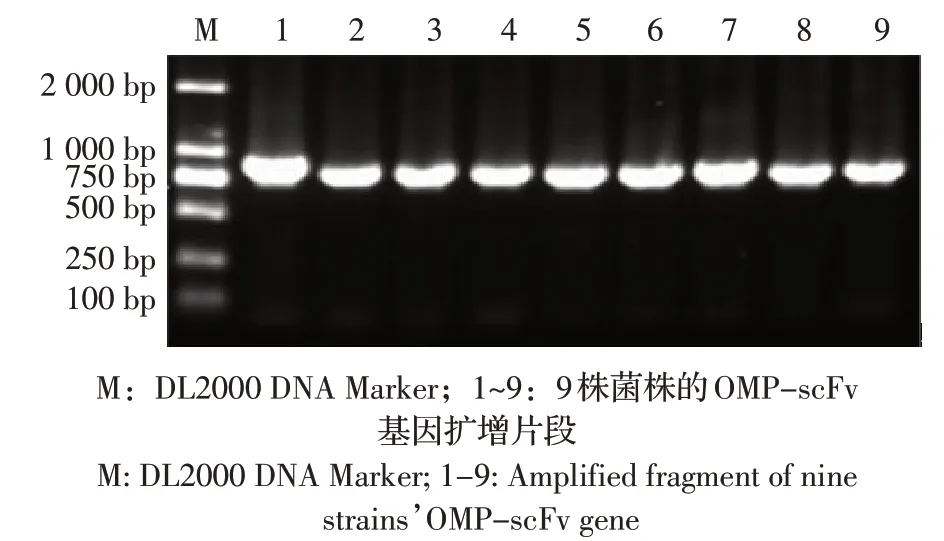
图5 转化后的大肠杆菌BL21 PCR 检测Fig.5 Identification of transformed E.coli BL21 by PCR
将pGEX-4T-2-OMP-scFv/BL21 重组菌经IPTG诱导后进行SDS-PAGE 检测。结果显示,重组菌在53 ku 处表达出明显的蛋白条带(图6),与预期大小一致。表明欧洲鳗鲡嗜水气单胞菌OMP scFv 在大肠杆菌BL21 中可以高效表达。
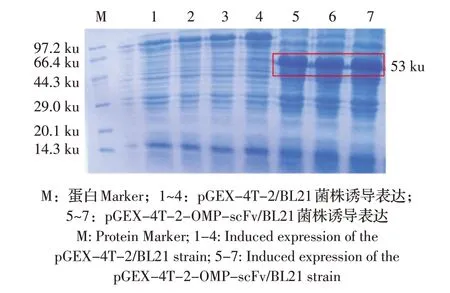
图6 IPTG 诱导表达SDS-PAGE 结果Fig.6 SDS-PAGE results of IPTG induced expression
3 讨 论
scFv 作为继单克隆抗体之后的第3 代基因工程抗体,具有分子量小,穿透力强等特点,同多克隆抗体相比特异性、多样性和定向性更高,易于大规模生产。在靶向治疗、影像诊断和生物检测等方面具有广阔的应用前景[11]。
噬菌体展示技术是将插入到单链丝状噬菌体外壳蛋白基因中的抗体可变区基因以融合蛋白形式表达呈现于噬菌体表面,可通过与相应靶抗原“吸附-洗脱-扩增”的富集过程从抗体库中快速高效地淘选到特异性抗体,是scFv 体外生成的重要途径之一[9]。目前,噬菌体抗体库在人类、家畜及家禽的病害防治与检测中发挥重要作用,但有关鱼类的噬菌体抗体库仅在斑点叉尾鮰(Ictalurus punctatus)中有所报道[12]。
高滴度的噬菌体抗体库是淘选特异性scFv 的基础,目前已有学者在斑点叉尾鮰[12]和小鼠[13]中构建了噬菌体天然抗体库,其抗体库滴度分别为5.67×107pfu/mL、1.2×109pfu/mL。本研究构建的欧洲鳗鲡噬菌体天然抗体库滴度为2.8×109pfu/mL,滴度相对较高,为淘选针对不同鳗鲡病原微生物的特异性scFv 奠定了基础。
scFv 中用于VH、VL 连接的Linker 序列对于其表达水平、亲和力和稳定性至关重要,既要避免对VH、VL 折叠和结合的干扰,也不能降低scFv 的抗原识别能力。目前,15 肽(Gly4Ser)3Linker 已被广泛应用于scFv 的制备,其所含的甘氨酸(Gly)是分子量最小、侧链最短的氨基酸,其空间位阻低的特点促进了scFv 空间结构的稳定性,而极性较强的丝氨酸(Ser),有助于增加scFv 的亲水性[14]。本研究采用(Gly4Ser)3的Linker 序列,以“VH-Linker-VL”的连接方式制备了欧洲鳗鲡噬菌体scFv 库,并通过抗原-抗体特异性结合的方式成功淘选到特异性较高的scFv,表明通过本研究选择的(Gly4Ser)3序列和scFv连接方式所获得的scFv 具有良好的亲和力和稳定的空间结构[15]。
嗜水气单胞菌是鳗鲡养殖中主要的病原菌之一,而OMP 作为革兰氏阴性细菌表面主要保护性抗原分子,具有良好的免疫原性,能够刺激宿主进行细胞免疫和体液免疫[2,16],因此通过鳗鲡嗜水气单胞菌OMP 对噬菌体scFv 库进行淘选获得特异性scFv,对于养殖鳗鲡的病害防治与检测具有重大意义。对于特异性scFv 的淘选,目前的主要方法有固相淘选和液相淘选两种,其中固相淘选以其操作简单易行,获得scFv 特异性更高的特点,在噬菌体scFv 库的淘选中被广泛应用[10]。此外,已有的研究表明淘选特异性scFv 的最佳生物淘选次数为3~4 轮,过多次数的淘选可能导致特异性scFv 的减少[17]。本研究采用固相淘选方式,对构建的噬菌体scFv 库进行了4 轮生物淘洗,从多个噬菌斑中随机挑取的10 个均具有较高特异性,表明该淘洗方法简单可行。
大肠杆菌原核表达系统具有繁殖快、表达量高等优点,是目前应用最广泛的蛋白表达系统,具有良好的成本效益和扩展性。本研究实现了高特异性的欧洲鳗鲡嗜水气单胞菌scFv 在大肠杆菌BL21 中的高效表达,有利于后续性鱼源基因工程抗体的大量制备,为基因工程抗体制剂应用于鳗鲡病害的免疫防治与病原菌ELISA 检测试剂盒等的研制奠定了基础。

