RIP1介导的坏死性凋亡通过NF-κB通路调节肾小管上皮细胞炎症反应*
方晓旭,杜春阳,宋 珊,史永红,任韫卓,段惠军
(河北医科大学病理教研室,河北石家庄050017)
慢性肾脏疾病(chronic kidney disease,CKD)的发生率持续升高,并且严重影响患者的生活质量,肾脏持续的炎症反应与CKD的发生发展密切相关[1]。坏死性凋亡(necroptosis)是细胞程序性死亡的一种新形式[2],同时具有坏死和凋亡的特征,它是由受体相互作用蛋白(receptor-interacting protein,RIP)调控的非caspase依赖性的细胞死亡模式,其中,RIP1在坏死性凋亡信号转导中起到了关键作用。在疾病等机体异常状态下,caspase-8生成显著增多,启动了机体的凋亡信号通路。Z-VAD-FMK是一种泛caspase抑制剂[3],它可以完全抑制RIP1介导的procaspase-8蛋白水解活化,使机体凋亡信号通路被阻断,进而使凋亡转化为坏死性凋亡。不同的刺激与坏死性凋亡有关,最具特征的是肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),TNF-α联合Z-VAD-FMK(T/Z)是诱导坏死性凋亡的经典模型[4-5]。新近研究发现,坏死性凋亡参与了急性胰腺炎[6]、肝炎[7]及克罗恩病[8]的炎症反应,但在肾小管上皮细胞中,坏死性凋亡与炎症关系如何,目前尚不清楚。我们在前期研究中发现,坏死性凋亡抑制剂necrostatin-1(Nec-1)能够减轻单侧输尿管梗阻小鼠的肾脏炎症反应[9],提示坏死性凋亡在肾小管细胞的炎症反应中具有关键调控作用,但具体的调控机制还未明确。吡咯烷二硫代氨基甲酸铵(ammonium pyrrolidinedithiocarbamate,PDTC)是一种选择性核因子κB(nuclear factorκB,NF-κB)抑制剂和抗氧化剂[10-11],可以抑制许多细胞类型中NF-κB的活化,进而抑制NF-κB通路。本研究在前期实验基础上,采用T/Z刺激体外培养的肾小管上皮细胞,构建坏死性凋亡的细胞模型;进一步用Nec-1和PDTC干预细胞,深入探讨坏死性凋亡对T/Z刺激的肾小管上皮细胞炎症反应的调控机制。
材料和方法
1 细胞
人肾小管上皮HK-2细胞购自美国标准生物品收藏中心。低糖型DMEM培养基和DMEM/F12培养基1∶1配制,常规培养。分别给予HK-2细胞TNF-α(50 μg/L)、Z-VAD-FMK(50 μmol/L)、Nec-1(50 μmol/L)和PDTC(20 μmol/L)处理,于24 h后收集细胞观察,重复细胞实验5次。
2 主要药品与试剂
TNF-α购自 PeproTech;Z-VAD-FMK和 Nec-1购自MCE;PDTC购自Abcam;RIP1过表达质粒由Addgene公司惠赠;鼠源抗 RIP1、NF-κB p65、p-NF-κB p65、IκB激酶(IκB kinase,IKK)、白细胞介素1β(interleukin-1β,IL-1β)和单核细胞趋化蛋白 1(monocyte chemoattractant protein-1,MCP-1)多克隆抗体购自Abcam;兔源多克隆抗caspase-3抗体购自Cell Signaling Technology;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒购自Promega;Lipofectamine 3000转染试剂盒和Opti-MEM培养基购自Thermo Fisher;IL-1β和MCP-1 ELISA试剂盒购自武汉六合生物公司;反转录试剂盒购自Promega;Real-time PCR SYBR Premix Ex TaqTMⅡ试剂盒购自TaKaRa。
3 主要方法
3.1 Western blot检测蛋白水平 细胞用冰冷的PBS洗2遍,然后加入200 μL预冷的RIPA蛋白裂解缓冲液,冰浴30 min,用细胞刮均匀刮起细胞,收集到1.5 mL的EP管内,4℃、12 000 r/min离心25 min,BCA法测定上清液蛋白浓度。按每孔30 μg细胞裂解蛋白上样,SDS-PAGE分离,将蛋白转至PVDF膜上;5%脱脂奶粉37℃孵育1 h封闭PVDF膜,加入抗RIP1(1∶1 000)、caspase-3(1∶800)、IKK-α(1∶5 000)、NF-κB p65(1∶900)、p-NF-κB p65(1∶1 000)、IL-1β(1∶1 000)和MCP-1(1∶1 000)抗体,4℃过夜;室温孵育1 h,洗膜后加入辣根过氧化物酶标记的山羊抗小鼠或山羊抗兔II抗(1∶5 000稀释),37℃孵育1.5 h;洗膜后加入Pro-light HRP化学发光试剂,Odyssey Fc成像系统显影,用UVP LabWorks 4.5分析软件对Western blot条带进行定量分析。
3.2 乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测 HK-2细胞接种于96孔板,刺激24 h后,收集细胞培养基上清,250×g离心4 min,分别取50 μL上清液于新的96孔板中,在各孔中加入50 μL CytoTox 96室温避光孵育30min后,再加入50 μL终止液,用酶标仪于490 nm波长处检测吸光度(A)值,LDH从细胞内的释放量用细胞坏死百分比表示。
3.3 细胞转染 构建RIP1过表达质粒,待细胞密度60%~70%进行转染,准备A、B两个2 mL的EP管,A管中加入125 μL Opti-MEM培养基和5 μL Lipofectamine 3000 Reagent,B 管 中 加 入 125 μL Opti-MEM培养基、5 μL P3000 Reagent及1 μg RIP1质粒,A、B管混匀,于细胞超净台上放置5 min,将混合液加入细胞培养皿中,转染6 h做后续处理。
3.4 ELISA测定 收集细胞培养基,1 000×g离心25 min,各取50 μL上清于ELISA板中,再在每孔中加入100 μL辣根过氧化物酶标记的检测抗体,密封条件下,37℃孵育60 min。弃去孔内液体,用洗涤液重复洗5次,再向每孔中加入50 μL底物A、B,37℃避光孵育15 min。在每孔中加入50 μL终止液,在450 nm波长处测定每孔的A值。
3.5 real-time PCR TRIzol法提取细胞总RNA后按试剂盒步骤反转录为cDNA。实时定量PCR采用20 μL反应体系:SYBR Premix Ex Taq Ⅱ 10 μL,ROX Reference Dye 0.4 μL,cDNA 2 μL,上、下游引物各0.8 μL,ddH2O 6 μL。反应条件为:95℃ 30 s;95℃5 s,55℃ 30 s,72℃ 30 s,共40个循环。使用3个复孔的Ct值取平均值,采用公式2-ΔΔCt计算mRNA表达的相对倍数变化。
4 统计学处理
用SPSS 21.0软件进行统计学分析,数据均采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 T/Z条件下RIP1介导HK-2细胞坏死性凋亡
Western blot结果显示,T组HK-2细胞坏死性凋亡相关指标RIP1和凋亡相关指标cleaved caspase-3的蛋白水平均增加,T/Z组RIP1的蛋白水平进一步增加,而cleaved caspase-3的蛋白水平降低(P<0.01),见图1A。LDH细胞毒性实验结果显示,与control组相比,T组HK-2细胞坏死百分比显著增加(P<0.05),T/Z组细胞坏死百分比进一步增加(P<0.01);与T/Z组相比,再加入Nec-1干预后(T/Z+N组)细胞坏死百分比显著下降到(P<0.01),见图1B。上述结果提示T/Z可以诱导HK-2细胞发生坏死性凋亡。
Western blot结果显示,与control组相比,转染RIP1过表达质粒(RIP1+)组HK-2细胞中RIP1的蛋白表达水平明显增高,见图1C。转染RIP1过表达质粒后,T/Z条件下(T/Z+RIP1+组)的HK-2细胞坏死百分比进一步增加(P<0.01),见图1D。上述结果提示RIP1介导了T/Z条件下HK-2细胞的坏死性凋亡。
2 T/Z条件下RIP1介导的坏死性凋亡对HK-2细胞IL-1β和MCP-1蛋白水平的影响
Western blot及ELISA结果显示,与control组相比,T/Z组HK-2细胞的IL-1β和MCP-1蛋白水平增高;与T/Z组相比,Nec-1干预下调IL-1β和MCP-1的蛋白水平;反之,转染RIP1过表达质粒明显上调IL-1β和MCP-1的蛋白水平(P<0.01),见图2。
3 T/Z条件下RIP1介导的坏死性凋亡对HK-2细胞NF-κB通路的影响
Western blot结果显示,与control组相比,T/Z组HK-2细胞中NF-κB通路相关蛋白IKK-α和NF-κB p65的水平增高,同时p-NF-κB p65蛋白水平也增高,再给予Nec-1干预则上述蛋白水平降低(P<0.01);与T/Z组相比,转染RIP1过表达质粒可明显上调HK-2细胞中上述蛋白的水平(P<0.01),见图3A。real-time PCR结果显示,与control组相比,T/Z组HK-2细胞中NF-κB的mRNA表达水平增高,再给予Nec-1干预则NF-κB的mRNA表达水平下降(P<0.01);与T/Z组相比,转染RIP1过表达质粒可明显上调HK-2细胞中NF-κB的 mRNA表达水平(P<0.01),见图3B。这提示在T/Z条件下,RIP1介导的HK-2细胞坏死性凋亡激活了NF-κB通路。
4 T/Z条件下NF-κB通路参与RIP1介导的HK-2细胞炎症
Western blot结果显示,与control组相比,T/Z组HK-2细胞中 NF-κB 通路相关蛋白 IKK-α、NF-κB p65、p-NF-κB p65及下游分子IL-1β和MCP-1的水平增高,再给予PDTC干预后(T/Z+P组),上述蛋白水平降低(P<0.01);PDTC和Nec-1联合干预HK-2细胞后(T/Z+P/N组),上述蛋白水平降低更明显(P<0.01),见图4。这提示在T/Z条件下,NF-κB通路可能参与RIP1介导的HK-2细胞炎症。
讨 论
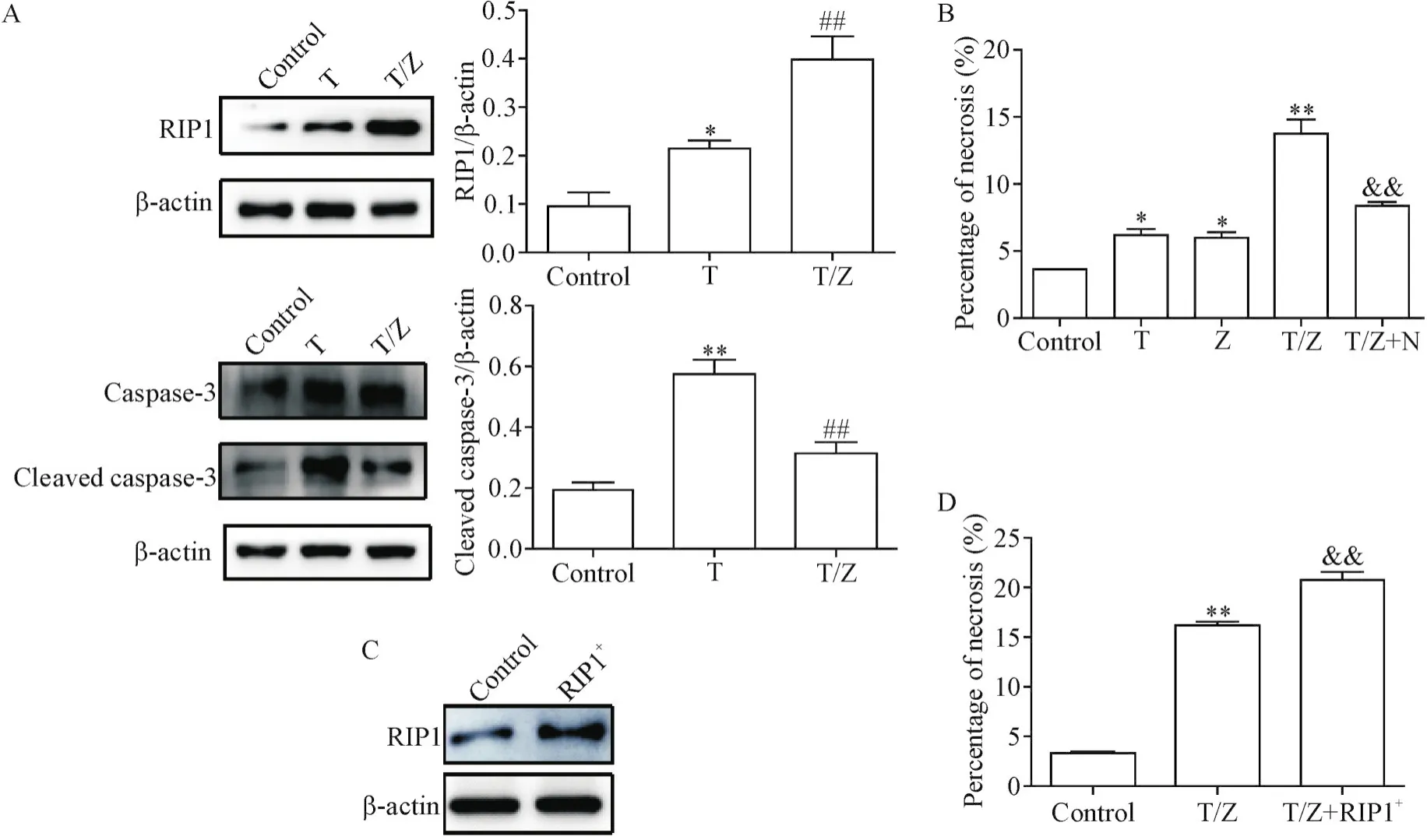
Figure 1.RIP1 mediated necroptosis of HK-2 cells under T/Z condition.A:Western blot was used to determine the protein levels of RIP1 and caspase-3;B:the release rate of LDH under T/Z and T/Z+N conditions;C:Western blot analysis of transfection of RIP1 over-expression plasmid in the HK-2 cells;D:the release rate of LDH in T/Z-treated cells with or without RIP1 over-expression.Mean±SD.n=5.*P<0.05,**P<0.01 vs control group;##P<0.01 vs T group;&&P<0.01 vs T/Z group.图1 T/Z条件下RIP1介导HK-2细胞坏死性凋亡
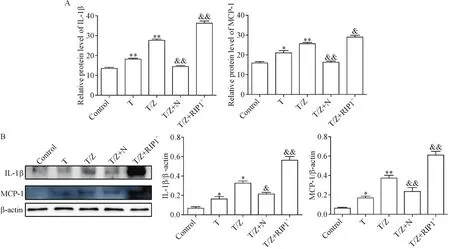
Figure 2.The relationship between RIP1-mediated necroptosis of HK-2 cells and inflammation under T/Z condition.A:the levels of IL-1β and MCP-1 in the supernatant were measured by ELISA;B:Western blot results showed IL-1β and MCP-1 levels in cells.Mean±SD.n=5.*P<0.05,**P<0.01 vs control group;&P<0.05,&&P<0.01 vs T/Z group.图2 T/Z条件下RIP1介导的HK-2细胞坏死性凋亡和炎症的关系

Figure 3.The relationship between RIP1-mediated necroptosis of HK-2 cells and NF-κB pathway under T/Z conditions.A:NF-κB pathway-related proteins were determined by Western blot;B:the mRNA expression of NF-κB was detected by real-time PCR.Mean±SD.n=5.**P<0.01 vs control group;&P<0.05,&&P<0.01 vs T/Z group.图3 T/Z条件下RIP1介导的HK-2细胞坏死性凋亡和NF-κB通路的关系

Figure 4.NF-κB pathway was involved in RIP1-mediated HK-2 cell inflammation under T/Z condition.The protein levels of NF-κB pathway-related molecules in the HK-2 cells were detected by Western blot.Mean±SD.n=5.**P<0.01 vs control group;&&P<0.01 vs T/Z group;++P<0.01 vs T/Z+P group.图4 T/Z条件下NF-κB通路参与RIP1介导的HK-2细胞炎症
坏死性凋亡是一种受调节的细胞死亡类型,其与坏死具有相似的形态学特征(早期包膜完整性破坏,细胞体积及胞内细胞器肿胀)[2],而坏死是一种被动的,不受管制的细胞死亡形式。在质膜透化后,一般FasL/TNF通过激活Fas/TNFR1死亡结构域,相继形成RIP1的TNFR复合体Ⅰ和TNFR复合体Ⅱ,继而活化caspase级联反应而启动常规的细胞凋亡。但在此途径中TNFR复合体Ⅱ中的RIP1会与RIP3紧密结合并相互磷酸化,活化的RIP3进一步导致其底物混合谱系激酶结构域样蛋白磷酸化[12],触发细胞通透化和细胞破坏,继而启动坏死性凋亡。T/Z是经典的坏死性凋亡模型[4-5]。Z-VAD-FMK是一个泛caspase抑制剂,TNF-α诱导的procaspase-8蛋白水解活化被Z-VAD-FMK完全抑制,使得RIP1的裂解减少,进而使细胞发生坏死性凋亡。LDH是一种极为稳定的细胞质酶,存在于正常细胞的胞质中,正常时不能通过细胞膜,当细胞受损或死亡时可释放到细胞外,所以细胞死亡数目与细胞培养上清中的LDH活性成正比。本研究发现单独给予HK-2细胞TNF-α刺激,可以同时发生坏死性凋亡和凋亡,TNF-α和Z-VAD-FMK联合刺激HK-2细胞,凋亡途径受到抑制,坏死性凋亡途径被激活;进一步转染RIP1过表达质粒,T/Z+RIP1+组与T/Z组相比HK-2细胞坏死百分比显著升高,提示T/Z条件下RIP1介导了HK-2细胞坏死性凋亡。
坏死性凋亡参与多种疾病炎症的发生,如心力衰竭[13]、克罗恩病[8]、肝炎[7]、急性胰腺炎[6]、急性肾损伤[14]、顺铂治疗小鼠的肾功能障碍[15]及糖尿病心肌病[16]等。本研究发现TNF-α和Z-VAD-FMK联合刺激HK-2细胞后IL-1β和MCP-1的表达水平均有明显提高,提示在T/Z条件下,RIP1介导的HK-2细胞坏死性凋亡的发生与炎症有关,但坏死性凋亡调节炎症的机制报道尚少。
Nec-1是一种有效的RIP1抑制剂[17-18],能够抑制RIP1的活化,并随后阻断坏死体的形成,最终阻断坏死性凋亡。本研究发现给予T/Z组HK-2细胞Nec-1干预后细胞坏死百分比显著减少,NF-κB的mRNA表达水平下降,NF-κB通路相关蛋白IKK-α、NF-κB p65和p-NF-κB p65的蛋白水平也明显降低,提示在T/Z条件下,RIP1介导的HK-2细胞坏死性凋亡激活了NF-κB通路。
PDTC是NF-κB的特异性抑制剂[10-11],可通过抑制NF-κB p65亚单位或IκB的降解来抑制NF-κB的激活。我们进一步给予T/Z组HK-2细胞PDTC干预,NF-κB 通路相关蛋白 IKK-α、NF-κB p65、p-NF-κB p65、IL-1β和 MCP-1的蛋白水平降低,Nec-1和PDTC联合干预HK-2细胞,对上述指标的抑制程度更显著。这提示在T/Z条件下,NF-κB通路可能参与RIP1介导的HK-2细胞炎症。
综上所述,RIP1介导的坏死性凋亡可以诱导肾小管上皮细胞发生炎症反应;NF-κB通路可能参与这一过程,抑制NF-κB通路可以减轻RIP1介导的坏死性凋亡引发的肾小管炎症反应。这些结果可为慢性肾脏疾病的治疗提供新的思路。
——一道江苏高考题的奥秘解读和拓展

