肥胖症患者血清内毒素水平与胰岛素抵抗的相关性研究*
李 影 刘 彦 王 艳 罗 娜 陶俊贤 张真稳 孙晓芳
江苏省苏北人民医院内分泌代谢科,江苏省扬州市 225001
肥胖被认为是21世纪最重要的公共卫生问题之一。据世界卫生组织统计,2014年,全球有超过19亿超重成人,而有4 100万儿童(<5岁)处于超重或肥胖状态[1]。肥胖患者长期处于慢性非特异性低度炎症状态,且这种低度炎症与传统的炎症反应不同,是由营养物和代谢过剩触发。脂肪组织由不同种类的细胞组成,其中免疫细胞在肥胖相关的低度炎症状态中具有重要作用。研究发现,脂肪细胞功能失调加速脂质向骨骼肌和肝脏溢出,导致异位脂肪沉积和胰岛素抵抗(Insulin resistance,IR)[2]。此外,脂肪组织还可以分泌游离脂肪酸和炎症因子,如肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、C反应蛋白(C-reactive protein,CRP)和瘦素等,从而干扰胰岛素信号系统,诱导IR[3]。然而,炎症、肥胖和2型糖尿病(Type 2 diabetes mellitus,T2DM)的触发因素仍有待进一步阐明。
核转录因子κB(Nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)在细胞炎症反应、免疫应答及炎症相关靶基因的调控中起着重要作用。脂多糖(Lipopolysaccharide,LPS)又称为“代谢性内毒素”,它是革兰氏阴性菌(如拟杆菌)的细胞壁成分,能引起促炎因子在不同组织中的表达,被认为是NF-κB活性的诱导物和引起肥胖慢性低度炎症的潜在因素[4]。LPS与靶组织,如脂肪、骨骼肌和肝脏等上面特定的受体相互作用,诱导炎症因子的分泌,并且负反馈调节胰岛素信号转导过程[5]。目前,关于肥胖患者LPS水平的直接报道甚少。本研究旨在分析肥胖患者LPS的水平,并探讨影响LPS的因素及其与体质量指数(Body mass index,BMI)、体脂分布、胰岛素抵抗的关系。
1 资料与方法
1.1 一般资料 选取2018年6月—2019年7月在我院内分泌就诊及体检中心检查的肥胖症患者49例(肥胖组,BMI≥28),健康体检者21例(正常对照组,BMI 18.5~23.9 )。纳入标准:(1)年龄为18~45岁;(2)肥胖的诊断依据中国成人肥胖防治专家共识,BMI≥28;(3)所有受试者经75g口服葡萄糖耐量试验(OGTT),证实空腹血糖(Fasting plasma glucose,FPG)<6.1mmol/L,餐后2h血糖(2hPG)<7.8mmol/L;(4)腰围:男性>90cm,女性>85cm;(5)血压<140/90mmHg(1mmHg=0.133kPa),总胆固醇<6.0mmol/L。 排除标准:(1)继发性肥胖;(2)急慢性感染性疾病、自身免疫性疾病、急性心脑血管疾病、肿瘤病史;(3)合并严重的心、肺、肾等基础疾病;(4)近半年有服用可能影响胰岛素敏感性的药物,激素及免疫抑制剂服药史,近期外科手术史;(5)妊娠、哺乳期或长期口服避孕药者。所有受试者体重至少稳定3个月以上,受试者均签署伦理委员会批准的知情同意书。
1.2 研究方法 采集受试者现病史、既往史、家族史,测量身高、体重、腰围、臀围,计算BMI和腰臀比(Waist-hip ratio,WHR)。所有受试者禁食8h后留取清晨空腹肘静脉血,采集上清液,及时放置于-80℃冰箱内保存。采用全自动生化分析仪(日本日立公司)检测FPG、空腹胰岛素(Fasting insulin,FINS)、总胆固醇(Total cholesterol,TC)、总甘油三酯(Total triglycerides,TG)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、丙氨酸转氨酶(Alanine transaminase,ALT)、天冬氨酸转氨酶(Aspartate aminotransferase,AST)和尿酸(Uric acid,UA)。采用鲎试剂盒(北京EKT205)检测血清LPS。计算稳态模型评估胰岛素抵抗指数(Homeostasis model assessment of insulin resistance index,HOMA-IR)。HOMA-IR=FPG(mmol/L)×FINS(mIU/L)/22.5。以HOMA-IR≥2.69作为判定胰岛素抵抗的切点[6]。
1.3 身体成分测定 于空腹状态下通过 Inbody770(韩国 Biospace 公司)测定所有受试者的身体成分。在温度和湿度合适的环境中进行(10~40℃,30%~75%RH,70~106kPa),身体内安装有起搏器或金属支架者禁做该项检查。所有受试者测试前禁食禁水至少8h,着轻便衣物,去除佩戴的金属物品,赤脚站立于足部电极对应位置上,双手分别持手部电极自然垂下与身体分开,测试时间为 30~60s,所有受试者测定过程均由同一个经过培训的医师完成。
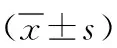
2 结果
2.1 两组一般资料和身体成分比较 两组受试者的年龄、性别构成差异无统计学意义(P>0.05),具有可比性。肥胖组患者的体重、BMI、腰围、臀围和WHR均显著高于正常对照组,差异有统计学意义(P<0.01),见表1。身体成分分析表明,肥胖组受试者体脂肪含量(Body fat,BF)、去脂体重(Fat free mass,FFM)、骨骼肌(Skeletal muscle mass,SMM)、体脂百分比(Percent body fat,PBF)、内脏脂肪面积(Visceral Fat area,VFA)和基础代谢率(Basal metabolic rate,BMR)的水平均较正常对照组显著升高,差异有统计学意义(P<0.01),见表1。
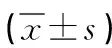
表1 两组一般资料和身体成分指标的比较
注:a表示独立样本t检验;b表示Mann-WhitneyU检验。
2.2 两组临床生化指标比较 两组受试者FPG比较差异无统计学意义(P>0.05),见表2。肥胖组患者FINS及 HOMA-IR水平显著高于正常对照组,且肥胖组81.63%的患者存在胰岛素抵抗,与正常对照组比较差异均具有统计学意义(P<0.01),见表2。
与正常对照组比较,肥胖组患者的TG、TC、LDL-C、ALT、UA和LPS水平显著升高(P<0.01),见表2和图1。同时,肥胖组患者HDL-C水平显著低于正常对照组,而两组AST水平无显著性差异,见表2。
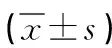
表2 两组临床指标的比较
注:a表示独立样本t检验;b表示Mann-WhitneyU检验。
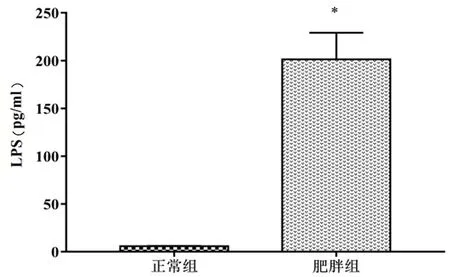
图1 两组血清LPS水平比较
注:*表示差异有统计学意义,P<0.01。
2.3 血清LPS和临床指标的相关性分析 Pearson相关性分析显示:血清LPS水平与体重、BMI、BF、PBF、FFM、SMM、VFA、腰围、臀围、WHR、BMR、FINS、HOMA-IR、TG、TC、LDL-C水平均呈正相关(P<0.05),与HDL-C呈显著负相关,与性别、年龄、FPG无相关性,见表3。
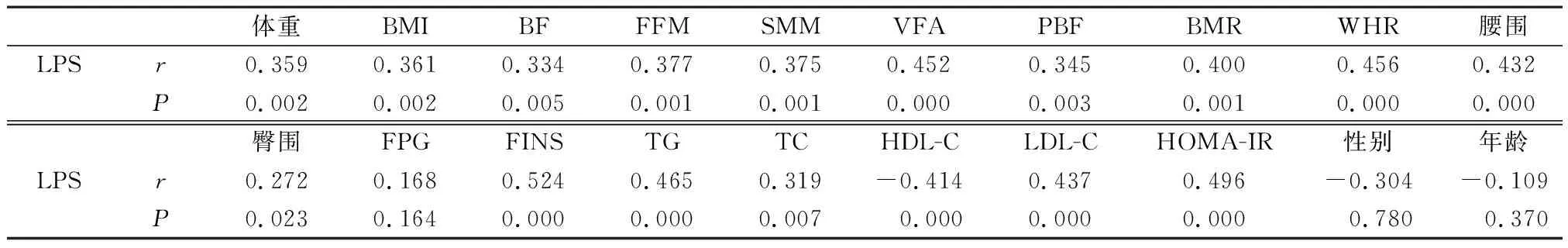
表3 LPS与代谢指标相关性分析
注:Pearson相关分析。
2.4 血清内毒素和临床指标的相关性分析 以LPS为因变量,以BMI、BF、VFA、WHR、FINS、HOMA-IR、TG、TC、LDL-C、HDL-C为自变量,校正年龄、性别后行多元逐步回归分析,结果显示,HOMA-IR、WHR是LPS的独立影响因素,见表4。

表4 LPS为因变量的多元逐步回归分析
3 讨论
胰岛素抵抗是一种与肥胖密切相关的病理状态,加重T2DM及代谢综合征的发病。HOMA-IR通常被用作评估IR的一种替代方法,这种方法更方便、简单、快速和经济[7]。本研究发现,与正常对照组相比,49例肥胖症虽经OGTT试验排除糖尿病,但受试者HOMA-IR平均水平为6.35±3.79,且有40例受试者HOMA-IR>2.69,提示肥胖组患者均伴有不同程度的胰岛素抵抗。研究发现,腰围是青少年肥胖患者空腹胰岛素水平和IR的简单预测因子;而且,腰围与肥胖患者的糖脂代谢紊乱密切相关[8]。本研究发现,肥胖组腰围平均水平(119.38±14.02)cm,WHR平均水平为1.01±0.07,提示肥胖组受试者多存在腹型肥胖(即中心型肥胖)的特征。
肥胖患者血循环中会出现多种炎症介质水平的增加,如CRP、IL-6、IL-8、TNF-α、纤溶酶原激活物抑制剂-1等,但却没有典型的红、肿、热、痛炎症反应。因此,这种“慢性炎症”称为“低度炎症”或称为“代谢性炎症”。LPS又被称为“代谢性内毒素”,可能是导致肥胖患者的低度炎症的关键因素。LPS水平增加,可通过接头蛋白MyD88激活Toll样受体4(Toll-like receptor4,TLR4)通路导致免疫细胞活化和炎症反应[9]。本研究发现,在排除其他感染因素外,肥胖组空腹血清LPS水平显著高于健康对照人群,进一步证实肥胖人群处于慢性炎症状态。为了进一步研究血清LPS的影响因素,通过简单相关分析我们发现,血清LPS水平与BMI、体脂肪含量、体脂百分比、内脏脂肪面积、WHR、HOMA-IR代谢指标均呈正相关;多元线性回归分析发现,HOMA-IR、WHR是LPS的影响因素。
LPS介导的胰岛素抵抗状态可能与肠道菌群的变化有关。肠道菌群通过核转录因子、炎症级联反应—NF-κB通路调节真核细胞宿主的免疫反应。NF-κB是转录调节因子,当NF-κB 摆脱IκB束缚后,NF-κB可以诱导各种细胞因子、趋化因子和黏附分子转录,诱导细胞炎症因子及免疫细胞聚集启动炎症反应。健康机体中肠道菌群抑制NF-κB-IκB解体,使得NF-κB不能进入细胞核,从而减轻炎症反应,血循环LPS浓度维持在正常水平[10]。研究发现,持续高脂饮食喂养4周后,小鼠肠道微生物菌群组成发生改变,双歧杆菌和真细菌的数量减少,而循环中LPS水平增加2~3倍,小鼠体重显著增加,出现肥胖表型并伴有IR[11]。而LPS受体(CD14-/-)缺乏的小鼠在正常饮食状态下能保持胰岛素敏感性,同时能抵抗慢性炎症状态,提示CD14可能在生理条件下调节胰岛素敏感性[11]。研究也发现,将健康体型小鼠的肠道菌群移植给代谢综合征的小鼠体内,可显著改善小鼠胰岛素敏感性。因此,高糖高脂诱导肥胖的发生,引起肠道菌群紊乱,导致肠源性LPS水平的增加;而持续增高的LPS水平引发机体低度炎症状态,进而促进IR发生,加重糖脂代谢紊乱。
综上所述,本研究结果表明,肥胖人群多合并高胰岛素血症或胰岛素抵抗,血清LPS水平显著高于健康人群,机体处于慢性低度炎症状态;同时研究还发现,HOMA-IR、WHR水平是影响血清LPS水平的重要因素。提示我们在临床诊疗过程中,对于合并高血清水平LPS的肥胖人群尽可能进行有效的干预、预防和治疗,以期待早期改善胰岛素抵抗,延缓糖尿病等代谢性疾病的发生或发展。后续将会进行更深入的基础研究来探讨肠道菌群和肥胖等代谢性疾病的发生发展,以便更好地指导临床实践。

