羊踟蹰提取物对金黄色葡萄糖球菌的抑菌机制研究*
蒋利荣,覃 玥,诸葛臣林,甘恩战,黄芳玉
(1 河池学院化学与生物工程学院,广西 河池 546300; 2 广西高校微生物与植物资源开发重点实验室,广西 河池 546300)
羊踟蹰为我国传统中药材,其又被称为三钱三、闹羊花、黄杜鹃、八厘麻等,为杜鹃花科杜鹃花属木本植物[1-2]。黄杜鹃全株都具有毒性,民间多以杜鹃花朵及果实入药,但毒性大使用受限,而杜鹃花科植物的根部,即羊踟蹰毒性相对较弱,药性药力与花果差异不大。羊踟蹰具有祛风、止咳、散瘀和止痛等功效,用于风寒湿痹,跌打损伤,痔漏,癣疮[5-6],且对类风湿性关节炎有一定疗效[7]。据《中药大辞典》记载, 羊踯躅的根可用于治疗驱风、除湿、消肿、风寒湿痹、痔漏、癣疮等病, 还曾用于治疗慢性支气管炎[8]。现代药理研究具有抗炎抗风湿作用、免疫作用、解热镇痛作用,降低血压减慢心率作用,杀虫灭螺作用[9],民间常用于治疗足癣等。前期的研究发现羊踟蹰根提取物对革兰氏阴性菌和阳性菌均有较好的抑菌效果,本研究通过平板法和二倍稀释法确定抑菌活性及MIC,通过羊踟蹰提取物作用后菌液电导率大小以及核酸含量变化研究其对细胞膜通透性的影响,通过扫描电镜观察其对菌体形态的影响,多方面阐述羊踟蹰提取物对金黄色葡萄糖球菌的抑菌机制。
1 实 验
1.1 材料与试剂
羊踟蹰药材购自宜州市中药材市场,金黄色葡萄球菌保存于学校实验室。
无水磷酸氢二钠、磷酸二氢钾、氯化钾、和牛肉膏、吐温80、氢氧化钠、琼脂、戊二醛、盐酸和95乙醇,以上试剂均为分析纯。
1.2 仪器与设备
DLSB-5/20低温冷却液循环泵,郑州长城科工贸有限公司;SBC-12小型离子溅射仪,北京中科科仪股份有限公司;TDL-5-A离心机,上海安亭科学仪器厂;Phenom ProX台式扫描电镜,复纳科学仪器(上海)有限公司;ZHFY-I乙酸乙酯皂化反应测定装置,南京桑力电子设备厂;Xmark酶标仪,Bio-Rad公司。
1.3 实验方法
1.3.1 羊踟蹰提取物的制备
称取羊踟蹰干粉10 g,加100 mL 95%乙醇水浴加热提取两次,每次1 h,合并滤液浓缩成生药当量1 g/mL浓溶液,4 ℃密封保存。
1.3.2 抑菌活性测定——平板打孔法
采用琼脂平板打孔法,测定抗菌活性。在无菌平皿内加入熔化的培养基,待其冷却凝固后作为底层,再取熔化的培养基,冷至加入菌液(500 μL:100 mL),冷却凝固后作为上层,用灭菌不锈钢打孔器打孔(直径为6 mm),用移液器分别吸取各药液约100 μL 加于各琼脂孔内于37 ℃ 培养18~24 h,观察孔周围有无抑菌圈,通过抑菌圈的大小比较各药物的抗菌效力。平行测定三次取平均值。
1.3.3 最低抑菌浓度的(MIC)测定
采用试管两倍稀释法测定最小抑菌浓度(MIC),按无菌操作规程以灭菌的肉汤液体培养基为稀释液,取9支试管分别加入肉汤液体培养基1 mL,再量取1 mL其羊踯躅提取液于第1管中(第1管为2 mL,浓度为1:1),混匀后再从第1管吸取1 mL 加至第2 管,使之成1:1、1:2、1:4、1:8、1:16、1:32、1:64、1:128、1:256的浓度梯度,第10管取1 mL不含药液的肉汤液体培养基为阴性对照,再分别加入30 μL大肠杆菌、 金黄色葡萄球、化脓性链球菌、表皮葡萄球菌到该10支试管培养基中,其他药液同上操作。37 ℃下培养16~24 h后观察细菌的生长状况。
1.3.4 核酸含量的测定
根据Chen等[10]的方法测定核酸含量。取5支试管,编号1~5,分别加入羊踟蹰提取液、液体培养基和含0.01%吐温80的PBS溶液,使得终浓度为4、2、 1和 0.5*MIC,5号试管不加药液作为对照组。在1~5号试管中分别加入60 μL菌悬液,于摇床培养箱(37 ℃、200 r/min)培养,0、1、2、4、6 h后分别取样200 μL,于5000 r/min条件下离心15 min,取上清液在酶标仪260 nm条件下测吸光度值。
1.3.5 电导率的测定
根据Lee等[11]的方法测定电导率值。实验组加入MIC浓度的羊踟蹰提取物,用灭菌水为对照,2支试管分别加入360 μL菌悬液,于摇床(37 ℃、150 r/min)中培养;间隔0,1,2,4,6和8 h,每支试管取样4 mL,离心机(5000 r/min)离心15分钟,测定上清液电导率。
1.3.6 细菌生长曲线的测定
参考王蒙蒙等[12]研究,取4支试管,按1.2.4方法,将羊踟蹰提取物稀释成浓度为0、0.5、1、2*MIC的药液,分别加入60 μL菌悬液,于37 ℃、150 r/min摇床中培养;间隔0,2,4,6,8,12,24 h,每支试管取样200 μL于96孔板中,用酶标仪测定其在600 nm波长下的吸光度值,绘制折线图得到生长曲线。
1.3.7 扫描电镜观察细菌形态
参考邢梦雨等[13]的研究,取2支试管,按1.2.4方法,第1支试管将羊踟蹰提取物稀释成最小抑菌浓度的药液,第2支试管不加药液作为对照组,分别加入60 μL菌悬液,于37 ℃、200 r/min摇床中培养5小时后,离心机(5000 r/min)离心10 min,弃去上清液,沉淀再以pH=7.2的PBS洗涤2次,然后加入2.5%戊二醛溶液4 ℃固定过夜。之后依次用乙醇梯度脱水,经重悬、离心、干燥后喷金,用扫描电镜上观察细菌形态。
2 结果与讨论
2.1 抑菌圈直径及最小抑菌浓度
按照方法1.3.2和1.3.3分别将羊踯躅提取物对4种供试菌进行抑菌实验,结果如表1所示。
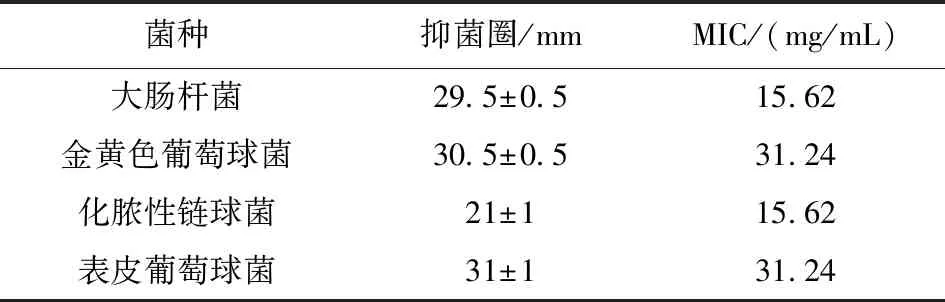
表1 羊踟蹰提取物的抑菌活性
羊踯躅75%醇提物对对金黄色葡萄球菌、化脓性链球菌、表皮葡萄球菌、大肠杆菌均具有不同程度的抑制作用。对大肠杆菌和化脓性链球菌极敏感,MIC都是15.62 mg/mL,对金黄色葡萄球菌和表皮葡萄球菌也极敏感,MIC都是31.24 mg/mL,其醇提物浓度为1 g/mL时对所有供试菌都有抑菌作用。
2.2 核酸含量的测定结果
按照1.3.4方法,用酶标仪测定不同浓度的羊踟蹰提取物药液对金黄色葡萄球菌DNA的吸光度值,结果见图1。
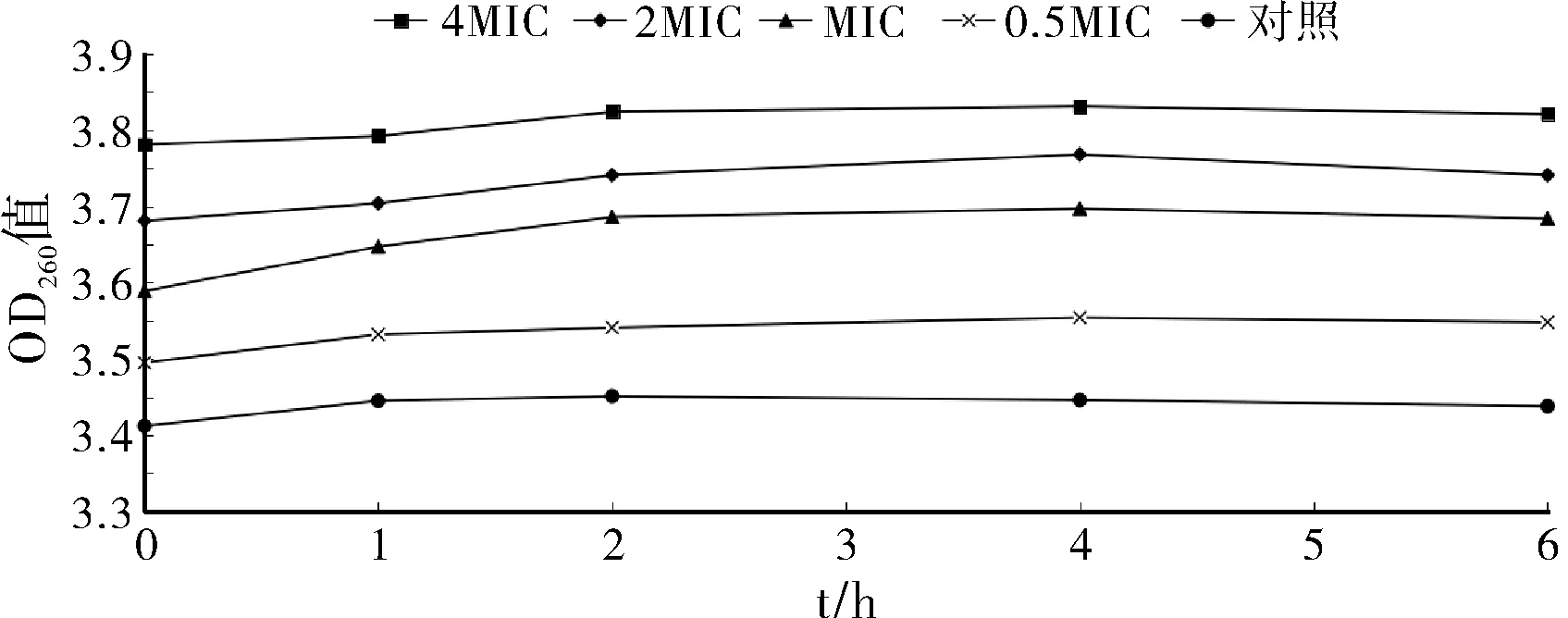
图1 菌液的吸光度值(DNA)
由图1可知,不同浓度的羊踟蹰提取物对金黄色葡萄球菌存在着不同程度的影响。4*MIC、2*MIC以及最小抑菌浓度下的药液能明显地使菌悬液中的DNA增加;加入0.5*MIC的实验组和不加药液的对照组中细菌DNA变化微弱,基本可以忽略不计。表明,一定浓度下的羊踟蹰提取物能改变细菌细胞膜的通透性,从而使细菌细胞膜内的DNA外流。细菌经高浓度药液作用4小时后,所测得吸光度值有所降低,估计是由于细菌全部死亡所造成。此外,由于药液颜色偏深并且与肉汤培养基作用后,溶液中会有沉淀生成,所以造成吸光度值普遍偏大,也对实验造成了一定误差。
2.3 电导率的测定结果
按照1.3.5方法,羊踟蹰提取物作用下金葡菌电导率测定结果见图2。随着药物作用时间的增加,实验组溶液中电导率值也随之增加;对照组电导率值无明显变化。其可能是由于金黄色葡萄球菌经羊踟蹰提取物的作用后,导致其细胞膜通透性增加,使得细胞内K+、Na+等导电离子外流,从而增加了溶液的电导率。
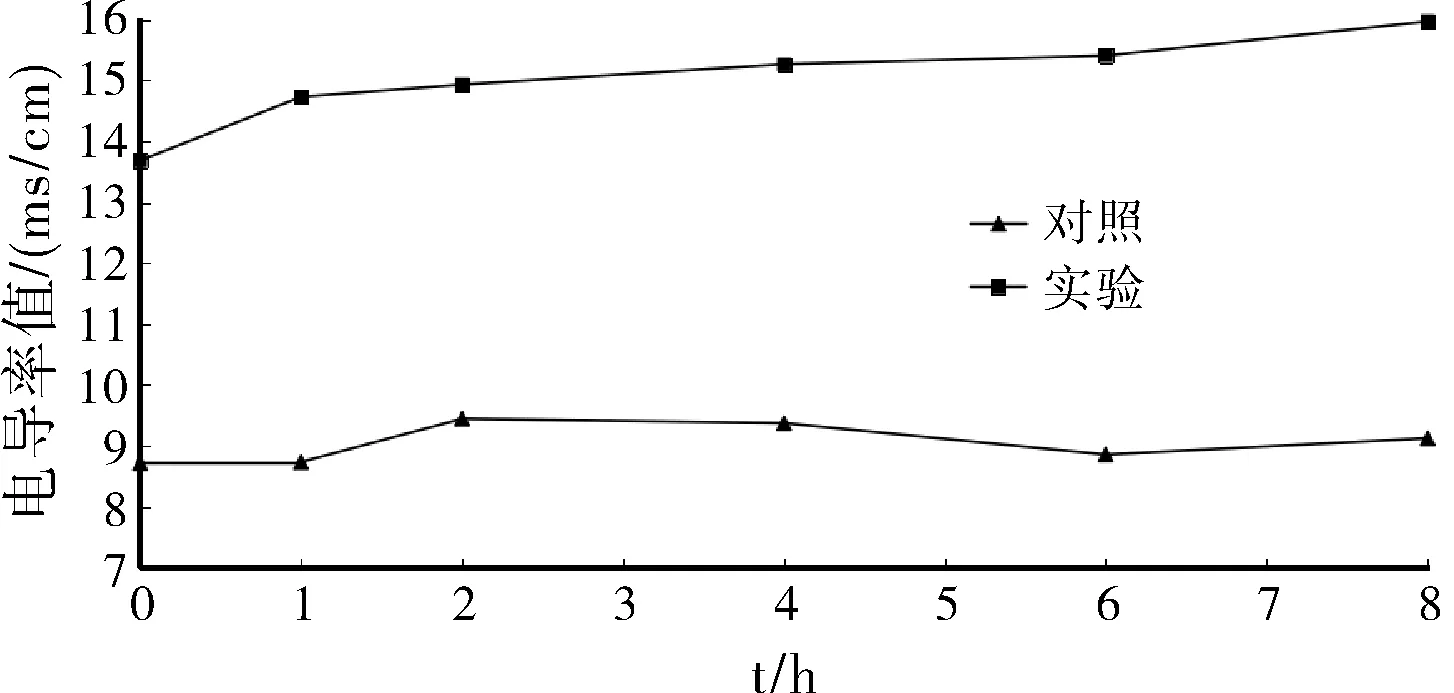
图2 菌悬液电导率值
2.4 细菌生长曲线的测定结果
按照1.3.6方法,测定600nm条件下菌液的吸光度值绘制生长曲线见图3。对照组的金黄色葡萄球菌对数生长;0.5*MIC药液组,前期细菌数量有明显的增加,后期也有增长趋势,但数量变化不大,说明该浓度下的羊踟蹰提取物对金黄色葡萄球菌有一定的抑制作用,但不能完全抑制其的生长;MIC和2*MIC实验组中,前期细菌也有所增长,但后期其生长已完全停止,甚至出现吸光度值变小的情况,说明这两个浓度的羊踟蹰提取物完全达到了抑制金黄色葡萄球菌生长的作用,甚至能使细菌死亡。
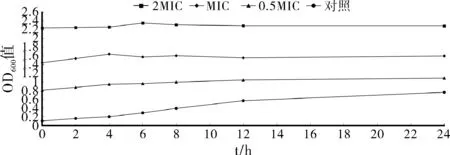
图3 金黄色葡萄糖球菌生长曲线图
2.5 扫描电镜观察细菌形态的结果

图4 金黄色葡萄糖球菌扫描电镜图
按照1.3.7方法,用小型离子溅射仪以10 mA电流喷金20 s后于扫描电镜观察经羊踟蹰提取物作用后金黄色葡萄球菌的形态,结果如图4所示。
从图4可以看出,对照组正常生长一段时间后,金黄色葡萄球菌菌体饱满,形态完整。细菌经羊踟蹰提取物作用后,菌体变形、塌陷,甚至发生表面溶解,形态完整性遭到了明显破坏。由此说明,羊踟蹰提取物对金黄色葡萄球菌菌体结构具有较强的破坏作用。
3 结 论
本研究以不同浓度的羊踟蹰提取物作用于金黄色葡萄球菌,结果表明该药物对此细菌具有较好的抑制作用最小抑菌浓度为31.24 mg/mL,MIC使得细菌细胞膜内的导电离子大量外流,细菌DNA外流细菌完整性明显遭到破坏,出现了凹陷、破损等。推测羊踟蹰对金黄色葡萄糖球菌的抑菌机制是通过破坏细菌细胞膜甚至细胞完整性,使得细胞内的K+、Na+等导电离子及DNA等大分子物质外流,从而造成细菌无法生存及繁殖。

