基于迈克尔加成的生物硫醇比率比色荧光探针
王晓菊,王云侠,张彩红*
(1.山西大学 分子科学研究所,教育部化学生物学与分子工程实验室,山西 太原 030006;2.山西大学 化学化工学院, 山西 太原 030006)
0 引言
小分子量生物硫醇 (RSH) 在调节代谢、生物氧化还原、结合金属、解毒和细胞生长等多种生物功能方面起着关键作用,因此对其检测越来越受到人们的重视[1-3]。细胞内RSH水平异常可引发多种疾病,如心血管疾病、肝脏损伤、阿尔茨海默病、代谢紊乱、肾脏疾病等[4-6]。半胱氨酸(Cys)可以通过二硫键促进生物大分子的交联,来表达蛋白质的功能和结构[7];与Cys相比,同型半胱氨酸(Hcy)多了一个亚甲基链,与维生素B反应可以形成Cys[8];谷胱甘肽(GSH)在可逆氧化还原反应中起重要作用。因此,RSH的定性和定量检测对相关疾病的预防和诊断具有重要意义[9]。由于这3种硫醇化合物具有相似的结构,且报道的大多数RSH探针不能对3种硫醇进行区分识别,因此设计出具有区别检测某一种硫醇的新型荧光探针是目前的研究热点。
到目前为止,报道的大量RSH荧光探针是基于探针与RSH之间的特异性反应[10-11],根据机理可分为:亲核取代[12]、磺胺与磺酸酯[13]的裂解、Michael加成[14]以及与纳米颗粒的结合[15]等。其中,基于硫醇亲核加成和分子内环化反应为作用模式的探针具有较强的竞争力。2015年,Wong的团队报道了一种双光子荧光探针[16],用于比率传感线粒体中的Cys。2017年,Yin的团队设计了一种以香豆素为主体的荧光探针,通过两种不同的反应途径[17],以pH调节激活,其中对Cys为比率荧光响应,对Hcy为激活荧光响应。为了进一步研制结构更新颖、性能更优良的生物硫醇荧光探针,本文报道了一种新的比色比率荧光探针用于RSH的定量检测。
在本研究中,N-丁基-4-羟基-1,8-萘二酰亚胺(BHNA)由于其良好的光学性质,如:好的光稳定性、大的斯托克斯位移和高的荧光量子产率,在构建的荧光探针中作为发光单元;α,β-不饱和烯酸酯(2,4-己二烯酸酯)作为结合硫醇的识别单元。BHNA与2,4-己二烯酸发生酯化反应形成具有α,β-不饱和羧酸酯的荧光探针(BHENA), 酯结构削弱了分子内的ICT作用,当探针BHENA与RSH作用时,经过亲核加成和分子内环化反应,释放出荧光团BHNA,进而使发射波长红移。
1 实验部分
1.1 实验试剂与仪器
4-溴-1,8-萘二酰亚胺,4-二甲基氨基吡啶(DMAP),乙醇,1-(3-二甲基氨基丙基)-3-乙基二亚胺盐酸盐(EDC),金属钠,正丁胺,溴化氢,甲醇和2,4-己二烯酸等化学试剂购于Sigma-Aldrich或Aldrich公司。GSH、Cys、Hcy、氨基酸等反应性硫均为分析级,均购于北京化工试剂厂。
UV-265紫外可见分光光度计(岛津公司,日本东京);pH计(梅特勒-托利多,瑞士);F4500荧光分光光度计(日立公司,日本东京);Bruker Avance DRX 400 MHz超导核磁共振仪(布鲁克,德国)。
1.2 探针的制备及其表征
探针合成路线如图1所示,其中两个中间化合物依据文献[18]合成。探针的合成方法:在5 mL无水的二氯甲烷溶液中加入制备好的BHNA(54.0 mg,0.2 mmol)、2,4-己二烯酸(23.0 mg,0.2 mmol)、EDC(38.0 mg,0.2 mmol)和DMAP(2.5 mg,0.02 mmol)室温搅拌过夜,减压蒸馏,得到的混合物经柱色谱分离(流动相为乙酸乙酯/二氯甲烷=1/10,V/V),分离提纯得到黄色固体BHENA(41.0 mg,产率56%)。1HNMR(400 MHz,CDCl3),δ(ppm):δ 8.70-8.62(m,2H),8.28-8.30(d,J=2.80 Hz,1H),7.77-7.80 (t,J=2.60 Hz,1H),7.59-7.63(m,2H),6.34-6.42(m,2H),6.14-6.17(d,J=5.20 Hz,1H), 4.20-4.22(t,J=2.60 Hz,2H),1.97-1.98(d,J=1.80 Hz,3H),1.73-1.75(t,J=2.60 Hz,2H),1.45-1.49(m,2H),0.99-1.02(t,J=2.40 Hz,3H);13C NMR (100 MHz,CDCl3):δ 164.84,164.11,163.56,151.82,148.67,142.39,131.79,131.59,129.62,129.34,127.87,127.11,125.40,122.96,120.26,119.49,116.69,40.27,30.20,20.37,18.92,13.84.
1.3 紫外吸收和荧光发射光谱
在DMF溶剂中配制0.2 mmol/L探针母液。在去离子水中配制磷酸缓冲盐溶液(PBS),在PBS缓冲液中配制Cys、GSH、Hcy等母液。光谱测量时,移取探针原液加入到DMF/PBS缓冲溶液(1/9 V/V,PBS 缓冲液,pH=7.4)中。将不同浓度的RSH逐渐加入石英杯中,在室温下80 min后进行光谱测定,激发和发射狭缝宽度均设置为5 nm。激发波长为390 nm。
2 结果与讨论
2.1 对RSH的比率响应和比色响应
首先,我们研究了BHENA探针在0.05 mol/L PBS缓冲液(pH7.4,含体积百分数10%DMF)中的光谱性能。如图2a所示,BHENA(10 μmol/L)具有一个宽吸收带,最大吸收在346 nm(ε=2.8×104(mol/L)-1·cm-1)。荧光光谱测定表明,BHENA在400-600 nm存在荧光发射带,最大发射峰在468 nm。探针BHENA与Cys作用的吸收光谱和荧光光谱如图2a所示,在加入100 μmol/L Cys后,探针BHENA在346 nm的吸收峰强度降低,同时在452 nm(ε=2.5×104(mol/L)-1·cm-1)处新的吸收峰出现。另外,肉眼可以观察到溶液从无色到黄色的明显变化(图2a插图)。荧光光谱的变化表现为原来468 nm的发射峰强度降低,同时在长波区556 nm出现新的发射峰。对应地,在365 nm紫外灯下溶液的颜色由蓝色变为黄绿色。当探针分别与Hcy和GSH作用时,也可以观察到类似的实验现象。这些结果表明,BHENA探针可以通过比率和颜色两种方法识别RSH。
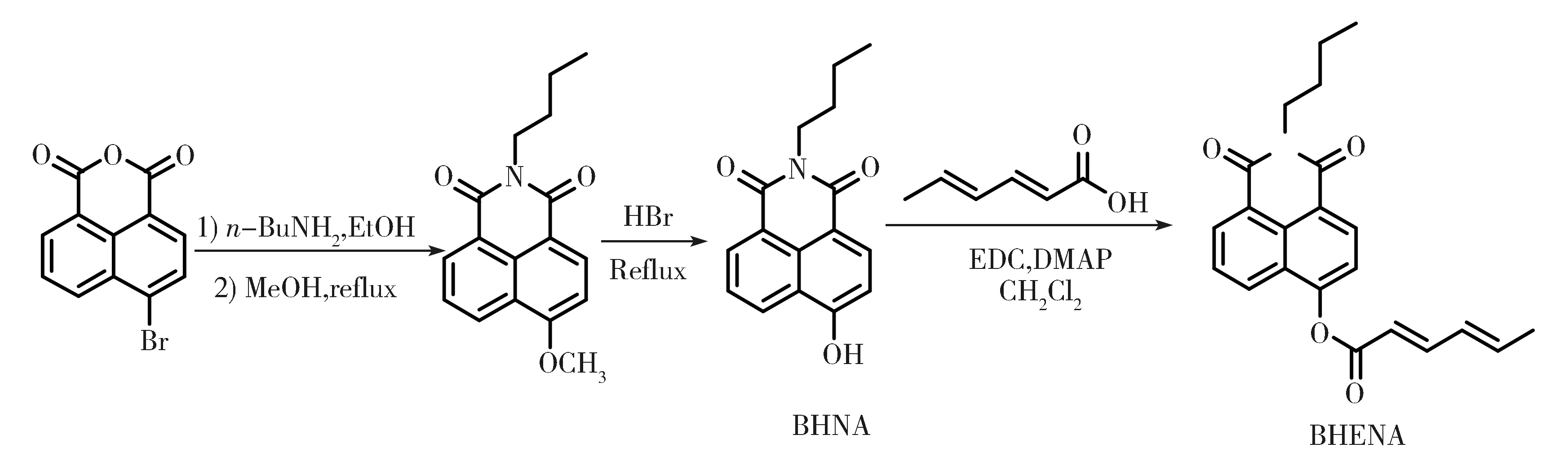
图1 探针BHENA的合成路线
探针BHENA对Cys的荧光滴定光谱变化如图2b所示。在390 nm激发下,BHENA的发射峰处于468 nm,随着半胱氨酸Cys (0-100 μmol/L) 的加入,468 nm荧光发射强度逐渐降低,而一个新的发射峰在556 nm处出现并逐渐增强。其比率荧光信号F556/F468随Cys浓度增加,从0.17增强至4.13,增强了24倍。当Cys的浓度超过100 μmol/L时,荧光比率信号基本稳定。进一步分析比率信号和生物硫醇浓度的关系,发现比率荧光信号F556/F468和Cys在10~100 μmol/L浓度范围呈线性关系(图2b插图),根据IUPAC的规定 (CDL=3 Sb/m) 计算得到探针对Cys的检出限为5.3 μmol/L。类似地,利用荧光光谱分别对探针BHENA与GSH和Hcy相互作用也进行了研究,如图2c和图2d所示。探针对GSH检测范围为10~50 μmol/L,对Hcy的检测范围为10~100 μmol/L,对应的检测限分别为4.2 μmol/L和5.5 μmol/L。上述结果表明,BHENA可以用于RSH的定量检测。
2.2 反应时间和pH影响
为了更好地理解BHENA与RSH作用的反应动力学,在室温下开展了探针对生物硫醇的响应时间研究,结果如图3a所示,在RSH存在的情况下,468 nm处的发射强度逐渐减小,而556 nm处的发射强度增大。探针对3种不同结构的生物硫醇响应达到平衡的时间相差较大,当溶液体系中加入Cys后,比率荧光信号F556/F468在80 min内达到稳定,而探针对GSH和 Hcy的响应时间长达140 min以上。
体系pH对探针和生物硫醇相互作用的影响如图3b,探针自身的荧光强度在 pH=2~12 范围内变化小。当加入RSH后,在pH=6~12有较强的比率荧光响应,在pH=2~6范围内,荧光信号基本无变化,这可能是因为酸性条件抑制了羟基酯保护基团的裂解,研究结果表明该探针可用于生理环境下RSH的检测。
2.3 探针BHENA对RSH的选择性研究
良好的选择性是探针应用的前提,为了评估探针对生物硫醇的选择性,在相同的溶液体系中,我们对探针 (10 μmol/L) 和各种氨基酸和阴离子的相互作用进行了考察(图4)。Cys,GSH,Hcy(均为100 μmol/L)和其他氨基酸:L-组氨酸(His),L-谷氨酸(Glu),L-天冬酰胺(Asp),L-缬氨酸(Val),L-苯丙氨酸 (Phe),L-酪氨酸(Tyr),L-丙氨酸(Ala),L-丝氨酸(Ser),L-亮氨酸(Leu),L-精氨酸(Arg),L-脯氨酸(Pro),L-苏氨酸(Thr),L-谷氨酰胺(Glu),L-色氨酸(Trp),L-异亮氨酸(Ile),L-赖氨酸(Lys)(均为1 mmol/L)分别与探针作用80 min后检测其比率荧光强度。从图4a中可以看出,Cys存在时,BHENA的荧光比率信号(F556/F468)明显升高;与Cys相比,GSH和Hcy有一定程度的增强;其他氨基酸,在相同条件下未观察到明显的荧光变化。这一结果证明探针对RSH有一定的选择性,探针对3种RSH作用的不同,主要是由于作用时间的差异导致的,探针与Cys的作用时间比Hcy和RSH要快。进一步考察非巯基氨基酸对Cys检测的干扰情况,当1 mmol/L不含巯基的氨基酸和100 μmol/L Cys共存时,探针的比率荧光信号仍明显增强,说明探针对Cys的检测不受这些氨基酸的干扰。

图2 a) 探针BHENA(10 μmol/L)与半胱氨酸(100 μmol/L)在室温下作用80 min的紫外吸收和荧光光谱图。

图3 探针(10.0 μmol/L)与RSH(1.0 mmol/L)相互作用受时间 (a)和pH (b)的影响

图4 a) 探针(10.0 μmol/L)在分别加入RSH(100.0 μmol/L),氨基酸(1 mmol/L)以及非巯基氨基酸和Cys的混合物后比率荧光强度变化图;b) 探针(10.0 μmol/L)在分别加入RSH (100.0 μmol/L),常见阴离子 (1.0 mmol/L) 以及阴离子和Cys的混合物后比率荧光强度变化图。测试在25℃下,作用80 min
2.4 机理推测
根据探针BHENA对硫醇RSH的荧光检测,图5给出了它们可能的作用机制。当Cys加入后,首先发生迈克尔加成反应,接着进行分子内环化反应,同时释放出环状副产物和BHNA,导致体系的荧光在长波发射和比率信号的改变。现将0.1 mmol的探针和1.0 mmol Cys在DMF∶PBS缓冲溶液(1∶9 V/V,PBS缓冲液,pH=7.4)中反应1.5 h后,可分离出新物质,并通过1HNMR (1H NMR(300 MHz,CDCl3) δ 11.87(s,1H),8.52(d,1H,J=8.6),8.46(d,1H,J=8.1),8.34(d,1H,J=7.5),7.75(t,1H,J=8.2),7.14(d,1H,J=7.3),4.00(t,2H,J=4.4),321.52-1.62(m,2H),1.28-1.36(m,2H),0.88-0.92(t,3H,J=7.3))证实产物为BHNA,进一步证明了我们的推断是正确的。在整个作用过程中,迈克尔加成反应速度快,而分子内环化反应速度较慢,是速控步骤。对3种硫醇反应的不同在于,分子内环化反应所得环状中间体化合物稳定性不同所致。Cys和探针BHENA作用能形成比较稳定的七元环,故反应作用时间短,比率荧光响应最强。
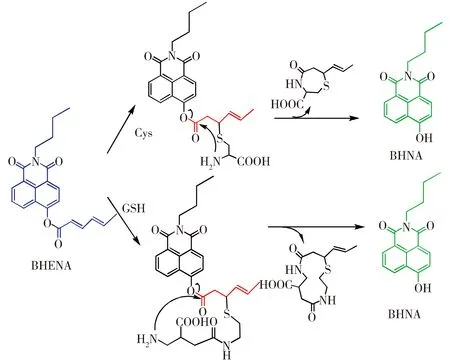
图5 推测的探针对生物硫醇的作用机理
3 结论
我们设计并合成了一种能用于生物硫醇检测的比色比率荧光探针。实验结果表明,该探针可对RSH进行选择性的检测,尤其是与Cys相互作用时,比率荧光信号可增强24倍。在光谱研究的基础上提出了探针对生物硫醇的检测机理,即探针与RSH先发生迈克尔加成反应生成硫醚,之后发生分子内环化并释放荧光团,达到检测RSH的目的。此外,探针对Cys的响应比Hcy/GSH高是由于探针与Cys的环化反应更快所致。

