DNA-银纳米簇对L-组氨酸的荧光增强检测
毛安琪,魏春英
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
以DNA为模板合成的银纳米簇(DNA-Ag NCs)是一种新兴材料,由于其毒性小、生物相容性好以及易调节的发射波长,近几年来受到了研究者们的关注,被广泛应用于金属离子和生物小分子的检测[1]。此外,科学家也致力于改善DNA-Ag NCs的物理及化学性质,研究表明富G序列靠近DNA-Ag NCs能显著增强其荧光强度[2]。根据这一特性,借助多种DNA适配体和独特的二级结构,DNA-Ag NCs被成功应于生物成像[3]及核酸序列的“turn on”检测[4]。
L-组氨酸是人类和其他哺乳动物必需的氨基酸,它控制着金属元素的转运,同时也是哺乳动物中枢神经系统中的一种神经调节剂。L-组氨酸的咪唑侧链是金属蛋白酶中常见的配体,在某些酶的催化位点上起着重要的作用。研究表明,L-组氨酸水平异常可引起心理障碍、类风湿关节炎、神经性耳聋等多种疾病[5]。鉴于L-组氨酸在人体中的重要性,人们已经建立了液相色谱法[6]、毛细管电泳法[7]、电化学方法[8]、荧光法[9]等检测方法,其中荧光探针具有较高的选择性和灵敏度,在L-组氨酸检测中具有较好的应用前景。尽管用于L-组氨酸检测的荧光传感器的开发已经取得了显著的进展,但目前常见的小分子染料和量子点探针存在毒性大、光稳定性差、合成困难等不足[10]。因此仍有必要开发新型荧光传感器用于组氨酸检测。
采用包含富G和富C序列的单链DNA模板合成了发射波长为593 nm的DNA-Ag NCs,测试了其紫外可见吸收和荧光性质,并借助Ni2+对DNA-Ag NCs荧光的猝灭以及Ni2+和L-His的强配位相互作用,实现了对L-His的“turn on”检测。
1 实验部分
1.1 材料
AgNO3(质量分数99.8%),NaBH4(质量分数98%), Ni(NO3)2,2-甲基苯并咪唑为分析纯,半胱氨酸(Cys),胱氨酸(Cys-Cys),同型半胱氨酸(Hcy),谷氨酸(Glu),谷氨酰胺(Gln),谷胱甘肽(GSH),L-组氨酸(L-His),羟基脯氨酸(Hypo),苏氨酸(Thr)和色氨酸(Trp)为高级纯,均购于上海阿拉丁生物科技股份有限公司。无水乙醇、1-乙烯基咪唑和咪唑均为分析纯,分别购于天津市恒兴化学试剂制造有限公司、安耐吉化学、和生工生物工程(上海)股份有限公司。胎牛血清购于浙江天杭生物科技股份有限公司。研究中使用的寡聚单链DNA由生工生物工程(上海)股份有限公司合成,序列如下:
C-T30695:5′-TTTACCCACCCACCCACCCAAA-3′,C-T30695-G:5′-TTTACCCACCCACCCACCCAAAGGTGGTGGTGGTTGTGGTGGTGGTGG-3′
1.2 DNA-Ag NCs的合成
DNA-Ag NCs按照文献报道的方法合成[11],具体如下:将初始浓度为100 μmol/L的DNA贮存液稀释于pH=7.4的PBS-K+(20 mmol/L) 缓冲溶液中,加入硝酸银溶液,充分混匀,放入4℃冰箱避光孵育20 min。随后在上述溶液中加入10 mmol/L的NaBH4溶液(需现配现用)混合均匀,4℃冰箱继续避光孵育1 h合成DNA-Ag NCs。体系中DNA、硝酸银和NaBH4的终浓度分别为3,18,18 μmol/L。合成的DNA-Ag NCs储存在室温下用于后续实验。
1.3 光谱测定
荧光光谱在FL 4600型荧光光谱仪上测试。如非特殊说明,测量时采用的DNA-Ag NCs浓度为0.6 μmol/L,激发和发射狭缝均为5 nm,测定温度为室温。紫外可见吸收光谱利用Cary 50 Bio紫外可见光谱仪测试,测量时使用的DNA-Ag NCs浓度为3 μmol/L。透射电镜(TEM)测试使用仪器为JEM-2100透射电子显微镜。测试时使用20 μmol/L DNA-Ag NCs,与无水乙醇1∶1混合均匀后取10 μL滴加在铜网上,干燥后测试。荧光寿命测试在FL 920瞬态荧光光谱仪上完成,使用405 nm皮秒激光器作为激发光源,DNA-Ag NCs样品浓度为0.6 μmol/L。参考Stern-Volmer方程[12]作为判断动态猝灭和静态猝灭的依据:
F0/F=1+kqτ0[Q]=1+ksv[Q]
τ0/τ=1+kqτ0[Q]=1+kD[Q]
方程中F和F0分别为加入及未加入猝灭剂时的荧光强度,τ和τ0为加入及未加入猝灭剂时体系的平均荧光寿命,kq为分子猝灭常数,ksv为SV方程常数,kD是动力学猝灭常数,[Q]为猝灭剂浓度。根据SV方程,当τ0/τ=1时,猝灭过程为静态猝灭;猝灭过程为纯动态猝灭时,F0/F和τ0/τ对猝灭剂浓度[Q]作图均呈线性,并且F0/F=τ0/τ。
1.4 胎牛血清中检测
取胎牛血清稀释100倍,加入标准L-His溶液。将上述溶液加入0.6 μmol/L C-T30695-G-Ag NCs体系中,使加入L-His的终浓度分别为40 μmol/L, 80 μmol/L和160 μmol/L测定体系593 nm处荧光强度,通过测定的标准曲线得到检测结果,通过计算回收率判断该方法的可靠性。
2 结果与讨论
2.1 DNA-Ag NCs的性质
DNA-Ag NCs的性质如图1所示。由图1A可见,C-T30695-Ag NCs的吸收峰位于450 nm,最大激发和发射波长分别为470和550 nm,254 nm手提紫外灯照射下可观察到黄绿色荧光,自然光照射下为淡黄色(图1A插图)。然而,在模板中加入富G序列后合成的C-T30695-G-Ag NCs的最大吸收峰红移到520 nm,最大激发波长和最大发射波长也分别红移至515和593 nm,同时荧光发射强度增强约6倍(图1B)。可见在合成模板中添加富G序列后,不仅DNA-Ag NCs的荧光强度显著增强,而且最大发射波长由黄绿光波段移至橙光波段,扩大了其在生物成像中的应用前景。由图1B插图也可以观察到C-T30695-G-Ag NCs溶液在254 nm手提紫外灯照射下发射明亮的橙色荧光,自然光下呈现淡粉色。由图1C和图1D可见C-T30695-Ag NCs与C-T30695-G-Ag NCs均为分散良好的球形结构,粒径无明显差别。
2.2 Ni2+对C-T30695-G1-Ag NCs的荧光猝灭
如图2A所示,随Ni2+的加入C-T30695-G-AgNCs(下文中简称为Ag NCs)的荧光减弱。将最大发射波长593 nm处荧光强度对Ni2+离子浓度作图(图2A插图),发现在100 μmol/L左右可分为两部分线性关系,标准曲线分别为F1=-3.968 9[Ni2+]+1 660,R2=0.965 9;F2=-1.573 1[Ni2+]+1 373,R2=0.971 5。Ni2+离子加入过少,荧光体系不能有效猝灭,检测线性范围窄;Ni2+离子加入过多,L-His会先和游离的Ni2+反应,影响L-His的检测灵敏度。因此,为了实现对L-His的高效检测,需要选择适当浓度的Ni2+。结果表明,当加入的Ni2+大于100 μmol/L时对L-His灵敏度相对变差(数据未详细列出),因此选择在0.6 μmol/L Ag NCs中加入100 μmol/L Ni2+继续以下研究。
进一步研究Ni2+加入对Ag NCs的影响,向Ag NCs中逐步滴加Ni2+测得不同Ni2+浓度下Ag NCs的荧光寿命。将荧光寿命τ0/τ和荧光强度F0/F对Ni2+离子浓度作图(图2B),发现当Ni2+浓度为0~120 μmol/L时二者斜率几乎相同,根据SV方程得到动力学猝灭常数kD=4.46×103mol/L,ksv=4.43×103mol/L,属于动态猝灭。当加入的Ni2+浓度大于120 μmol/L时τ几乎不再变化,此时应归于为静态猝灭,可能是由于Ni2+与G碱基和/或Ag NCs发生了相互作用[5,13]。
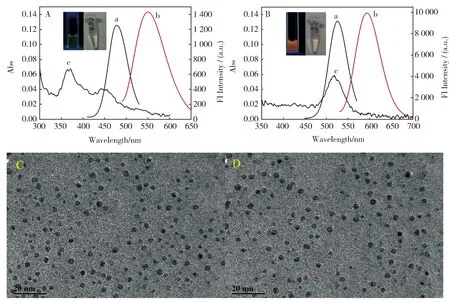
图1 Ag NCs的性质。(A) C-T30695-Ag NC和(B) C-T30695-G1-Ag NCs的(a)荧光激发光谱,(b)荧光发射光谱和(c)紫外可见吸收光谱;(C)C-T30695-Ag NCs 和(D) C-T30695-G1-Ag NCs 的TEM图。
2.3 L-His对猝灭体系的恢复
如图3A所示,0.6 μmol/L Ag NCs溶液中加入100 μmol/L Ni2+后荧光明显猝灭,继续加入200μmol/L的L-His 荧光得到恢复,这应该是由于L-His与Ni2+的强相互作用。紫外可见吸收光谱表明(图3B),向3 μmol/L Ag NCs中加入500 μmol/L Ni2+和1 mmol/LL-His,520 nm处吸收峰几乎未发生变化,推测Ni2+和L-His可能只与G碱基作用,而不是和Ag NCs直接作用。
2.4 L-His的检测
由图4A可见,向Ag NCs-Ni2+体系中加入L-His后1 min荧光强度不再变化,因此选择1 min作为反应时间,实现对L-His的快速检测。图4B为逐渐向Ag NCs-Ni2+体系中滴加L-His的荧光光谱,发现随着L-His浓度增大荧光逐渐增强。取593 nm处荧光强度对L-His浓度作图(图4B插图),发现在20~160 μmol/L范围内呈现出良好的线性,线性回归方程为F=2.745 3[Ni2+]+1 381.8,R2=0.996 6,检出限为4.17 μmol/L(σ=3),线性范围为20~160 μmol/L。人体血液中组氨酸含量为20~200 μmol/L[14],本文方法的测定范围与之相匹配,具有实际应用前景。
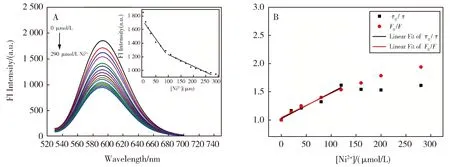
图2 Ni2+对银纳米簇荧光性能的影响。(A)不同浓度Ni2+对Ag NCs荧光强度的影响,插图为593 nm处Ag NCs荧光强度与[Ni2+]的关系;(B) F0/F和τ0/τ分别对[Ni2+]作图
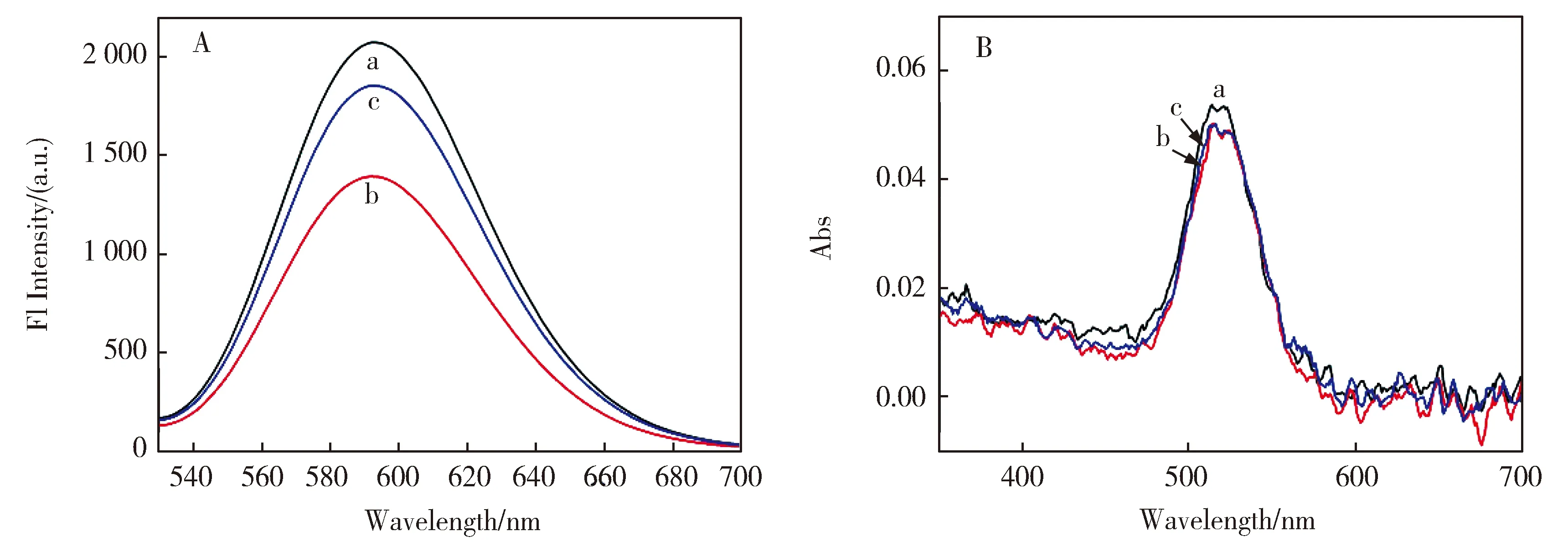
图3 Ni2+和L-His对银纳米簇荧光和紫外可见吸收的影响。
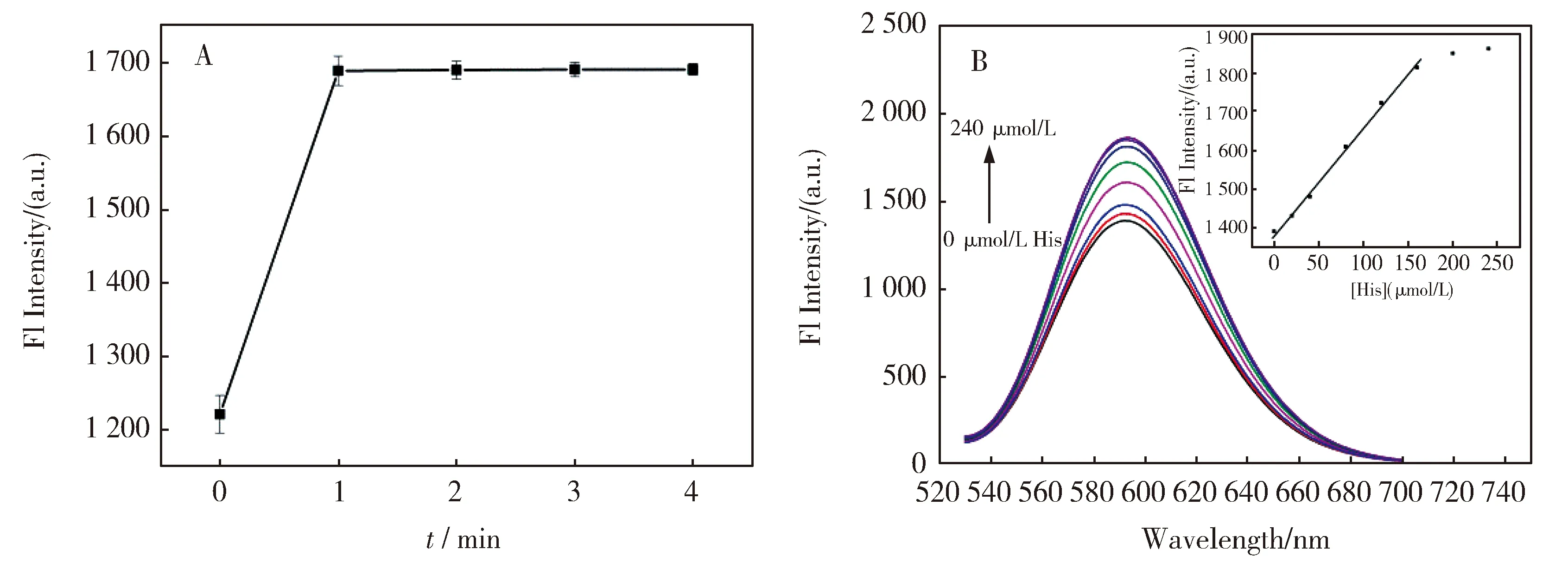
图4 Ag NCs对L-His的检测
2.5 选择性
如图5所示,向0.6 μmol/L Ag NCs与100 μmol/L的Ni2+混合溶液中分别加入200 μmol/L不同氨基酸、咪唑,1-乙烯基咪唑,和2-甲基苯并咪唑的水溶液,发现Trp,Thr,Met,Hypo,Glu,Gln,Cys-Cys对体系荧光强度几乎没有影响,GSH,Hcy和Cys会引起体系的强烈猝灭。这是GSH,Hcy和Cys结构中含有的巯基与Ag NCs中的Ag生成Ag-S键引起的。由于GSH,Hcy和Cys都具有还原性,可以考虑通过加入NEM掩蔽剂消除干扰[15]。相比其他氨基酸Ag NCs对于L-His具有较好的选择性,应该是由于L-His特有的咪唑基团与Ni2+配位。进一步测试表明,向Ag NCs-Ni2+体系中加入咪唑和其他含有咪唑基团的化合物如1-乙烯基咪唑和2-甲基苯并咪唑,荧光不能恢复。因此,L-His引起的荧光恢复应该归于组氨酸中的咪唑N和氨基N原子共同与Ni2+配位,只含有咪唑基团的化合物与Ni2+配位能力不及组氨酸与Ni2+配位能力强,无法消除Ni2+对G碱基的作用。

图5 Ag NC对L-His检测的选择性。
2.6 实际应用
为评价Ag NCs体系的应用价值,我们在稀释100倍胎牛血清中检测了L-His,实验结果(表1)显示该方法回收率在99.2%~105.3%之间,具有较好的回收率。结果表明,Ag NCs作为L-His传感器可以在胎牛血清环境中实现对L-His快速、准确的检测,具有潜在的实际应用价值。

表1 胎牛血清中对L-His的检测
3 结论
本文通过在富C序列(C-T30695)末端连接富G序列合成了C-T30695-G-Ag NCs,与使用仅含有富C序列的模板相比,发现C-T30695-G-Ag NCs荧光强度增强,发射波长红移至橙光波段。此纳米簇体系加入Ni2+后,由于Ni2+与G碱基间的相互作用使DNA-Ag NCs荧光强度猝灭,当加入L-His后,由于L-His与Ni2+的强配位作用使荧光得到恢复,从而实现对L-His的检测,检出限为4.17 μmol/L,线性范围为20~160 μmol/L,并能够实现在胎牛血清环境中对L-His的检测。

