PRMT1影响胃癌PI3K-AKT通路基因表达的转录组分析
刘蒙蒙,姜 浩,楼文晖,宋 超,孙剑勇,吴伟新
近年来胃癌发病率逐年升高,虽然通过手术及化疗,患者生存期显著延长,但总体死亡率仍居高不下[1]。蛋白精氨酸甲基转移酶(protein arginine methyltransferase, PRMT1)在体内广泛存在,发挥着重要作用,多年来的研究[2]表明PRMT1广泛参与了细胞内信号转导、转录调节、DNA损伤修复以及mRNA剪接等多种细胞生理活动过程。因此,对PRMT1的研究有助于进一步了解细胞生长与增殖调控和肿瘤的发生发展,有望寻求肿瘤药物治疗的新靶点。转录组是连接生物功能与基因组遗传信息的桥梁,在探索疾病的发生发展及基因调控等方面发挥了重要作用。现通过高通量测序对胃癌组织标本与癌旁组织的差异表达谱进行京都基因与基因组百科全书富集分析(kyoto encyclopedia ofgenes and genomes, KEGG),探讨胃癌中PRMT1影响代谢通路的基因表达情况,从转录组学和代谢组学层面为胃癌诊治寻找新线索。
1 材料与方法
1.1 组织样本及主要试剂
1.1.1病例资料 选取复旦大学附属中山医院青浦分院2018年9月胃癌患者术后新鲜胃癌组织标本2例及相应癌旁正常组织标本2例,正常对照来自手术边界5 cm以上,均经病理学诊断证实。其中男1例,60岁;女1例,72岁。其病理均为胃中-低分化腺癌。患者术前无放化疗及靶向等肿瘤相关治疗,无高血压、糖尿病等合并症。并选取2018年1~9月间在复旦大学附属中山医院青浦分院普外科行胃癌根治手术患者的组织蜡块。共入组25例,其中男15例,女10例,年龄64~82(64±9.385)岁。纳入标准:①均经病理学诊断明确为胃腺癌;②术前无肿瘤相关治疗。所有患者签署知情同意书。该实验经复旦大学附属中山医院青浦分院伦理委员会批准。
1.1.2主要试剂及仪器 胃癌组织标本总RNA提取试剂TRIzol®Reagen、定量试剂TBS380 Picogreen、mRNA分离仪器磁力架、Superscript逆转录试剂盒购自美国Invitrogen公司;建库试剂TruseqTM RNA sample prep Kit、桥式扩增试剂簇生成试剂盒cBot Truseq PE Cluster Kit v3-cBot-HS购自美国Illumina公司;RNA质控仪器安捷伦2100生物分析仪购自美国Agilent 公司;NanoPhotometre分光光度计购自德国Implen公司;Oligo d (T)25磁珠购自美国NEB公司;琼脂糖凝胶电泳系统购自美国Nanodrop公司;RNA保存于-80℃超低温冰箱DW86L262,购自青岛海尔集团。
1.2 方法
1.2.1cDNA文库构建及质检 ① 从胃癌组织标本中提取总RNA,按照TRIzol试剂说明书操作,随后质控;检测所提RNA完整性及浓度和纯度,并利用Agilent 2100测定RIN值;② 利用Oligo(dT)磁珠富集mRNA,在NEB Next碎片缓冲区随机打断mRNA;③ mRNA片段为模板合成cDNA第一条链,降解RNA链,随后以dNTPs为原料合成cDNA第2条链;④ 筛选150~200 bp的cDNA片段,PCR扩增并纯化;⑤ 最后对文库进行初步定量,并检测插入片段大小,准确定量文库的有效浓度(大于2×109mol/L)。
1.2.2上机测序及数据分析 桥式PCR扩增利用cBot Truseq PE Cluster Kit v3-cBot-HS簇生成试剂盒v3-cBot-HS生成clusters,利用Hiseq Xten平台行双端150 bp测序。为避免影响后续组装的质量及生物信息分析的准确性,检查鸟嘌呤和胞嘧啶含量分布及原始测序数据测序错误率并对原始数据进行过滤,获得后续待分析数据。应用STAR(v2.5.lb)软件对其进行比对分析,RSEM(vl.2.28)进行转录本水平的定量分析。采用edge R(v3.12.1)软件进行表达差异显著性分析,clusterProfiler(v3.0.5)软件对差异基因集行KEGG通路富集分析。
1.2.3免疫组化 25例胃癌组织标本常规甲醛固定及石蜡包埋,将蜡块切成5 μm厚的组织切片,覆盖于预先经过防脱处理的载玻片上,经过烤片、水化、抗原修复,分别滴加一抗PRMT1(1 ∶300)、AKT(1 ∶200),二抗:HRP-conjugated IgG(1 ∶500),DAB显色,中性树胶封片。光学显微镜拍照。每个标本选5个40×的视野,评出染色深度:无或弱染色为1分,中阳染色为2分,强阳为3分;阳性面积:<25%为1分,25%~50%为2分,>50%~75%为3分,>75%为4分。将上述2项分值相乘取平均,得到1~12分的总分区间。
1.3 统计学处理采用 SPSS 17.0进行统计分析,采用进行统计描述,组间差异采用单因素方差分析进行比较,如方差分析结果显示组间差异有统计学意义,则进一步采用t检验进行组间差异的两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 转录组文库构建及RNA-seq数据处理TRIzol法提取的胃癌和癌旁组织总RNA的各项质量指标均达标,分离mRNA并成功合成cDNA文库,质检合格并测序。4个样本进行过滤和比对分析的待分析数据均占相应原始数据的90 %以上。然后对RNA-seq测序数据进行比对分析、基因水平定量及标准化处理。2组的唯一比对率77.4%~88.9%、91.5%~97.3%的reads可以比对到人类参考基因组上。见表1。

表1 测序数据比对人参考基因组比对率
2.2 差异表达分析利用edge R软件筛选差异基因,q<0.05作为基因筛选标准。2组取交集共获得758个长度大于200 bp的差异表达基因,与正常胃黏膜组织相比,胃癌中表达下调基因251个,包括PRMT1;表达上调基507个。通过 heatmap 软件包对2组差异表达基因进行聚类分析并得到热图,表明了胃癌样本组织中和正常组织间有统计学意义的差异表达基因的分布情况。见图1。

图1 胃癌样本组织中和正常组织间有差异基因热图绿色:下调基因;红色:上调基因
2.3 KEGG分析本次KEGG富集分析利用KOBAS,并通过Fisher精确检验计算。采用BH(FDR)方法多重检验控制假阳性率,校正的P<0.05,满足此条件的定义为在差异表达基因中显著富集的KEGG通路。见图2。KEGG富集分析发现25条显著富集代谢通路,由于肿瘤的异质性,将富集通路中基因数最多的10条代谢通路进行列表。见表2。
2.4 PRMT1对PI3K-AKT通路关键基因表达相关性分析在PI3K-AKT信号通路中共有19个基因显著富集。见表2。利用cBioportal数据库将PRMT1分别对PI3K-AKT信号通路中该19个基因进行相关性分析,分析显示PRMT1与PI3K-AKT信号通路上的PPP2R3A[P=2.070×10-14(Spearman),P=1.590×10-14(Pearson)]和THBS4[P=3.257×10-4(Spearman),P=2.882×10-3(Pearson)]基因负相关,说明PRMT1可能影响PI3K-AKT信号通路。见图3。

表2 胃癌和正常组织差异表达基因的KEGG显著富集通路(P<0. 05)

图2 KEGG通路富集结果
1:Amoebiasis;2:Legionellosis;3:Cytokine-cytokine recept…;4:Salmonella infection;5:NOD-like receptor signaling path way;6:Phagosome;7:Malaria;8:Toll-like receptor signaling pathway;9:Tuberculosis;10:Rheumatoid arthritis;11:Leish maniasis;12:Staphylococcus aureus infection;13:Folate biosynthes;14:Osteoclast differentiation;15:NF-kappa B signaling pathway;16:Renin-angiotensin system;17:Transcriptional misr egulation…;18:Chagas disease (Americ…;19:Platelet actiovation;20:cGMP-PKG signaling pathway;21:PI3K-Akt signaling pathway;22:ECM-receptor interaction;23:Basal cell carcinoma;24:Chemliine signaling pathway;25:Pertussis

图3 胃癌样本中PRMT1基因与PPP2R3A、THBS4表达相关性分析
2.5 胃癌组织中PRMT1与AKT蛋白为了进一步验证PRMT1影响PI3K-AKT信号通路的活性,课题组选取临床25例胃癌组织标本,分别利用PRMT1抗体和P-AKT(473Ser)抗体进行免疫组化染色并打分进行分析,发现在下调的PRMT1胃癌组织中AKT 473丝氨酸磷酸化蛋白水平上调(P<0.001),说明PRMT1的表达与AKT的活性负相关,暗示了PRMT1可能抑制PI3K-AKT信号。见图4。
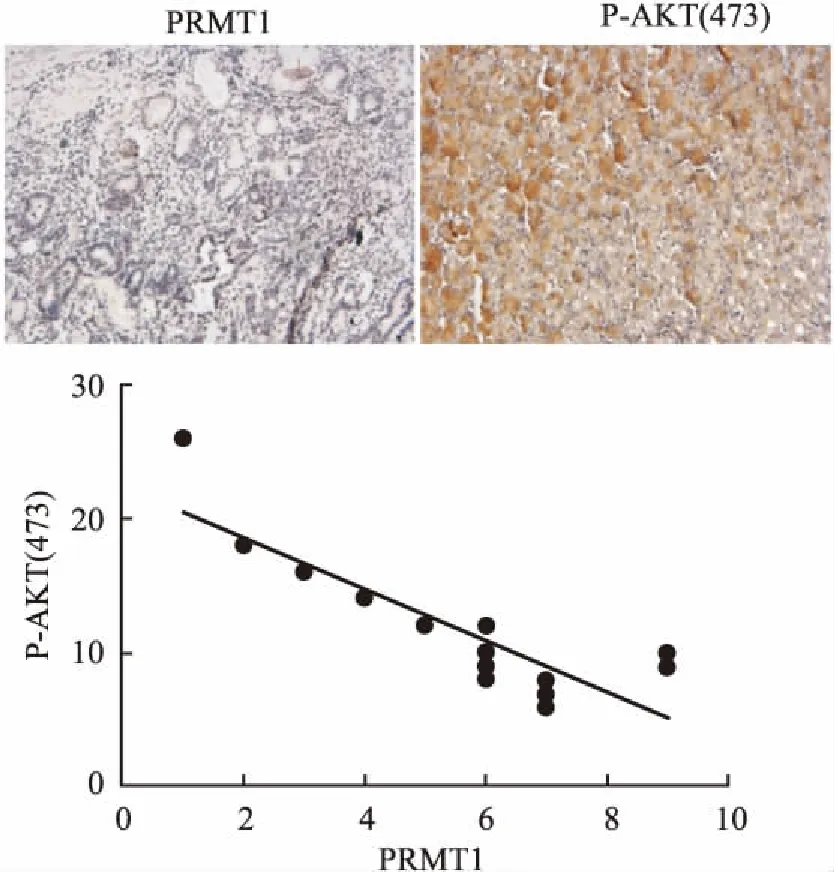
图4 免疫组化染色及相关性分析 ×10
3 讨论
PRMT1在PRMT家族最主要成员中,活性最高,占总催化活性的一半以上。PRMTs催化将s-腺苷甲硫氨酸(S-Adenosyl methionine, SAM) 甲基转移到精氨酸胍基氮原子上,形成对称或不对称的甲基精氨酸[3]。PRMT1属于Ⅰ型PRMTs,哺乳动物中,PRMT1是主要的精氨酸不对称二甲基化酶,占不对称二甲基化酶的90%以上,可以识别多肽RGG/RG序列[4]。在结构上,PRMT1的同源二聚体上含有1个中间腔和2个相对应的活性位点。PRMT1是第1个被克隆的真核PRMT,并且已有证据[5]表明其与p300/CREB结合蛋白、组蛋白乙酰转移酶以及PRMT4/CARM1可以一起充当核受体,作为介导基因转录激活的共激活剂。多年来的研究[6]表明PRMT1广泛参与了细胞内信号转导、转录调节、DNA损伤修复以及mRNA剪接等多种细胞生理活动过程。该研究显示PRMT1基因在胃癌组织中下调,这与以前的研究结果相吻合[7]。
PI3K-AKT信号通路作为恶性肿瘤细胞存活的关键调控因子,已成为人们关注的焦点,许多Akt信号通路抑制剂被发现具有多种功能和特异性。然而,目前对于该信号通路的调控及其在肿瘤生长、侵袭转移中的作用机制尚不明确。课题组利用KEGG对鸟嘌呤和胞嘧啶差异表达基因行富集分析,分析表明显著富集的PI3K/AKT代谢通路中15个基因显著上调。为分析PRMT1是否对PI3K/AKT代谢通路活化起作用,进一步利用cBioportal数据库相关性分析,PRMT1与其中2个基因 (PPP2R3A、THBS4) 紧密相关。
蛋白磷酸酶2A调节亚基B(“protein phosphatase 2 regulatory subunit B” alpha,PPP2R3A)从属B"/PR72家族,为PP2A的调节亚基,有学者[8]发现PPP2R3A可受DNA 甲基化而失活,其C-端甲基化可促进核心酶结合B亚基。PPP2R3A可作为PP2A的调节亚基可促进肝癌的发生发展,具有潜在的促细胞转移作用。有研究[9]指出PP2A抑制剂LB100可以通过作用Thr308和Ser473位点抑制AKT的磷酸化从而抑制肿瘤增值。然而有趣的是,在一些特定的肿瘤中,PP2A抑制剂也能促进AKT的磷酸化[10]。但其在胃癌中的作用及机制尚未见报道,本研究从mRNA水平发现在胃癌组织中PPP3R2A显著上调。这些数据提示,PPP3R2A可能是胃癌治疗的潜在靶点。
THBS4基因是凝血酶敏感蛋白家族(thrombospondins,THBS)新成员,其结构各有一个氨基端和一个羧基端。参与调节细胞间接触、黏附、游走、增殖及血小板聚集。在肿瘤中的研究较少,有的学者[11]指出THBS4在结直肠癌中表达减低,可能与其基因甲基化相关。而THBS4在肝癌中普遍高表达,是预后不良的独立危险因素。Liu et al[12]发现下调THBS4前列腺癌细胞的侵袭转移能力显著下降。Chen et al[13]证实在胃癌组织中THBS4蛋白高表达,促进胃癌生长和转移。课题组从mRNA水平的研究结果与之一致,本研究显示THBS4在胃癌PI3K/AKT代谢通路中富集明显,但具体机制尚不明确,其具体的调控途径还需要进一步的实验的验证。
为了进一步验证PRMT1影响PI3K-AKT信号通路的表达,选取临床25例胃癌组织标本,分别利用PRMT1抗体和P-AKT(473Ser)抗体进行免疫组化并打分进行分析,发现在下调的PRMT1胃癌组织中AKT 473丝氨酸磷酸化蛋白水平上调(P<0.001),说明了PRMT1蛋白影响了AKT蛋白的磷酸化,暗示了PRMT1可能抑制PI3K-AKT信号,这与KEGG分析结果吻合。

