煤基Fe/AC去除废水中苯胺和吡啶的吸附行为和模型优化*
李秉正 吴慧媛 田晋平 杨颖超 鲍宇钢 秦丽娜 王莉霄 刘 达
(太原科技大学环境与安全学院,030024 太原)
0 引 言
煤化工是以煤为原料,经化学手段使煤转化为气体、液体和固体产品或半产品,再经过一系列化学过程加工成化工、能源产品的过程,其主要工艺包括煤的气化、液化、干馏以及焦油精细加工和电石乙炔化工等[1]。目前,煤化工是我国化学工业的重要组成部分。然而,煤化工却是一个高污染的行业,在生产的过程中产生了大量成分复杂的废水[2],如高浓度煤气洗涤废水中含有大量酚、氰、油和氨氮等有毒、有害物质。综合废水中的CODCr一般在5 000 mg/L左右、氨氮在200 mg/L~500 mg/L,废水所含的有机污染物包括酚类、多环芳香族化合物和含氮、氧、硫的杂环化合物等,是一种典型含有难降解有机化合物的工业废水。废水中含有易降解的有机物主要是酚类化合物和苯类化合物,砒咯、萘、呋喃、咪唑类等可降解类有机物以及砒啶、咔唑、联苯、三联苯等难降解类有机物。此外,煤化工废水经生化处理后存在色度和浊度很高的特点(因含各种生色团和助色团的有机物,如3-甲基-1,3,6庚三烯、5-降冰片烯-2-羧酸、2-氯-2-降冰片烯、2-羟基-苯并呋喃、苯酚、1-甲磺酰基-4-甲基苯、3-甲基苯并噻吩和萘-1,8-二胺等)。因此,为实现此类煤气化废水处理后达到回用或排放标准,需进一步降低废水的CODCr、氨氮、色度和浊度等主要指标。
目前,有机废水的处理方法有吸附、氧化、生物降解和光降解等[3]。对于难以生物降解且浓度较低的有机废水,可使用活性炭吸附法处理[4]。活性炭材料以其发达的毛细孔结构以及易改性的表面特性倍受关注。活性炭常被优选用于环境净化和化工医药产品精制领域,是工业生产和人民生活中不可或缺的绿色环保型吸附材料。活性炭不仅对水中溶解的有机物(如苯类化合物、酚类化合物、石油和石油产品等)具有较强的吸附能力,而且能有效去除用生物法及其他方法难以去除的有机物(如有色度、异臭异味、表面活性的物质和胺类化合物等)[5]。在吸附-催化氧化技术中,活性炭担载铁及铁的氧化物对苯酚、甲醛具有较高氧化活性(将所吸附的有机物催化氧化(降解)为无害物),因此,此项技术具有较好的发展前景[6-7]。煤基活性炭是煤炭经充分研磨、模压成型、低温炭化、高温造孔过程后得到的多孔吸附材料,凭借充足、成本低、可再生和效率高等优势受到关注。关于煤基活性炭如何处理其他类型污染物(包括吸附效果和催化氧化效果),以及活性炭负载铁如何影响其他类型污染物(如苯胺和吡啶等)的吸附、催化氧化行为的研究鲜有报道。本实验以苯胺和吡啶为模型化合物,通过制备不同铁负载量的煤基活性炭,研究其对苯胺和吡啶吸附行为(在评价载铁活性炭催化氧化活性时,采用TPO-MS联用技术),以期为指导其相关吸附工艺提供参考。
1 实验部分
1.1 载铁活性炭的制备
本实验原材料采用山西新华化工厂的煤基破碎活性炭,在使用前研磨至粒径为0.30 mm~0.45 mm,110 ℃干燥48 h待用。载铁活性炭(Fe/AC)采用等体积浸渍法制备。制备步骤为:将硝酸铁溶液逐滴滴入活性炭(AC)中,并混合均匀,活性炭浸渍完全后,先在空气中静置2 h,浸渍样于50 ℃和110 ℃各烘干6 h,最后在N2气氛下于250 ℃焙烧2 h,制成的载铁吸附剂用密封玻璃瓶储存,将铁负载量为3%(质量分数,下同)和5%的载铁活性炭,分别记为Fe3/AC和Fe5/AC。
1.2 吸附质
实验所用试剂主要为苯胺、吡啶、九水硝酸铁(均为分析纯)。实验前,用蒸馏水稀释苯胺和吡啶配制苯胺溶液和吡啶溶液。
1.3 吸附剂的结构和表面化学性质
吸附剂表面形貌由S4800型扫描电镜(日本,日立公司)测定。吸附剂比表面积和孔结构采用ASAP2020分析仪(美国,Micromeritics instrument公司)在液氮温度(77 K)下用氮气吸附进行表征。BET比表面积(SBET)、微孔(孔径小于2 nm)孔容及其中孔比表面积分别依据BET方程、t-plot方程计算得到,而中大孔孔容(孔径大于2 nm)则按Density-Functional Theory(DFT)计算得到。
吸附剂表面化学性质通过Boehm滴定法[8]分析。其原理为:用NaOH溶液中和表面的酸性官能团,用盐酸中和表面的碱性官能团。具体步骤是将0.300 g吸附剂置于具塞聚乙烯瓶中,分别加入25 mL 0.1 mol/L的NaOH和HCl溶液,密封后置于HZQ-C型空气浴振荡器(哈尔滨东联电子技术开发有限公司)中,于30 ℃和150 r/min条件下振荡24 h后过滤,并在滤液中加入25 mL HCl或NaOH溶液,最后用标准浓度的NaOH或HCl溶液回滴至终点,由碱或酸的消耗量算出吸附剂上酸性或碱性官能团的含量。
1.4 程序升温氧化实验
在评价Fe/AC催化氧化降解能力时,本实验仅对预吸附苯胺的AC和Fe5/AC进行了程序升温氧化实验(TPO)。预吸附过程如下:将0.5 g样品置于1 000 mg/L苯胺溶液中,并加以振荡,转速为150 r/min,时间为12 h。吸附结束后,过滤并在室温下干燥,AC和Fe5/AC平衡吸附量分别为94.717 mg/g和93.791 mg/g。
程序升温氧化实验在微型管式反应器中进行。具体过程为:将50 mg预吸附苯胺样品置于管式反应器(Φ 6 mm×370 mm)中,并将样品两端用石英棉填充,然后将反应管置于电加热炉中,然后通入O2/Ar(5% O2,12 mL/min),尾气接入Balzers四级杆质谱(QMG 422)。待质谱信号平稳后,开始由室温程序升温到500 ℃,升温速率为10 ℃/min。
1.5 吸附实验
1.5.1 调变吸附时间实验
分别称取0.5 g的AC,Fe3/AC和Fe5/AC吸附剂放入具塞三角瓶中,移入50 mL初始质量浓度分别为100 mg/L和2 500 mg/L的苯胺或吡啶溶液,混合后,将三角瓶放置于空气浴振荡器(30 ℃)中,以150 r/min进行振荡吸附,并于不同吸附时间(1.5 min,3 min,5 min,10 min,20 min,30 min,40 min,1 h,1.5 h,2 h,2.5 h,3 h,4 h,5 h,6 h,8 h,10 h,12 h,15 h,18 h,20 h和24 h)移取吸附溶液,将样品过滤、常温干燥,密封保存。过滤液吸光度用紫外可见分光光度计在波长λ=230 nm(苯胺)和波长λ=252 nm(吡啶)处进行检测。t时刻的吸附量(qt)通过式(1)计算:
(1)
式中:qt为t时刻吸附剂的苯胺或吡啶吸附量,mg/g;ρ0和ρt为溶液中吸附质初始质量浓度和t时刻质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
1.5.2 等温吸附实验
吸附振荡48 h,其他吸附条件与1.5.1小节相同。待吸附平衡后取出过滤,并测定其残余质量浓度,其平衡吸附量(qe)通过式(2)计算:
(2)
式中:qe为活性炭对苯胺或吡啶的平衡吸附量,mg/g;ρe为溶液中吸附质平衡浓度,mg/L。
1.5.3 调变温度吸附实验
调变吸附温度(20 ℃,30 ℃,40 ℃和50 ℃),振荡48 h,其他吸附条件与1.5.1小节中的吸附条件相同,吸附平衡后吸附液的吸光度测定同1.5.1小节的吸光度测定。
1.6 动力学研究
吸附过程的动力学研究主要是用来描述吸附剂吸附吸附质的速率,通过动力学模型对数据进行拟合,从而探讨吸附机理。本研究选择100 mg/L和2 500 mg/L两种质量浓度,对苯胺在AC,Fe3/AC和Fe5/AC上的吸附动力学数据进行研究,并用准一级动力学方程[9-10]、准二级动力学方程[11-12]和Elovich动力学方程[11]对吸附动力学数据进行拟合,以得到最佳描述。
1.6.1 准一级吸附模型
采用Lagergren方程[9]计算吸附速率,该模型为:
qt=qe-qee-k1t
(3)
式中:k1为准一级吸附速率常数,1/min;t为吸附时间,min。
1.6.2 准二级吸附模型
准二级动力学模型预测了包括外部膜液扩散、表面扩散和粒子内扩散等一系列的吸附行为[11],因此应用更普遍,并与准一级吸附模型相比在吸附速率控制步骤上机理是一致的。准二级动力学模型方程为:
(4)
式中:k2为准二级吸附速率常数,g/(mg·min)。
1.6.3 Elovich动力学方程
该模型是Elovich在20世纪30年代提出的,表明吸附率随吸附剂表面的吸附能力的增加呈指数减少[9]。这个模型的线性数学方程表示如下:
qt=(1/βE)ln (αEβE)+(1/βE)ln (t)
(5)
式中:αE为初始吸附速率常数,mg/(g·min);βE为脱附速率常数,g/mg。
1.7 等温模型拟合
1.7.1 Langmuir模型
Langmuir模型是常用的吸附等温模型之一,它假设吸附剂均匀吸附在表面上且吸附材料表面有一定数量的吸附位,所有吸附位的能量都相同,吸附平衡时,吸附速度和脱附速度相等[13],是单分子层吸附等温模型。
该模型的线性表达式为:
(6)
式中:QL为Langmuir吸附参数,表示单位吸附剂的最大苯酚吸附容量,mg/g;KL为Langmuir吸附参数,与吸附的自由能有关,L/mg。
根据Langmuir模型,另一个非常重要的参数是RL(用于预测苯酚/吸附剂的亲和力)可以通过公式(7)计算[14]:
(7)
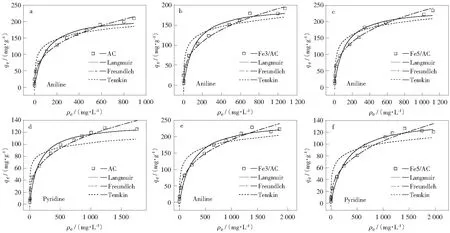
式中:ρ0为初始苯酚溶液的质量浓度,mg/L;RL为Langmuir吸附常数,RL的值表明等温线的类型。当RL>1时,说明不利于吸附;RL=1时,吸附量为常数;0 1.7.2 Freundlich模型 Freundlich模型是一个有关吸附的重要模型,它是基于吸附在非均相和具有不同能量的活性位上且该模型认为吸附可逆[15]。 Freundlich模型的线性表达式为: (8) 式中:KF为Freundlich吸附常数,与吸附能有关,(mg/g)(L/mg)1/n;n为Freundlich吸附常数,与吸附强度(推动力和吸附位能量)有关。1/n表示吸附强度,n>1则表示吸附过程易于发生[16]。 1.7.3 Temkin模型 Temkin模型考虑了吸附剂/吸附质的相互作用的影响,所有分子的吸附热与覆盖情况呈线性递减关系[17-18]。该模型的线性形式为: qe=FlnKT+Flnρe (9) 式中:F为Temkin常数,与吸附热相关,J/mol;KT为Temkin常数,与平衡结合能相关,L/mg。 吸附热力学参数(ΔG°,ΔH°和ΔS°)[19]通过公式(10)获得: (10) 式中:ΔG°为标准吉布斯自由能变,kJ/mol;ΔH°为标准焓变,kJ/mol;ΔS°为标准熵变,kJ/mol;K为热力学平衡常数;R为理想气体常数,8.314 J/(mol·K);T为热力学温度,K。 图1所示为AC,Fe3/AC和Fe5/AC的SEM照片。由图1可以看出,AC表面有许多不规则且孔径不一的孔。三种吸附剂表面外孔的多寡规律呈现为AC≫Fe3/AC≫Fe5/AC,即Fe负载量越高的材料外表面孔越少,这是由于Fe(NO3)3处理时堵塞部分外孔所致。 图1 AC和Fe3/AC及Fe5/AC的SEM照片Fig.1 SEM photos of AC, Fe3/AC and Fe5/ACa—AC;b—Fe3/AC;c—Fe5/AC 表1所示为AC,Fe3/AC和Fe5/AC的化学组成。由表1可知,AC灰分的质量分数最低(11.43%),Fe5/AC灰分的质量分数最高(16.50%)。采用Fe(NO3)3处理明显增加活性炭的灰分含量,使吸附剂表面具有一定的不均匀性。吸附剂的碳含量变化趋势与灰分含量变化趋势相反(即碳含量随着灰分含量的增加而降低)。与AC相比,Fe3/AC和Fe5/AC的H,N和S含量无显著变化,但氧含量显著增加(即Fe3/AC和Fe5/AC的O含量分别增加了53.9%和39.9%),结合Fe的负载量仅为5%(假设其全部转化为Fe2O3(一种灰分成分),Fe2O3仅为7.1%),实际Fe2O3的理论O增加量仅为2.1%,这表明Fe(NO3)3处理增加的灰分O只占很小一部分,主要增加了非灰分的表面O,即在活性炭表面可能产生了一些含氧官能团。与非灰分的表面O相比,Fe2O3的理论O增加量非常小,故可忽略。 表1 吸附剂灰分含量及元素分析(w/%)Table 1 Ash amount and ultimate analysis of adsorbents(w/%) 吸附剂的物理结构和孔径分布见表2和图2。由表2和图2可知,与AC相比,Fe3/AC和Fe5/AC的微孔孔容(Vmic)、中孔孔容(Vmeso)和中孔比表面积(Smeso)略有差别,但没有明显变化。 表2 吸附剂的结构Table 2 Textural properties of adsorbents 结合图1可知,氧化铁主要负载于载体活性炭大孔内。上述结果表明,Fe(NO3)3处理对活性炭微孔和中孔无显著影响。 表3所示为吸附剂的表面化学性质。由表3可知,AC和Fe5/AC的碱性官能团含量相似,Fe3/AC的碱性官能团含量最低。Fe3/AC和Fe5/AC的表面酸性含氧官能团(羧酸、内酯和酚羟基)含量显著高于AC的表面酸性含氧官能团含量,这是由于在硝酸铁热解过程中产生了一些氧化性气体氧化了活性炭表面。由表3还可知,表面酸性官能团含量的大小次序为Fe5/AC,Fe3/AC,AC,表明吸附剂表面酸性官能团含量随着铁负载量增加而增加。这些官能团(含有非C杂原子)在一定程度上也使吸附剂表面具有不均匀性(非均相性)。需要说明的是,金属负载过程增加活性炭表面的含氧官能团使活性炭孔道变细,可能阻碍了液氮分子进入微孔。 图2 吸附剂的孔径分布Fig.2 Pore size distribution of adsorbents 表3 吸附剂的表面化学性质(mmol·g-1)Table 3 Surface chemistry property of adsorbents(mmol·g-1) 图3所示为吸附苯胺AC的TPO产物。由图3a可知,在约400 ℃前AC-C6H7N和AC-Blank具有相似的CO2释放曲线,说明AC所吸附的苯胺没有被氧化为CO2。然而,在约215 ℃时AC-C6H7N的O2消耗曲线开始偏离AC-Blank曲线。由图3b 图3 吸附苯胺AC的TPO产物Fig.3 Products released from C6H7N-adsorbing AC in TPO 可知,N2和H2O微小的释放曲线,说明苯胺的胺基发生了部分氧化。由图3c可知,在整个TPO过程中未检测出AC-C6H7N释放的苯胺、苯酚和苯,这说明TPO中苯胺没有脱附,也没有产生苯酚和苯等其他降解产物并释放出来。由图3还可知,苯胺部分氧化产物可能发生聚合并沉积于AC表面。上述结果说明,载体AC几乎不具备催化氧化降解苯胺的能力,该结果类似于Cu/AC催化氧化苯胺的载体AC行为[20]。 图4所示为吸附苯胺Fe5/AC的TPO产物。由图4a可知,在约110 ℃前,Fe5/AC-C6H7N与Fe5/AC-Blank的O2消耗曲线是重合的,而在约110 ℃时,Fe5/AC-C6H7N的O2消耗曲线则开始偏离Fe5/AC-Blank的O2消耗曲线,且前者的消耗O2量大于后者的消耗O2量,这可能是由于苯胺的降解或氧化。在温度区间220 ℃~390 ℃,Fe5/AC-C6H7N的CO2释放曲线与Fe5/AC-Blank的CO2释放曲线存在一定的偏离,这说明苯胺在该温区发生氧化,且苯胺的起始氧化温度为220 ℃,Fe5/AC载体AC的燃点为390 ℃。由图4b可知,Fe5/AC-C6H7N的N2释放曲线在约220 ℃时开始偏离Fe5/AC-Blank的N2释放曲线,这说明苯胺的胺基中氮原子脱氢被氧化为N2,该过程同时也伴随着H2O的释放,上述N2和H2O释放规律正好对应于CO2的产生和O2的消耗(相互印证),进一步说明苯胺在220 ℃~390 ℃确实发生了氧化。另外,在220 ℃前也有H2O的释放,结合O2的消耗规律说明在220 ℃(氧化前)苯胺发生部分降解,产生了一些水分子。值得注意的是,在TPO中并未检测到苯胺脱附和苯酚、苯(苯胺的部分降解产物)。这说明苯胺部分降解产物发生聚合反应,并可能沉积到Fe5/AC上。结合图4中Fe5/AC和图3中AC的TPO行为可知,Fe5/AC具有催化氧化所吸附苯胺的活性,并可以将苯胺氧化为CO2,N2和H2O,苯胺催化氧化是由于载体AC表面所负载的Fe2O3催化氧化作用。由于Fe的催化氧化起始温度略低于CuO/AC的催化氧化起始温度[20],说明Fe2O3活性略高些。Fe2O3对苯胺的催化作用类似于CuO或Fe2O3对苯酚催化氧化作用[21-22]。 图4 吸附苯胺Fe5/AC的TPO产物Fig.4 Products released from C6H7N-adsorbing Fe5/AC in TPO 与湿法氧化条件(5 MPa,200 ℃)相比[23-24],上述操作条件(常压、250 ℃)在技术上具有可行性和更强的实用性。由于Fe/AC对吡啶的TPO行为类似于Cu/AC对吡啶的情形[20],可得Fe/AC也具有催化氧化吡啶活性。 2.3.1 苯胺吸附 图5所示为不同初始质量浓度下苯胺吸附量与吸附时间的关系。由图5可知,不论是初始质量浓度高低(即低浓度(100 mg/L)、高浓度(2 500 mg/L))还是吸附剂差异,吸附剂的苯胺吸附量随着吸附时间的变化趋势是相似的,即吸附过程包括三个阶段:快速吸附期(吸附剂在吸附开始后约120 min内)、慢速吸附期(120 min~300 min)、吸附平衡期(300 min后)。在吸附初期,该阶段吸附量随吸附时间增加而快速增加,并且可以完成该初始质量浓度下平衡吸附量的85%左右;在慢速吸附期,完成该初始质量浓度下平衡吸附量的15%左右。 图5 不同初始质量浓度下苯胺吸附量与吸附时间的关系Fig.5 Relation of qt with contact time at different initial mass concentrations of aniline solution■—AC;○—Fe3/AC;▲—Fe5/ACa—Initial concentration of aniline solution is 100 mg/L;b—Initial concentration of aniline solution is 2 500 mg/L 由图5还可知,在吸附低质量浓度(100 mg/L)苯胺溶液时,与文献[13]报道的苯酚吸附行为相似,同一时刻三种吸附剂的苯胺吸附量无显著差异,说明负载金属Fe对活性炭吸附低质量浓度苯胺的行为没有实质影响。当吸附高质量浓度(2 500 mg/L)苯胺溶液时,随着时间增加,吸附剂的吸附量略有差别:对于同一吸附时间,Fe/AC的吸附量小于略AC的吸附量,最终AC,Fe3/AC和Fe5/AC苯胺吸附量分别为167 mg/g,166 mg/g和164 mg/g,即吸附剂的吸附量随着铁负载量增加而降低,降低的幅度由大到小依次为AC,Fe3/AC,Fe5/AC,说明金属担载量越高越不利于活性炭对苯胺的吸附,这与其对苯酚的吸附行为一致[13]。如前所述,吸附量减少是由于吸附剂结构和表面化学性质的变化,硝酸铁处理对活性炭孔结构无实质影响,故排除结构的影响;表面化学性质包括Fe2O3和表面含氧官能团,由文献[25]可知灰分对吸附行为无显著影响的规律,而Fe2O3本身为无机物,属于一种灰分,因而可以忽略Fe2O3的影响。Fe2O3的O对于活性炭表面O贡献非常小,因此,在研究活性炭表面化学性质时只考察表面含氧官能团是合理的。活性炭表面酸性官能团增加不仅降低了色散作用,而且酸性官能团还增加了炭表面的亲水性[26-27],这些原因都可以抑制活性炭对以疏水性为主的苯胺的吸附。由此可见,活性炭负载Fe带来的表面化学性质(主要是含氧官能团)变化在很大程度上影响了活性炭的吸附性能。 为进一步揭示吸附机理,本实验采用准一级、准二级和Elovich三种动力学方程对吸附剂吸附苯胺数据(见图5)进行拟合,苯胺溶液的质量浓度分别为100 mg/L和2 500 mg/L,拟合参数见表4。由表4可知,对于低质量浓度(100 mg/L)苯胺吸附,由于准二级模型的拟合相关系数(R2值)大于其他两种模型的拟合相关系数,因此,准二级模型比其他两种模型更适合描述低质量浓度苯胺的吸附过程。对高质量浓度(2 500 mg/L)苯胺吸附,Elovich方程拟合的相关系数远大于其他两种模型的相关系数,说明Elovich方程更适合描述高质量浓度苯胺吸附。 表4 吸附剂对100 mg/L和2 500 mg/L苯胺溶液的吸附动力学拟合参数Table 4 Parameters of kinetic fitting of adsorptive models for adsorbents for 100 mg/L and 2 500 mg/L aniline solutions 2.3.2 吡啶吸附 图6所示为不同初始质量浓度下吡啶吸附量与吸附时间的关系。由图6可知,吸附时间对吡啶吸附量变化趋势与苯胺吸附相似,即吸附过程包括三个阶段:快速吸附期(吸附剂在吸附开始后约120 min内)、慢速吸附期(120 min~300 min)、吸附平衡期(300 min后)。在吸附初期,吸附量随着吸附时间增加而快速增加,并且可以完成初始浓度下平衡吸附量的80%左右;在慢速吸附期,完成该初始浓度下平衡吸附量的20%左右。上述结果表明,吡啶的吸附速率慢于苯胺的吸附速率。 与吸附低浓度(100 mg/L)苯胺溶液不同,同一时间(>120 min)三种吸附剂的吡啶吸附量存在较大差异,说明负载金属Fe影响了活性炭吸附低浓度吡啶的行为,即吸附剂的吸附量随着铁负载量增加而降低(AC>Fe3/AC>Fe5/AC),类似于低质量浓度苯胺吸附过程。在吸附高浓度(2 500 mg/L)吡啶溶液时,随着时间增加(>10 min),吸附剂的吸附量开始呈现不同趋势,并且具有明显差别:对于同一吸附时间,Fe3/AC和Fe5/AC的吸附量远小于AC的吸附量,而Fe3/AC的吸附量略大于Fe5/AC的吸附量,最终AC,Fe3/AC和Fe5/AC吡啶吸附量分别为122 mg/g,102 mg/g和100 mg/g。上述结果表明,Fe负载量高低似乎对高质量浓度吡啶吸附影响不大。这是由于,当吸附亲水性更强的吡啶时,溶液中发生了活性炭表面(固体)与吡啶分子之间的吸附(极性相吸)以及水分子(溶剂)与吡啶分子(溶质)之间的极性溶解(溶剂化作用,二者之间互溶)的竞争。由于吡啶溶剂化作用很强,抑制了活性炭对吡啶的吸附,所以同一吸附时间活性炭的吡啶吸附量小于苯胺吸附量。在吸附高质量浓度(2 500 mg/L)吡啶溶液时,由于负载Fe增加活性炭表面酸性官能团(主要是含氧官能团),进而增加亲水性的叠加效应,这种情况更为明显,进一步降低了活性炭的吸附性能。 图6 不同初始质量浓度下吡啶吸附量与吸附时间的关系Fig.6 Effect of contact time in qt of pyridine■—AC;▲—Fe3/AC;△—Fe5/ACa—Initial mass concentration of pyridine is 100 mg/L;b—Initial mass concentration of pyridine is 2 500 mg/L 同理,仍采用准一级、准二级和Elovich三种动力学方程对活性炭吸附上述100 mg/L和2 500 mg/L吡啶溶液的数据(见图6)进行拟合,拟合参数见表5。由表5可知,与苯胺吸附行为不同,不论吸附低质量浓度或高质量浓度苯胺溶液,由于准二级方程的拟合相关系数(R2值)大于其他两种模型的拟合相关系数。因此,准二级方程比其他两种模型更适合描述吡啶吸附过程。 表5 吸附剂对100 mg/L和2 500 mg/L吡啶溶液的吸附动力学拟合参数Table 5 Parameters kinetic fitting of adsorbents for 100 mg/L and 2 500 mg/L pyridine solutions 需要说明的是,在吸附高质量浓度吸附质(尤其是吸附吡啶)时,铁的负载明显降低了吸附量(即弱化了吸附性能),因此Fe/AC不能处理高质量浓度废水。在吸附低质量浓度吸附质时,铁的负载对吸附影响不大(保持了吸附性能),同时负载Fe自身又具有较高催化降解活性,所以Fe/AC就具有吸附和催化氧化双功能,因此,将Fe/AC应用于处理降解低浓度有机废水是有意义的。 由于不同温度的吸附行为相似,故本实验仅列出在30 ℃时吸附剂吸附苯胺和吡啶的数据,并采用Langmuir,Freundlich和Temkin模型分别进行非线性拟合,所得拟合曲线如图7所示,其拟合参数见表6。由图7和表6可知,Freundlich模型拟合线几乎穿过所有吸附实验点或几乎平均分散在拟合线两边。比较各模型拟合的相关系数R2值大小,可得Freudlich模型拟合效果最佳(通常Freundlich模型主要描述非均匀表面的吸附过程[17])。上述结果是由于吸附剂表面具有不同数量的含氧官能团导致其表面呈现不同程度的不均匀性,这恰与硝酸铁处理后增加了活性炭的O含量规律及酸性、碱性官能团规律相一致(见表3)。 图7 30 ℃下吸附剂吸附苯胺和吡啶的等温曲线Fig.7 Adsorption isotherms of aniline or pyridine using adsorbents at 30 ℃ 表6 不同吸附等温模型拟合参数Table 6 Fitting parameters of different adsorption isotherm models 温度是吸附过程中的一个重要参数。图8所示为不同温度下吸附剂对初始质量浓度为500 mg/L的苯胺和吡啶溶液的平衡吸附量。由图8可知,AC,Fe3/AC和Fe5/AC对苯胺和吡啶的平衡吸附量均随着温度升高而降低,这说明吸附过程是放热的,高温不利于吸附,这是由于高温使吸附质更易从吸附剂表面上脱附下来。 图8 不同温度下吸附剂对初始浓度为500 mg/L的苯胺和吡啶溶液的平衡吸附量Fig.8 Equilibrium adsorbing capacity of aniline and pyridine solution at 500 mg/L by adsorbents at different temperatures 为揭示吸附过程中热力学本质,本实验通过公式(10)计算吸附的标准吉布斯自由能变(ΔG°)、标准焓变(ΔH°)和标准熵变(ΔS°)[19],然后再给予分析。 吸附剂吸附苯胺和吡啶的热力学参数见表7。由表7可知,所有温度的ΔG°均小于零,说明吸附过程是自发进行的,这从热力学上支持本实验吸附实验能够顺利进行的事实。在同一温度下ΔG°值表面上随着AC铁负载含量的增大而下降,结合前面结论,实际上说明吸附剂的吸附自发性与其含氧官能团含量有一定关系。所有吸附中ΔH°值均小于零,说明吸附是放热的,其从热力学上证实了高温不利于吸附的现象。所有ΔS°值均小于零,表明吸附剂上苯胺和吡啶的吸附在固/液界面混乱度降低。 表7 吸附剂吸附苯胺和吡啶的热力学参数Table 7 Thermodynamic parameters of adsorption of aniline and pyridine onto adsorbents 1) 硝酸铁处理对煤基活性炭的孔结构无显著影响,氧化铁主要负载于活性炭大孔,但硝酸铁处理显著增加活性炭表面酸性含氧官能团。 2) 活性炭不具有催化氧化苯胺的作用,而活性炭负载铁具有催化氧化苯胺活性,并将苯胺氧化降解为CO2,H2O和N2。 3) 吸附100 mg/L苯胺和吡啶溶液时,硝酸铁处理对吸附量无显著影响,而吸附2 500 mg/L苯胺和吡啶溶液时,AC,Fe3/AC和Fe5/AC对苯胺的吸附量分别为167 mg/g,166 mg/g和164 mg/g,AC,Fe3/AC和Fe5/AC对吡啶的吸附量则分别为122 mg/g,102 mg/g和100 mg/g,说明硝酸铁处理可以降低苯胺和吡啶的吸附量(吡啶吸附量降低幅度更为显著),这是由酸性含氧官能团的增加和吸附质亲水性叠加作用所致。 4) Freundlich模型较好描述活性炭对苯胺和吡啶的吸附过程,其源于吸附剂表面的非均相性。准二级方程较好描述吡啶和低浓度苯胺吸附,而Elovich方程则适用于高浓度苯胺的吸附。 5) 吸附剂吸附量随温度升高而略下降,吸附剂吸附苯胺和吡啶是一个自发的、放热的过程。 6) 载铁活性炭适用于处理低浓度苯胺和吡啶废水。1.8 等温吸附热力学研究
2 结果与讨论
2.1 吸附剂的结构和表面化学性质




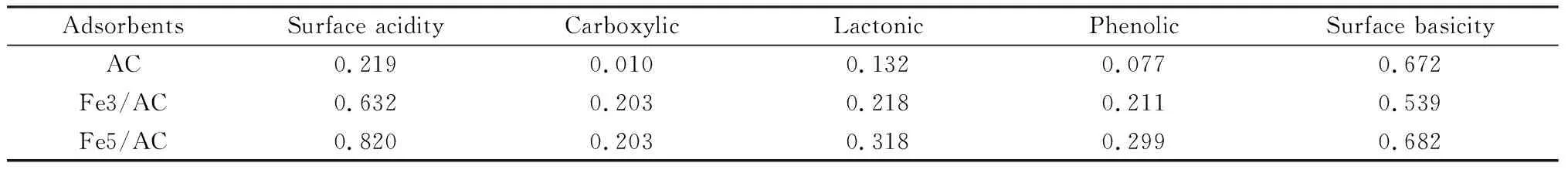
2.2 TPO行为
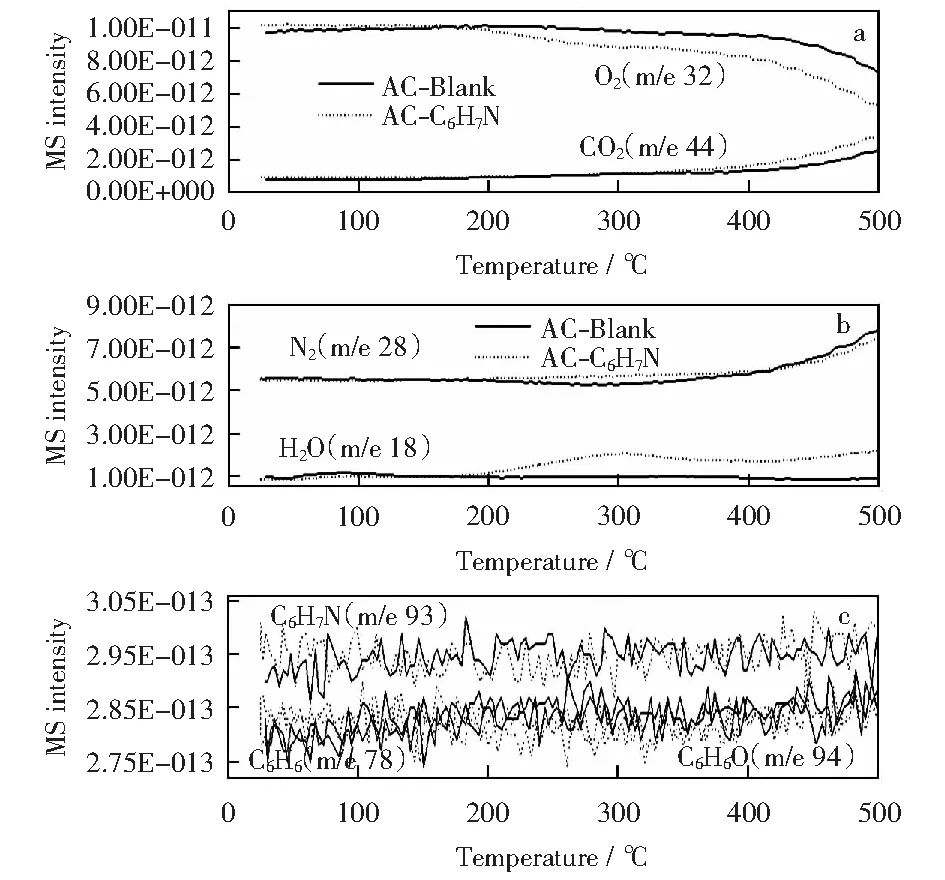

2.3 吸附动力学
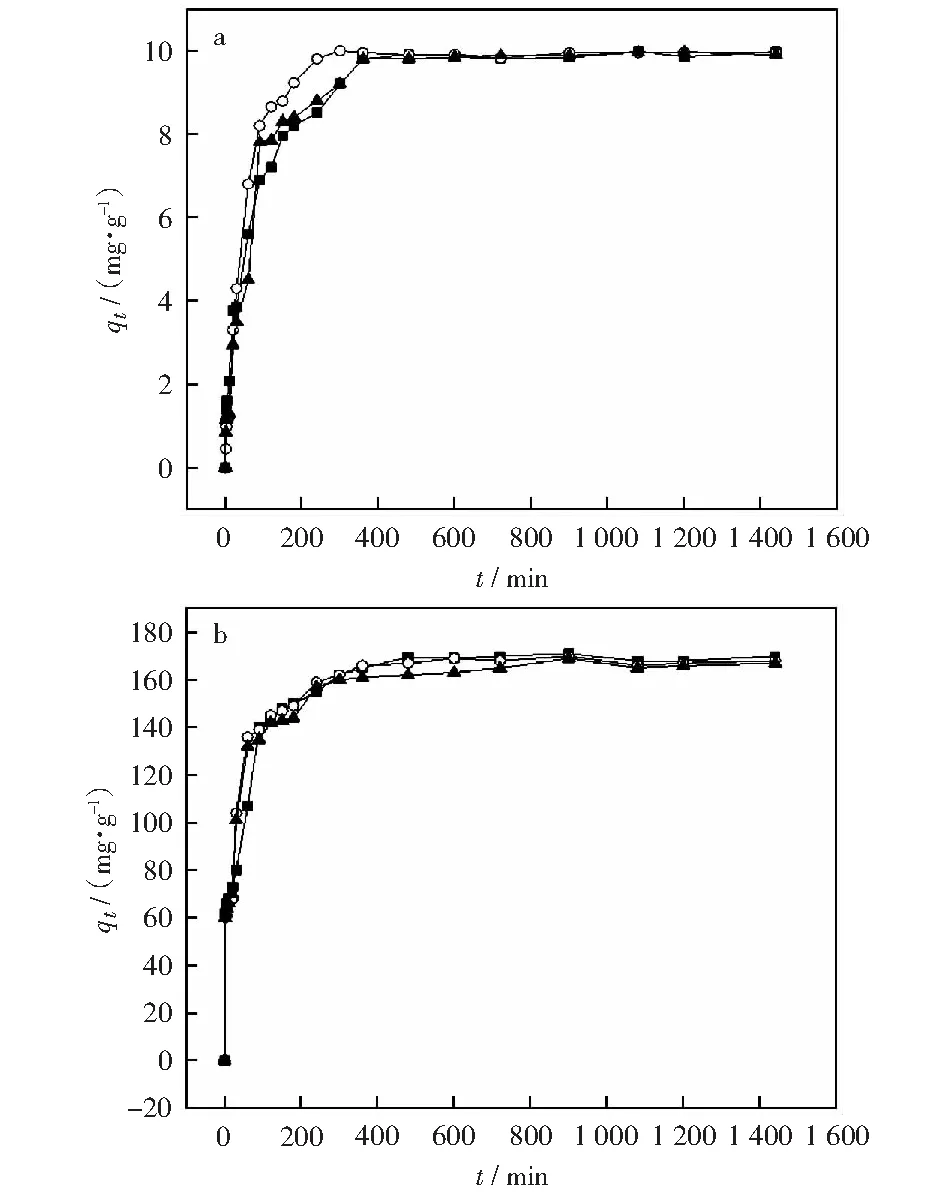

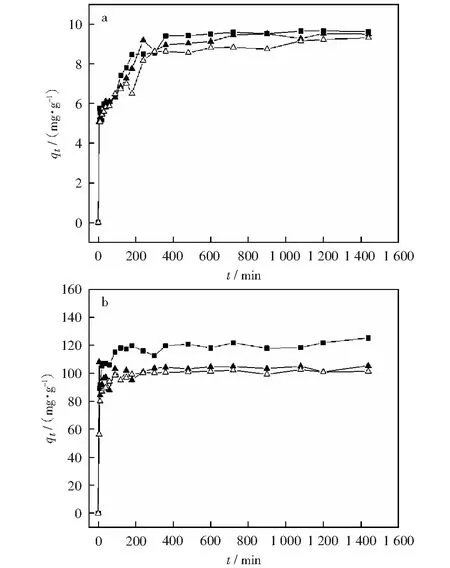
2.4 等温吸附模型拟合

2.5 吸附热力学研究


3 结 论

