利用分子标记及花药培养快速改良五山丝苗
徐丽媛 周桂林 冯睿彤 范家萌 周贤达 周红英 吴晓亮


摘 要:将五山丝苗/R0356作为亲本,使用分子标记辅助育种和水稻花药培养相结合的方法,仅需2年即得到稳定遗传的与五山丝苗性状相似且带有香味的恢复系材料。具体方法是通过分子标记检测F2代材料,确定单株材料中是否含有香味基因,对含有香味基因的单株在孕穗期取样进行水稻花药培养,培养过程使用的诱导培养基为M8+2.0mg/L 2,4-D+1.0mg/L KT+60g/L蔗糖+8g/L琼脂,花药培养得到的纯合二倍体绿苗再进行分子标记检测,将含有香味基因的材料在田间种植,经过筛选后即得到优质的改良五山丝苗(HPR10)。
关键词:分子标记检测;花药培养;恢复系选择;香味
中图分类号 S511文献标识码 A文章编号 1007-7731(2020)12-0014-03
Abstract: With the combination of molecular marker assisted breeding and rice anther culture, it takes only 2 years to get the restorer line materials with stable genetic characteristics similar to wushansimiao / r0356 as parents. The specific method is to detect F2 generation materials by molecular markers to determine whether there is fragrance gene in the single plant materials. The single plant with fragrance gene is sampled at booting stage for rice anther culture, and the induction medium used in the culture process is M8+2.0mg/l 2,4-D+1.0mg/l KT+60g/L sucrose+8g/L agar, The pure diploid green plantlets obtained from anther culture were detected by molecular markers, and the materials containing fragrance genes were planted and propagated in the field. After screening, the high quality improved wushansimiao(hpr10) were obtained.
Key words: Molecular marker detection; Anther culture; Restoration line selection; Fragrance
中國是世界上最大的水稻生产和消费国,杂交水稻的成功选育,为保障国家粮食安全供给做出了巨大的贡献[1]。近年来,随着生活质量的提高,国民对稻米食味品质的需求有所提高,给育种工作带来了新的机遇和挑战[2]。
传统的育种手段对优质材料的纯化效率偏低,1个材料需要4~5年才能选育出纯合材料。水稻花药培养技术利用花药诱导愈伤分化获得单倍体绿苗,单倍体绿苗DNA加倍后即得到纯合二倍体材料,这种方法能够缩短育种时间,加快育种速度。但在实际操作过程中,有很多因素影响培养效果[3-4]。
作为高品质稻米的一个重要特性,含有香味特性的稻米更受市场青睐。在稻米香味的选育过程中,直接有效的方式是对水稻香味基因进行检测。现在水稻全基因组序列已经明确,香味功能基因的分子标记已经比较成熟[6-7]。通过分析得到与香味基因紧密连锁的分子标记基因,可以直接进行检测[8]。在其他农艺性状不变的前提下对恢复系进行改良,变成食味品质更佳的材料,对于推动农业高质量发展具有重要的意义[9]
本研究对恢复系进行了快速改良,将分子标记辅助选择、水稻花药培养技术与传统的育种手段结合,在育种的低世代获得含有目的基因的纯合材料,以期缩短育种周期,提高育种效率[10]。
1 材料与方法
1.1 供试材料 供试材料:五山丝苗、R0356。五山丝苗的株型较紧凑、抗倒力中强、成穗率高;R0356的株高较高、剑叶挺、粒型细长、含有香味,但茎秆较细,抗倒性弱。所有材料均由合肥丰乐种业股份有限公司水稻研究院提供。
1.2 试验方法
1.2.1 分子标记检测 水稻苗期,在田间取叶片进行检测,使用DNA快速提取方法获取样品DNA溶液[11]。多态性标记引物GRFM04[12]序列为F:GTTAGGTTGCATTTACTGGGAG,R:GAATGATGCTCAA AGTGTCT,扩增体系为:DNA提取液2.0μL、10 x Buffer 1.0μL、dNTP 0.8μL、引物0.5μL、Taq酶0.1μL和ddH2O 5.6μL。PCR反应程序为:94℃预变性2min;35个循环:①变性94℃,15s,②退火55℃,15s,③延伸72℃,30s;72℃延伸5min,4℃保存。PCR扩增产物使用4%聚丙烯酰胺凝胶进行电泳检测。
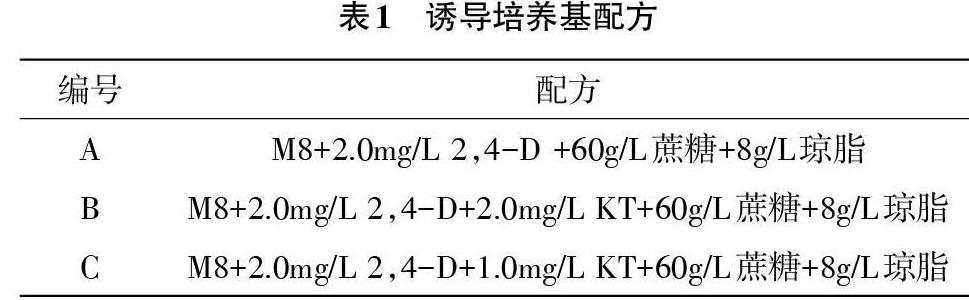
1.2.2 水稻花药培养 取材时选择处在单核靠边期的花粉,目测处于水稻剑叶与倒二叶叶枕距5~8cm时,接种过程使用剪颖抖药法。培养过程采用3步培养法:诱导培养时以M8为基本培养基,配合多种激素,具体激素添加量如表1所示;分化培养时以MS为基本培养基;生根培养时以1/2MS为基本培养基。培养基pH均为5.8。
1.3 选育过程 2017年8月,丰乐种业苏小水稻基地利用五山丝苗/R0356构建群体,同年12月,海南种植BC1F1群体,去除假杂种,其余种子混合收获。2018年5月,在F2代中选取3个较好的株系命名为CR1、CR2、CR3,每个株系群体种植1000株,苗期取单株叶片进行基因检测分析,对检测到含有香味基因的材料进行花药培养得到H0代幼苗,同年12月将培养出的H0代幼苗移栽至三亚种植。田间种植后,对结实较好的正常苗进行取材,寄回合肥进行香味基因的检测,收获含有香味基因的H1代材料单穗。2019年5月,在合肥种植H1,并进行配合力测定。2019年12月进行了三亚比较试验,筛选得到符合目标性状的H2代株系并进行选择和进一步利用。选育流程如图1所示。[2017年08月 五山丝苗/R0356 合肥-构建群体
2017年12月 F1 三亚-去假杂种,混收2018年5月 F2 合肥-种植群体,选取三个较好的株系,单株检测,花药培养2018年12月 H0 三亚-种植花培苗,检测香味基因,单穗收2019年5月 H1 合肥-株行种植,配合力测定2019年12月 H2 三亚-筛选、利用 ]
2 结果与分析
2.1 改良群体分子标记检测结果 对每个群体所有单株(共1000个)进行检测,CR1、CR2、CR3分别得到137、164、121个含有香味基因的单株,部分分子检测电泳图谱见图2。图2所示为CR1株系1-90号单株检测电泳图谱,其中CK为含有目的基因的条带。由图2可知,CR1材料1~90号单株中,有14个单株的带型与CK带型相同,分别为3、7、10、21、25、31、37、38、39、56、57、58、59、60。将这些编号的材料在田间找出并标注,在合适时期取材进行花药培养。
2.2 影响水稻花药培养的因素 水稻花药培养过程中,愈伤组织诱导率受取材时间和诱导培养基配方2个因素的影响较大。
2.2.1 不同取材时间对诱导效果的影响 愈伤组织生成数统计日期为转接花药后第75天,转接花药数目统计按照每个单株转接2瓶,每瓶转接50枚花药计算。通过表中的数据可以看到,不同取材时间的诱导率不同,CR1在7月27日取材时诱导率最低,随后逐渐上升,8月16日取材时诱导效率最高,CR2在7月27日所取材料得到最高的诱导率,随后逐渐降低,CR3在7月27日和8月16日取材的诱导率较低,8月6日取材的诱导率最高。由于不能对每个细胞都进行镜检,不同材料的单株状态并不完全相同,同一株系内水稻单株又具有不同的分蘖。经过试验发现,需要多次对同一材料进行田间取材,才能够得到较高的诱导率。
2.2.2 不同激素对诱导花药愈伤组织效果的影响 从图3可以看出,3种配方诱导产生的愈伤组织个数,培养基B在3个材料上均表现出低诱导率,培养基C在3个材料上均表现出高诱导率,因此在培养过程中使用培养基C进行培养能够获得更多的愈伤组织。
2.3 改良效果 经过花药培养,共生成330株绿苗,将绿苗从培养基中取出,洗净根系后移栽种植。移栽到大田时用遮阳网盖住,防止弱苗被阳光直射导致死苗,7d后绿苗叶片舒展,施少许复合肥使其快速生长,根据绿苗长势选择需要的单株,将未加倍的单倍体、结实差和农艺性状不好的单株去除,留取符合育种目标的单株进行单穗收获,第2季将单穗进行株行种植,后期进一步观察。目前,通过该技术选择得到30个含有香味的稳定株系,经过一系列田间比较试验,最终筛选得到优质改良恢復系HPR10。该材料与五山丝苗相似,但导入了R0356的香味基因,含有香味,配合力更好、株高适中、分蘖强、抗倒性较强。
3 讨论
由于籼稻花药培养诱导率的高低受基因型的影响较大,针对不同材料需找到适合的培养方法。由于愈伤诱导后期的分化培养阶段均使用常规MS培养基,本文仅对诱导愈伤组织阶段培养基进行改良,通过试验得到了一种对该材料实用性较高的配方,并且采取一个株系多次取材的方法,保证材料其有较高的愈伤组织诱导率。
由于当前分子标记检测的费用较低,且操作简便,可对所有需要检测的材料都进行检测。本试验经检测结果仅有14%的单株含有香味基因,通过检测增加了选取材料的精确度,减轻了田间育种工作量。
与其他育种材料相比,改良恢复系的可利用价值更高,分子生物学和细胞生物学的快速发展,为育种单位缩短育种年限、提高育种效率提供了切实可行的途径。本研究针对性的将田间育种、分子标记辅助选择、水稻花药培养3种方法进行结合,充分利用现代科技手段,快速改良恢复系并得到了预期材料。
参考文献
[1]程式华.中国超级稻育种技术创新与应用[J].中国农业科学,2016(2):205-206.
[2]王建康,李慧慧,张学才,等.中国作物分子设计育种[J].作物学报,2011,37(2):191-201.
[3]冯双华,赵森,郭家源,等.不同培养基和激素对超级杂交稻花药培养力的影响[J].西南农业大学学报(自然科学版),2006,28(4):523-525.
[4]王茂良,冯慧.花药离体培养研究进展[J].北京农学院学报,2010,25(3):70-75.
[5]Yu H,Xie W,Li J,et al. A whole-genome SNP array (RICE6K)for genomic breeding in rice[J]. Plant Biotechnology Journal,2014,12(1):28-37.
[6]Phing Lau W C,Latif M A,et al. Advances to improve the eating and cooking qualities of rice by marker-assisted breeding[J].Critical Reviews in Biotechnology,2016,36(1):87-98.
[7]Luo W L,Guo T,Yang Q Y,et al. Stacking of five favorable alleles for amylase content,fragrance and disease resistance into elite lines in rice (Oryza sativa) by using four HRM-based markers and a linked gel-based marker[J].Molecular Breeding,2014,34(3):805-815.
[8]王岩,付新民,高冠军,等.分子标记辅助选择改良优质水稻恢复系明恢63的稻米品质[J].分子植物育种.2009,7(4):661-665.
[9]周黎军,王丽,魏琴,等.利用水稻早世代稳定特性选育杂交水稻恢复系[J].中国水稻科学,2007,21(3):265-269.
[10]关世武.花药培养技术在寒地水稻育种中的应用研究[J].中国农学通报,2005,21(5):94-96.
[11]周桂林,刘启燕,范家萌,等.SSR分子标记高效选择抗稻瘟病双基因Pi-1、Pi-2的技术体系[J].安徽农业科学,2017,45(18):115-117.
[12]王丰,李金华,柳武革,等.一种水稻香味基因功能标记的开发[J].中国水稻科学,2008,22(4):347-352.
(责编:张宏民)

