青海极端生境7株萎缩芽孢杆菌的生物活性
杨 雪, 谢永丽, 陈 兰, 吴晓晖, 武玲玲, 孟晓霞, 夏介卓玛
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室;2.青海省高寒草地适应性管理重点实验室,青海 西宁 810016)
萎缩芽孢杆菌(Bacillusatrophaeus)是芽孢杆菌属的一个重要种,芽孢为椭圆形,不膨大[1],菌落不透明、无光泽、不规则,边缘不整齐[2].该菌能产生抗逆芽孢,在抗低温、抗盐碱、抗辐射等方面表现突出,因此具有抗逆性强、无致病性、安全可靠等特点[3].萎缩芽孢杆菌是枯草芽孢杆菌(B.subtilis)的黑色变种,其对病原菌同样具有较强的拮抗活性,近年来成为植物病害生物防治的研究热点.
芽孢杆菌能够通过代谢途径产生多种抗菌物质[4].其中,泛革素(fengycin)[5]、表面活性素(surfactin)[6]和伊枯草菌素(iturin)[7]三大脂肽类化合物的结构稳定[8],在植物病害防治中发挥着重要作用.刘邮洲等[9]发现,萎缩芽孢杆菌合成的脂肽类物质能抑制草莓枯萎病菌(Fusariumoxysporumf. sp.fragariae)的生长,且随着剂量的增加,抑制效果逐渐加强;同时,脂肽类粗提物中具有拮抗病原细菌的surfactin和fengycin.还有研究表明,芽孢杆菌能产生消化酶,如蛋白酶、脂肪酶、淀粉酶、纤维素酶等,促进家畜胃肠道对饲料的消化吸收,维持有益菌群平衡状态,提高饲料利用率[10].此外,将纤维素酶应用于秸秆还田,能大幅度提高农作物秸秆的利用率[11].因此,筛选有益芽孢杆菌菌源对保护高原的生态环境和促进农牧业生产具有重要意义.
已报道的萎缩芽孢杆菌都来源于普通生境,有关低温、缺氧、干旱极端环境的萎缩芽孢杆菌生物活性的研究尚少.本试验以分离自青海不同极端环境的7株芽孢杆菌为研究对象,通过生理生化特征测定、16S rDNA和gyrB基因序列分析对其进行鉴定,测定其拮抗病原真菌活性、抑菌物质、降解纤维素活性、耐逆性及固氮活性,以期筛选出具有优质生物学性状的芽孢杆菌资源.
1 材料与方法
1.1 材料
7株供试芽孢菌株分别分离自青海省海西州托素湖盐碱地黑枸杞(Lyciumruthenicum)根围、大格勒荒漠沙地红柳(Tamarixramosissima)根围和茶卡盐湖周边骆驼蓬(Peganum)根围.病原指示菌:瓜类枯萎病菌(Fusariumoxysporum)、油菜菌核病菌(Sclerotiniasclerotiorum)、大白菜软腐病菌(Erwiniaamylovora)由青海大学高原草地资源与生态省部共建实验室保存.
培养基: LB培养基用于芽孢杆菌的活化及培养[12];PDA培养基用于病原真菌的培养[13];NA培养基用于病原细菌的培养[12];改良阿须贝(Ashby)无氮液体培养基用于芽孢杆菌固氮能力检测[14];低温1C培养基用于芽孢杆菌耐低温检测[15];CMC 培养基用于芽孢杆菌降解纤维素活性检测[16].
1.2 形态鉴定及生理生化特性测定
将供试芽孢杆菌接种于LB固体培养基中,置于30 ℃恒温培养箱培养24 h,观察菌株的单菌落形态和菌苔形态,记录其特征.生理生化试验参照文献[17-18].
1.3 分子鉴定
1.3.1 16S rDNA基因序列分析 16S rDNA扩增引物:正向引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′),反向引物1492R(5′-GGYTACCTTGTTACGACTT-3′).PCR扩增条件:95 ℃ 4 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,共34个循环,72 ℃ 10 min.对16S rDNA扩增产物进行测序,将测序结果运用NCBI数据库进行BLAST序列比对,分析菌株同源性[19],并运用MEGA 7.0对供试菌株和6个已知菌株B.atrophaeusLKYLW-1(登录号:MF375905.1)、B.atrophaeusXAAS.xj4(登录号:MN187264.1)、B.atrophaeus402SS2(登录号:MK713721.1)、B.atrophaeusY30(登录号:MK721047.1)、B.atrophaeusZ78(登录号:MG470729.1)、B.atrophaeusNEL-002(登录号:MN640828.1)进行系统发育分析[20].
1.3.2gyrB基因序列分析gyrB基因扩增引物:正向引物gyrB-For(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′),反向引物gyrB-Rev(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′).PCR扩增条件:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,共30个循环,72 ℃ 8 min.对gyrB扩增产物进行测序,将测序结果运用NCBI数据库进行BLAST序列比对,分析菌株同源性[19],并运用MEGA 7.0对供试菌株和6个已知菌株B.atrophaeusBKS1-45D(登录号:HM585086.1)、B.atrophaeusLSSC3(登录号:GU994861.1)、B.atrophaeusBCRC 17123(登录号:DQ309296.1)、B.atrophaeus5127 st(登录号:KF194289.1)、B.atrophaeusATCC 49760(登录号:CP014840.1)、B.atrophaeusBA59(登录号:CP024051.1)进行系统发育分析[20].
1.4 拮抗病原真菌活性测定
将油菜菌核病菌和瓜类枯萎病菌活化后打菌碟,接种于PDA平板上,在平板等距离对称的点上,放上直径4 mm的滤纸片,吸取7株菌株TSH5、DGLWZ10、DCD1、CKL1、CKL4、CKL5、CKL6的菌液5 μL点于滤纸片中央,重复3次,置于26 ℃条件下培养3 d后,观测并记录抑菌圈直径[21].
1.5 脂肽类化合物的分离及鉴定
1.5.1 脂肽类化合物粗提 选择菌株DCD1、CKL1单菌落于LB液体培养基中活化,将菌液转接于Landy培养基进行发酵,30 ℃条件下培养38 h[22].发酵培养结束后,离心取上清,将上清液pH调至2.0,4 ℃贮存过夜后,离心取其沉淀,加入甲醇后调节pH至7.0,再用甲醇多次浸提并将浸提液混匀,获得脂肽类粗提物[23].
1.5.2 MALDI-TOF-MS质谱分析 利用MALDI-TOF-MS质谱,通过质荷比(m/z)分析供试芽孢杆菌菌株DCD1、CKL1的脂肽类粗提取物的种类[23],基质为α-氰-4-羟肉桂酸(α-cyano-4-hydroxy-cinnamic acid).
1.5.3 脂肽类化合物活性检测 采用平板对峙法测定菌株DCD1、CKL1的脂肽类提取物对大白菜软腐病菌的拮抗活性.将大白菜软腐病菌菌液与NA培养基按1∶30混匀,制成含菌平板,取待测脂肽类粗提物点于平板等距离的滤纸片中央,以甲醇点在滤纸片中央作为对照,放入26 ℃恒温培养箱中培养过夜[21],每个处理重复3次,观察抑菌结果.
1.6 耐逆性测定
1.6.1 耐盐性 选择菌株DCD1、CKL1、CKL4、CKL5、CKL6分别接种于含3%、5%、7%、9%、11%、13%、15% NaCl的LB液体培养基中,37 ℃、200 r·min-1过夜培养12 h,吸取50 μL菌液分别涂于含3%、5%、7%、9%、11%、13%、15% NaCl的固体LB平板上,置于37 ℃条件下培养,重复3次,一周内每天观察并记录菌株生长情况[24].
1.6.2 耐低温性 选择菌株DCD1、CKL1、CKL4、CKL5、CKL6接种于低温1C液体培养基中,过夜培养12 h,取10 μL菌液于1C固体培养基上,分别在 4、10、14、18 ℃的恒温培养箱进行培养,重复3次,观察并记录菌株每天的生长情况[24].
1.7 降解纤维素活性测定
在CMC培养基平板等距离对称的4个点上,放置直径4 mm的滤纸片,将菌株DCD1、CKL1、CKL4、CKL5、CKL6接种在LB液体培养基中,37 ℃、200 r·min-1过夜培养12 h,取待测菌液5 μL点于滤纸片中央,每个处理重复3次.37 ℃培养2 d,将Gram碘染液注入平板表面,盖上皿盖,静置4 min后倒去染液,计算透明圈直径与菌落直径的比值(A),A越大说明降解纤维素活性越大[25].
1.8 固氮能力测定
挑取活化的芽孢杆菌菌株DGLWZ10转接于10 mL改良Ashby无氮液体培养基中,37 ℃、200 r·min-1培养10 d后,取出菌液与对照(Ashby无氮液体培养基)进行比较,观察菌株在无氮培养基中的活化程度.
2 结果与分析
2.1 形态特征及生理生化特性
7株菌株的菌落形态均为表面不规则,边缘波状、不整齐,乳白色,不透明(图1).7株菌株除厌氧生长为阴性外,接触酶、V-P测定、厌氧试验、硝酸盐还原、7% NaCl、丙酸盐利用、淀粉水解、甘露糖、氧化酶、革兰氏染色、甘油、明胶反应均为阳性.参照文献[17-18],初步鉴定7株菌株为萎缩芽孢杆菌.
2.2 分子生物学特征
2.2.1 16S rDNA序列分析 以菌株TSH5、DGLWZ10、DCD1、CKL1、CKL4、CKL5、CKL6的基因组DNA为模板扩增16S rDNA基因片段,扩增到大小约1 300 bp的PCR特征性条带,与芽孢杆菌16S rDNA基因的理论值[26]基本相符.BLAST比对结果表明:菌株TSH5与B.atrophaeusATCC49760的16S rDNA序列同源性为99%,菌株DGLWZ10与B.atrophaeusMAS20的16S rDNA序列同源性为98%, DCD1与B.atrophaeusBKS1-45的16S rDNA序列同源性为100% ,CKL1与B.atrophaeusXAAS.xj4的16S rDNA序列同源性为99%,CKL4、CKL5、CKL6与B.atrophaeusEGI131的16S rDNA序列同源性为100%.通过MEGA 7.0构建16S rDNA基因序列系统发育树,结果表明7株供试菌株与B.atrophaeus亲缘关系较近(图2).
2.2.2gyrB基因序列分析 以菌株TSH5、DGLWZ10、DCD1、CKL1、CKL4、CKL5、CKL6的基因组DNA为模板扩增gyrB基因片段,扩增到大小约1 300 bp的PCR特征性条带,与芽孢杆菌gyrB基因的理论值[27]基本相符.BLAST比对结果表明:菌株TSH5与B.atrophaeusATCC49760的gyrB基因序列同源性为98%,菌株DGLWZ10、CKL1与B.atrophaeusLSSC3的gyrB基因序列同源性分别为97%、100%,菌株CKL6与B.atrophaeusBKS1-45的gyrB基因序列同源性为100% ,DCD1与B.atrophaeusBCRC 17530的gyrB基因序列同源性为98%,CKL4、CKL5与B.atrophaeusFA12的gyrB基因序列同源性均为98%.通过MEGA 7.0构建gyrB基因序列系统发育树,结果表明7株供试菌株与B.atrophaeus聚在同一个分支,表明其亲缘关系较近(图3).结合形态特征、生理生化特性及分子生物学特征,确定7株菌为萎缩芽孢杆菌(Bacillusatrophaeus).
2.3 拮抗病原真菌活性
菌株TSH5、DGLWZ10、DCD1、CKL1、CKL4、CKL5、CKL6对病原真菌的抑菌圈直径均>16 mm,说明7株菌均具有显著的拮抗病原真菌活性.其中,菌株DGLWZ10抑制瓜类枯萎病菌的活性最佳,菌株TSH5抑制油菜菌核病菌的活性最佳(图4、表1).

表1 萎缩芽孢杆菌对瓜类枯萎病菌和油菜菌核病菌的拮抗活性1)
1)+:抑菌圈直径0~5 mm;++:抑菌圈直径5~10 mm;+++:抑菌圈直径10~15 mm;++++:抑菌圈直径>15 mm.
2.4 抑菌物质测定结果
MALDI-TOF-MS质谱图(图5)分析显示,菌株DCD1在m/z为1 030.720、1 044.830、1 058.830处的3个离子峰均对应于脂肽类化合物surfactin的分子质量;在m/z为1 080.750处的离子峰对应于脂肽类化合物bacillomycins D的分子质量;在m/z为1 485.830、1 499.831处的2个离子峰均对应于脂肽类化合物fengycin的分子质量.菌株CKL1在m/z为1 030.920、1 044.920处的2个离子峰均对应于脂肽类化合物surfactin的分子质量;在m/z为1 485.580处的离子峰对应于脂肽类化合物fengycin的分子质量.菌株DCD1、CKL1产生的脂肽类化合物在含大白菜软腐病菌的NA培养基平板上均产生了抑菌圈(图6).由此推断菌株DCD1和CKL1拮抗病原菌活性可能与其产生抗菌作用的脂肽类化合物有关.
2.5 菌株的耐逆性
2.5.1 耐盐性 菌株DCD1可在含3%、5%、7%、9% NaCl的平板上正常生长;菌株 CKL1、CKL4、CKL5、CKL6均可在含3%、5%、7%、9%、11%、13% NaCl的平板上正常生长,表现出一定的耐盐性;在含15% NaCl的培养基上,5株菌株均不能生长(表2).
2.5.2 低温适生性 在14、18 ℃条件下培养1 d后,5株菌株均能正常生长;在10 ℃条件下,5株菌株快速生长,2 d后均生长出菌苔;在4 ℃条件下,5株菌株可缓慢生长(表2).可见,菌株DCD1、CKL1、CKL4、CKL5、CKL6表现出良好的低温适生性.
2.6 菌株的降解纤维素活性
菌株DCD1、CKL1、CKL4、CKL5、CKL6在CMC培养基上均可产生透明圈,表明5株菌株具有不同程度的降解纤维素活性.菌株CKL6和DCD1形成的透明圈直径最大,均为17 mm,A分别为2.4和2.36(图7、表3),表现出较强的降解纤维素活性.
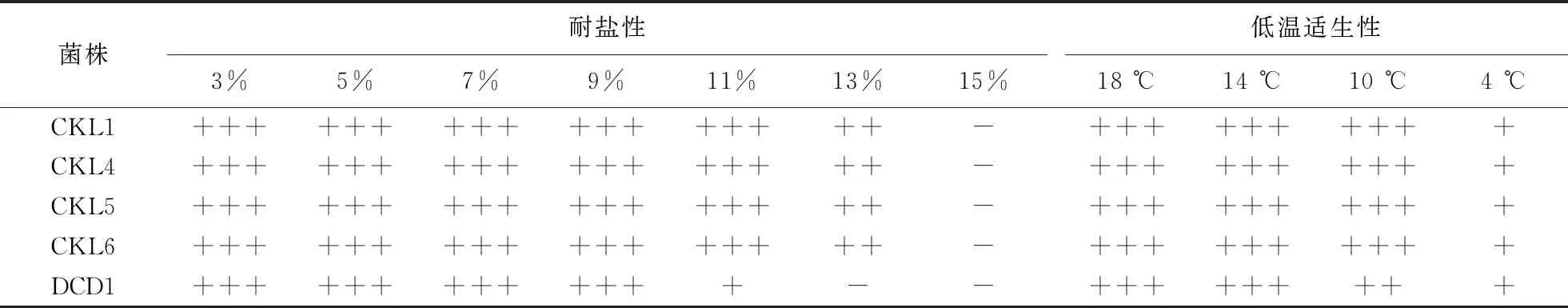
表2 5株萎缩芽孢杆菌菌株的耐盐性及低温适生性1)
1)+++:生长良好;++:正常生长;+:缓慢生长;-:不能生长.
2.7 菌株固氮活性
拮抗活性较好的菌株DGLWZ10,经改良Ashby无氮液体培养基培养后的发酵液比对照浑浊(图8),表明菌株DGLWZ10可在无氮培养基中生长,推测其具有一定的固氮能力.
3 讨论
青海高原具有海拔高、气温低、降水少、低氧、强紫外辐射的极端气候条件,因此孕育出丰富的耐逆性萎缩芽孢杆菌资源[28].本研究对分离自青海极端生境的萎缩芽孢杆菌的耐盐性和耐低温性进行检测,结果表明菌株CKL1、CKL4、CKL5、CKL6具有较强的低温适生性和耐盐性.青海的低温气候造成了大量秸秆资源的利用率低且难以处理,焚烧又会加重环境的污染[29].本研究通过CMC法检测了萎缩芽孢杆菌菌株DCD1、CKL1、CKL4、CKL5、CKL6降解纤维素的活性,结果表明5株萎缩芽孢杆菌均具有一定的降解纤维素活性,在饲料加工及秸秆还田方面具有一定的应用潜力.
本研究结果表明,7株萎缩芽孢杆菌菌株TSH5、DGLWZ10、DCD1、CKL1、CKL4、CKL5、CKL6对病原真菌瓜类枯萎病菌和油菜菌核病菌具有较强的拮抗活性.据报道,萎缩芽孢杆菌能够抑制多种植物病害,如植物病菌大丽轮枝菌(Verticilliumdahliae)[30]、杨树炭疽病菌(Colletotrichumgloeosporioide)[31]、小麦赤霉病菌(Gibberellazeae)[32]等.此外,通过MALDI-TOF-MS质谱分析发现菌株DCD1能产生脂肽类化合物surfactin、fengycin、bacillomycins D,菌株CKL1能产生脂肽类化合物surfactin、fengycin;同时,这些脂肽类化合物均能在含大白菜软腐病菌的平板上产生抑菌圈.黄华毅等[33]发现,枯草芽孢杆菌STO-12 的脂肽类化合物能够抑制枣缩果病菌(Alternariatenuissima)、杨树炭疽病菌和杨树腐烂病菌(Cytosporachrysosperma)的生长,同时在高温、强酸强碱、紫外线等条件下仍能够表现出稳定的抑菌活性;向亚萍等[34]发现,解淀粉芽孢杆菌(B.amyloliquefaciens)B1619菌株抑制番茄枯萎病菌(Fusariumoxysporumf. sp.lycopersici)生长的重要物质是脂肽类化合物bacillomycinL、fengycins和surfactins.因此,推断菌株DCD1、CKL1的抑菌活性与脂肽类物质有关.研究表明,禾本科植物具有和一些微生物联合固氮的习性[35],能够增加土壤的养分,提高作物的产量.本研究发现DGLWZ10菌株具有固氮活性,这种非共生的固氮作用对青海农牧业发展具有重要意义.

