合成生物技术制备脂肪族二元胺的研究进展
王昕,王静,陈可泉,欧阳平凯
(南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏省国家先进材料协同创新中心,江苏 南京211816)
脂肪族二元胺作为基础化学品,在聚酯、聚氨酯、聚酰胺等高分子材料的合成中占有重要地位[1-2]。2020 年仅聚酰胺类高分子材料的全球市场预计可达970万吨[3],高分子材料广阔的市场空间使得对材料单体的需求日益增大。然而,这些材料单体大多通过化学法合成,存在原料依赖化石资源、合成过程污染严重、环境安全隐患大等问题,尤其化学合成二元胺的核心技术长期被国外跨国公司垄断,已成为我国相关高分子材料领域“卡脖子”的重要因素。以自然界中可再生资源为原料通过生物制造合成二元胺,具有过程绿色、环境友好、资源节约等优点,且制备出的生物基材料不仅可以取代传统材料,性能还有望超越传统材料,未来潜力巨大。同时,生物制造合成二元胺工艺的开发可打破我国高分子材料领域对国外进口的长期依赖,是我国生物制造国家发展战略的重要组成部分。
赖氨酸、精氨酸、鸟氨酸等碱性氨基酸在化学结构上含有一个羧基和两个氨基,被认为是合成C3~C5脂肪族二元胺(1,3-丙二胺、1,4-丁二胺、1,5-戊二胺)的理想前体化合物。当前,英国帝斯曼、中国科学院微生物研究所、南京工业大学、上海凯赛生物产业有限公司、宁夏伊品生物科技股份有限公司、日本味之素株式会社等国内外研究单位和公司均开展了大量的生物基二元胺制备研究[4],但大多利用静息细胞转化法以氨基酸为原料催化脱羧合成,成本较高[5-6]。开发以糖类等生物质为原料直接发酵合成二元胺的工艺,可进一步降低二元胺的生产成本,是实现二元胺规模化生产的关键,近年来受到广泛关注。
随着合成生物技术的快速发展,人类通过设计、合成和组装代谢途径,改造微生物产生新的化合物,构建高效的细胞工厂,使得生物燃料、医药、化学品等的一系列产品的生物制造成为可能[7]。利用合成生物学技术,通过对碱性氨基酸代谢途径的设计改造,1,3-丙二胺、1,4-丁二胺、1,5-戊二胺等C3~C5脂肪族二元胺的生物合成不断取得新的进展。本文重点关注了C3~C5的脂肪族二元胺的生物合成途径,介绍了合成生物学工具在构建和优化工程细胞合成二元胺,以及提高产品合成过程经济性方面的应用,综述了国内外生物基二元胺合成领域取得的突出进展,展望了未来生物基二元胺菌株改造的重点方向。
1 C3~C5脂肪族二元胺的生物合成途径
在生物体内,C3~C5脂肪族二元胺1,3-丙二胺、1,4-丁二胺和1,5-戊二胺的合成均衍生于碱性氨基酸(赖氨酸、鸟氨酸或精氨酸)的代谢途径[8]。当前,已发现模式菌株大肠杆菌具有直接合成1,5-戊二胺和1,4-丁二胺的能力,但产量极微。而常见的氨基酸生产宿主谷氨酸棒状杆菌缺乏二元胺的天然合成能力,因此了解微生物合成二元胺的代谢途径,对高效二元胺细胞工厂的构建至关重要。
1.1 1,5-戊二胺的生物合成途径
在微生物体内,1,5-戊二胺是通过赖氨酸脱羧酶催化赖氨酸脱羧形成的[9]。对于赖氨酸的合成,在微生物中存在两种不同的途径:始于α-酮戊二酸和乙酰CoA 的α-氨基己二酸途径(AAA)和始于天冬氨酸的二氨基庚二酸途径(DAP)。其中AAA途径主要存在于高等真菌和古生菌中,具有2种变异途径;而DAP 途径有4 种不同的变异途径,主要存在于细菌和植物。在常见的赖氨酸生产菌株大肠杆菌和谷氨酸棒状杆菌中,都通过DAP 途径合成赖氨酸,但催化路径有所差异,如图1所示,谷氨酸棒状杆菌中既可以通过二氨基庚二酸脱氢酶(DDH) 直接催化六氢吡啶二羧酸转化为二氨基庚二酸,也可以通过DapD、DapC、DapE、DapF 经四步催化完成转化,而在大肠杆菌中需要DapD、DapC、DapE、DapF 经四步催化形成二氨基庚二酸,进一步转化合成赖氨酸[9]。
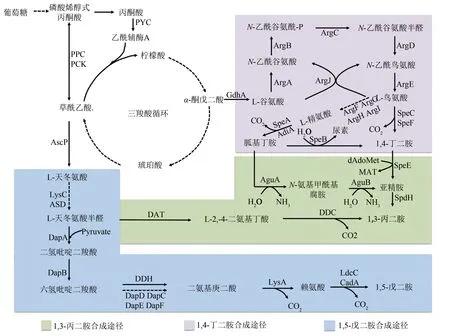
图1 C3~C5脂肪族二元胺的生物合成途径[8-13](实线箭头为一步代谢途径,虚线箭头为一步以上代谢途径。绿色为1,3-丙二胺合成途径,紫色为1,4-丁二胺合成途径,蓝色为1,5-戊二胺合成途径)Fig.1 The biosynthetic pathway of the aliphatic diamines with 3~5 carbon atoms(The solid arrows indicate one-step metabolic pathways,and the dotted arrows indicate multiple-step metabolic pathways.The green square represents the synthetic pathway of 1,3-propanediamine,the purple square represents the synthetic pathway of 1,4-butanediamine synthesis route,and the blue square represents the synthetic pathway of 1,5-pentanediamine)
1.2 1,4-丁二胺的生物合成途径
1,4-丁二胺在微生物体内的合成途径有两种,包括鸟氨酸脱羧途径和精氨酸脱羧途径[10]。如图1所示,L-鸟氨酸和L-精氨酸的生物合成途径始于TCA循环中间体α-酮戊二酸(α-KG)。谷氨酸脱氢酶(GDH)将α-KG生物转化为L-谷氨酸后,在N-乙酰谷氨酸合酶(ArgJ)、N-乙酰谷氨酸激酶(ArgB)、N-乙酰-γ-谷氨酰氨基-磷酸还原酶(ArgC)、乙酰鸟氨酸氨基转移酶(ArgD)和L-鸟氨酸乙酰基转移酶(ArgE)一系列酶的催化作用下生成L-鸟氨酸。L-鸟氨酸可进一步在L-鸟氨酸氨基甲酰基转移酶(ArgF)、精氨酸琥珀酸酯合酶(ArgG)、精氨酸琥珀酸裂解酶(ArgH)和L-鸟氨酸氨基甲酰基转移酶I(ArgI)的催化作用下生成L-精氨酸[11-12]。以鸟氨酸为前体,在鸟氨酸脱羧酶的催化作用下,可以一步合成1,4-丁二胺。而以精氨酸为前体,通过精氨酸脱羧酶和胍丁胺酶(SpeB)两步催化产生1,4-丁二胺[10]。
1.3 1,3-丙二胺的生物合成途径
1,3-丙二胺的生物合成途径仅在极少数微生物中发现,包括两条:假单胞菌属中的C5途径和不动杆菌属中的C4途径[13]。如图1 所示,在C5途径中,以L-谷氨酸为前体,通过一系列酶催化反应,经鸟氨酸或精氨酸合成1,4-丁二胺,进而在亚精胺合成酶(SpeE)的催化作用下合成亚精胺,亚精胺在亚精胺脱氢酶(SpdH)的作用下合成1,3-丙二胺。在C4途径中,以L-天冬氨酸为前体生成天冬氨酸半醛,进而在2-酮戊二酸-4-氨基转移酶(DAT)、L-2,4-二氨基丁酸酯脱羧酶(DDC)的催化作用下合成1,3-丙二胺。
2 二元胺合成菌株的构建和优化
当前,通过对已知生物基二元胺代谢途径进行设计、重组和组装,在大肠杆菌、谷氨酸棒状杆菌等菌株中,已开展了大量生物基二元胺合成的工作。利用合成生物学技术,如功能元件的进化和理性设计、调控元件的优化、途径的适配性调控、基因组的修饰和改造等(图2),进一步使得产二元胺人工细胞的性能得到优化。
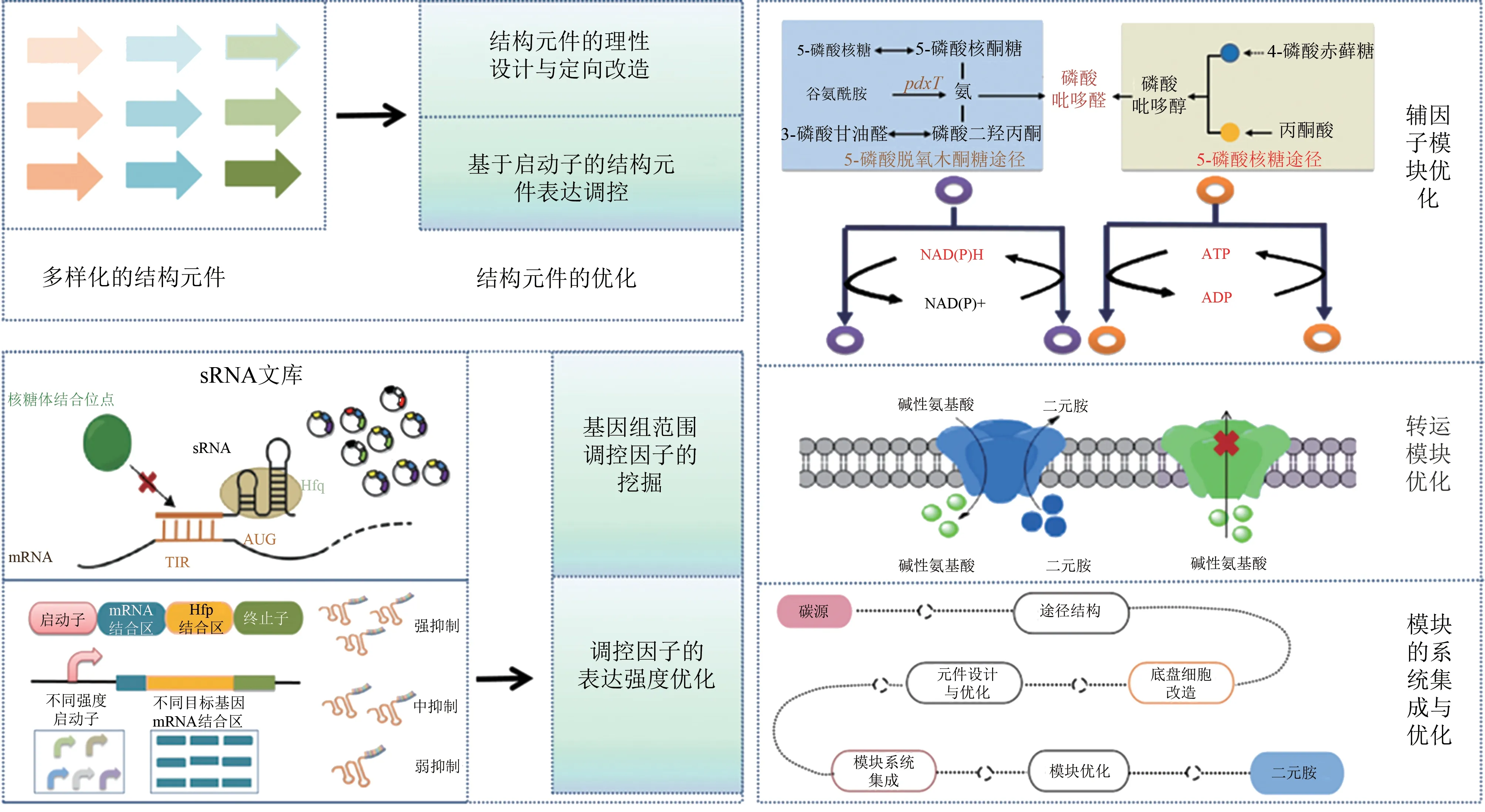
图2 二元胺合成细胞的优化策略[14-48]Fig.2 The engineering strategy for the optimization of diamine synthetic cells[14-48]
2.1 二元胺合成途径的构建
大肠杆菌存在天然的1,5-戊二胺和1,4-丁二胺代谢途径,通过对代谢途径中关键功能元件的表达调控以及旁支代谢途径的敲除,实现了大肠杆菌对1,5-戊二胺和1,4-丁二胺的发酵生产。2011年,Qian等[14]在E.coliW3110 中通过过表达赖氨酸脱羧酶(CadA),同时抑制与1,5-戊二胺降解相关的代谢途径,在30 h 的发酵后获得9.6 g/L 1,5-戊二胺,生产速率为0.32 g/(L·h),葡萄糖转化率仅为0.12 g/g;2009 年,韩国Sang Yup Lee 研究团队[15]首次通过过表达鸟氨酸脱羧酶SpeC/SpeF、敲除SpeE、亚精胺乙酰转移酶(SpeG)以及1,4-丁二胺分解代谢基因puuA阻断1,4-丁二胺的降解和利用途径、敲除鸟氨酸代谢的旁支途径、过表达鸟氨酸合成途径相关基因等策略,最终获得了基因工程菌株在6.6L 反应器规模下基于葡萄糖分批补料策略,1,4-丁二胺产量达24.2g/L。
以谷氨酸棒状杆菌为宿主,通过对异源二元胺合成途径的组装,构建获得了产1,5-戊二胺、1,4-丁二胺的重组谷氨酸棒状杆菌。2007 年Mimitsuka 等[16]通过将来源于大肠杆菌的CadA 整合到谷氨酸棒状杆菌的基因组上,成功实现了谷氨酸棒状杆菌发酵生产1,5-戊二胺,产量达2.6 g/L。2010 年,德国的Schneider 和Wendisch[10]首次在谷氨酸棒状杆菌中分别构建了依赖于鸟氨酸脱羧酶和精氨酸脱羧酶的1,4-丁二胺合成途径,发现基于鸟氨酸脱羧酶的1,4-丁二胺途径具有更高的合成效率,实现了1,4-丁二胺在谷氨酸棒状杆菌中的发酵合成。
大肠杆菌和谷氨酸棒状杆菌均缺乏1,3-丙二胺的天然合成途径,2015年,韩国的Sang Yup Lee课题组[13]以大肠杆菌为宿主细胞,通过构建1,3-丙二胺合成的C4途径,首次实现了1,3-丙二胺的异源合成。在该项工作中,研究人员采用基于生物信息学的全基因组通量分析技术对1,3-丙二胺合成的C4途径和C5途径进行系统分析,结果表明C4途径具有更高的1,3-丙二胺合成效率。进而在大肠杆菌中过表达来源于鲍曼不动杆菌的dat基因和ddc基因,实现了1,3-丙二胺在大肠杆菌中的生物合成[13]。而1,3-丙二胺合成途径在谷氨酸棒状杆菌中的构建,当前还未有研究涉及。
2.2 底盘细胞产品降解途径的解析和改造
底盘细胞基因组上与产品降解、利用等相关冗余基因的存在,显著影响产品的产量。合成生物学研究者们通过将系统生物学分析和高效的基因组编辑策略相结合,实现了对大肠杆菌中与1,4-丁二胺、1,5-戊二胺降解相关功能元件的挖掘,进一步通过基因敲除技术,实现了冗余基因的删减,提高了产品的合成。Kind 等[17]发现N-乙酰戊二胺是谷氨酸棒状杆菌发酵合成1,5-戊二胺的主要副产物,通过转录组学分析,发现了基因组上17 个可能相关的乙酰化酶,结合多基因敲除实验,证实了NCgl1469 编码的乙酰化酶是催化1,5-戊二胺乙酰化的关键酶,该基因的缺失可使得1,5-戊二胺产量提高11%。同样,结合转录组分析和系统的基因敲除技术,Nguyen等[18]发现谷氨酸棒状杆菌中的cg1722基因与1,4-丁二胺的乙酰化相关,该基因的缺失可使1,4-丁二胺的产量提高41%。此外,在大肠杆菌中,发现乙酰化酶、氨基转移酶、谷氨酸二元胺连接酶等多个同二元胺降解和利用相关的途径,为底盘细胞的基因组改造提供了指导。
2.3 功能元件的设计与改造
人工细胞工厂构建中组成代谢途径的酶、控制基因表达强度的启动子以及调控代谢网络的调控因子等是合成生物系统中最简单、最重要的生物元件,对结构元件与调控元件的解析与改造也是优化人工细胞工厂性能的关键。
2.3.1 结构元件的筛选、设计与改造
脱羧酶,包括赖氨酸脱羧酶(LDC)、鸟氨酸脱羧酶(ODC)、精氨酸脱羧酶(ADC)、DDC 等作为二元胺合成过程中的关键功能元件,其活性对二元胺的合成至关重要。随着基因组、转录组、蛋白组等组学技术的发展,使得多样化元件的挖掘成为可能。与1,3-丙二胺合成相关的DDC 当前仅在鲍曼不动杆菌、产气肠杆菌、产气克莱勃氏杆菌等微生物中发现[19-22],而与1,5-戊二胺、1,4-丁二胺合成相关的LDC、ADC、ODC 已在多种微生物中发现,其中对大肠杆菌来源的酶研究最为深入。在大肠杆菌中,LDC、ADC 和ODC 均存在诱导型和组成型两种形式。其中诱导型的LDC、ADC 和ODC 分别由cadA、adiA和speF编码,而组成型的由ldcC、speA和speC编码[23-29]。不同来源或形式的脱羧酶对pH、温度等环境的耐受性以及催化活性均有所差异,因此脱羧酶的选择是影响二元胺合成的关键因素之一。例如,在1,4-丁二胺合成过程中,组成型的SpeC 比诱导型的SpeF更有利于1,4-丁二胺的合成[10],同时在谷氨酸棒状杆菌对比7 个不同来源的组成型SpeC,发现来源于阴沟肠杆菌的SpeC 表现出最高的1,4-丁二胺合成能力[30];对于1,5-戊二胺,诱导型的CadA比组成型的LdcA表现出更高的催化活力[27]。
为了提高产品合成的经济效益,推动产品的产业化发展,对酶的活性和稳定性提出了更高的要求。然而,自然界中天然存在的酶通常不能满足需求。采用定向进化和理性设计等策略,进行元件的重新改造,可有效提高结构元件各种功能属性,满足细胞工厂的构建需求。Wang 等利用易错PCR 和DNA 改组技术产生了蜂窝哈夫尼亚菌来源LDC 的突变文库,筛选获得了具有更高催化活性的酶,使得1,5-戊二胺的合成提高了约1.5倍[31]。Hong等[32]采用基于蛋白质结构的理性设计策略设计获得了赖氨酸脱羧酶突变体CadAF14C/K44C,显著提高了CadA 对pH 的耐受性以及热稳定性,进一步筛选获得的突变体CadAF14C/K44C/L7M/N8G使得1,5-戊二胺的产量提高了1.3 倍,同时降低了发酵过程中pH 的调控成本。同样,为了优化1,4-丁二胺的合成,Choi 等[33]对大肠杆菌来源的SpeC 进行了理性设计和改造,大大提高了酶的底物亲和性,使得酶的活力提高了62.5 倍。Hong 等[34]基于分子结构和蛋白网络分析,设计构建底物特异性增强的酶突变体,使得1,4-丁二胺的产量提高了4 倍。
2.3.2 启动子元件的优化
原核基因表达的调控主要发生在转录水平,因此启动子、RBS 等生物元件在途径的调控中发挥着重要的作用。原核生物的启动子元件有诱导型和组成型两种。为了丰富基因的表达调控策略,合成生物学者已经开展一系列研究,通过挖掘多样的天然启动子、人工设计合成非天然启动子,建立了多样的启动子元件库,使得途径构建过程中基因表达强度的精确调控成为可能。当前,在大肠杆菌中开展二元胺生物合成的基础研究工作时,多采用IPTG 诱导的诱导型启动子。而在谷氨酸棒状杆菌中组装二元胺合成途径时,为了进一步提高经济效益,避免昂贵诱导物的添加,合成生物学研究者们设计了多个不同的组成型启动子,用于调控基因的表达。Oh等[35]在利用谷氨酸棒状杆菌合成1,5-戊二胺时,采用6个不同的人工合成的组成型启动子调控异源赖氨酸脱羧酶(LdcC)的表达,筛选获得了最有利于1,5-戊二胺合成的启动子PH30。利用上述的表达调控策略,Kim 等[36]在工业生产赖氨酸的谷氨酸棒状杆菌中组装1,5-戊二胺合成途径,使得1,5-戊二胺的产量达103.78 g/L,为当前发酵法生产1,5-戊二胺的最高水平。在1,4-丁二胺合成过程中,Schneider 等[37]通过优化启动子和RBS 元件,建立了ArgF 精确调控策略,使得谷氨酸棒状1,4-丁二胺产量提高到19 g/L,为当前谷氨酸棒状杆菌发酵合成1,4-丁二胺的最高水平。
2.3.3 调控因子的解析与改造
除产品自身的合成和降解途径外,细胞内存在其他可能影响产品合成的基因或转录因子。近年来,合成生物学者开发基于sRNA、CRISPR/Cas等策略的高通量基因组编辑技术,为调控元件的高效挖掘提供了强有力的技术支撑。其中,sRNA是细菌重要的转录后调控因子,广泛参与细菌各方面的调控功能。通过模块化的合成型RNA分子,RNA 介导的调节机制可在全基因组范围内有效筛选靶基因和精细控制靶基因的表达水平,优化产品的合成。2013 年,Na 等[38]通过设计合成型sRNA,使用含有130 个sRNA 的文库,在大肠杆菌中筛选发现murE基因的抑制可使得1,5-戊二胺的产量提高55%。2017 年,Noh 等[39]开发了通过调节合成型sRNA 表达水平微调基因表达水平的敲低系统,通过对75 个合成型sRNA-启动子组合的文库的筛选,在大肠杆菌中发现glnA和argF的抑制可有效提高1,4-丁二胺的合成,产量达42.3g/L,为当前以大肠杆菌为宿主发酵合成1,4-丁二胺的最高水平。以上研究所使用的人工合成型sRNA 微调靶基因的技术,同基因敲除策略和其他大规模靶标识别策略相比,具有操作简单、易于实施、通量高等优点,可较好地推广应用于优良生产菌株的开发。
此外,细胞内存在众多的全局转录因子,如σ因子,这些蛋白质控制了细胞内大量基因的转录表达,如果对这些蛋白质进行改造,可能产生多种复杂表型, 用于人工细胞工厂的性能优化。研究发现,大肠杆菌合成1,4-丁二胺的过程中,可引起转录因子Cya、RpoS、FecI和Fis表达量的提高,其中胞内压力响应RNA 聚合酶σ 因子RpoS 是一种众所周知的全局转录调节因子,可控制大肠杆菌中10%以上基因的表达,通过对RpoS 的敲除,可显著提高大肠杆菌1,4-丁二胺的合成能力[15]。
2.3.4 功能模块的适配性优化
人工细胞中模块之间的适配性是细胞工厂稳定发挥功能的必要因素之一,也是合成生物学领域要解决的核心关键问题之一。不同人工合成功能模块在同一底盘生物中的存在,引发的还原力不平衡、中间代谢物积累、前体供给不足等不适配问题常导致生物基产品合成效率低下,是合生生物学研究的主要困难。采用系统代谢工程策略,通过解析影响细胞工厂效率的关键代谢机制,将多种辅助生物模块,如底物转运模块、产物转运模块、辅因子转变模块等与产品合成模块在细胞中进行系统优化,是解决代谢途径的适配性问题、提高细胞工厂性能的有效手段。
(1)辅因子模块 DDC、ODC、ADC 和LDC均为依赖于5-磷酸吡哆醛(PLP)的脱羧酶[40]。PLP的高效供给是维持脱羧酶活力的必要因素,显著影响二元胺的合成效率。当前,已鉴定获得两条PLP 的从头合成途径[41-42]:一条是由7 步酶催化组成的5-磷酸脱氧木酮糖途径[43];另一条为5-磷酸核糖途径,由PdxST 复合体催化[44]。在大肠杆菌中过表达天然5-磷酸脱氧木酮糖途径中的关键基因或组装异源的5-磷酸核糖途径均可有效增强胞内PLP 的合成[45]。在产1,5-戊二胺的大肠杆菌中,南京工业大学的Chen等[46]通过在大肠杆菌中组装异源的5-磷酸核糖途径增强PLP的供给,使得1,5-戊二胺的合成提高了2.9倍。
赖氨酸、鸟氨酸、精氨酸等碱性氨基酸的合成途径依赖于ATP 和NAD(P)H,如每合成1 分子的赖氨酸,需要消耗2 分子的ATP 和4 分子的NADPH。ATP 和NAD(P)H 辅因子模块的适配性调控有利于二元胺的生物合成。在1,4-丁二胺合成过程中,Li 等[9]发现抑制胞内ATP 消耗的酶(CarB、XylB、AccDA、PurL、CoaA、PknG 和PanC2) 和NADPH 消 耗 的 酶(Dxr、 AroE 和TrxB) 增强胞内ATP 和NADPH 的供给可显著增加1,4-丁二胺的合成。在产1,3-丙二胺的大肠杆菌中,通过增强胞内NADPH 的供给,同时增强胞内前体天冬氨酸的合成,1,3-丙二胺的最终产量达13.0 g/L[13]。
(2)物质转运模块 当前,通过调控物质转运模块增强二元胺生产的研究主要集中在1,5-戊二胺和1,4-丁二胺的生物合成。南京工业大学Chen 等通过在大肠杆菌中调控赖氨酸/1,5-戊二胺反向转运蛋白CadB 的表达,采用全细胞催化工艺,使得以赖氨酸为底物的1,5-戊二胺产量达221g/L[5]。在产1,5-戊二胺的工程谷氨酸棒状杆菌,通过异源表达大肠杆菌中的CadB 转运模块,使得1,5-戊二胺的产量提高了30%[47]。Kind 等[48]采用转录组技术,在组装了1,5-戊二胺合成途径的谷氨酸棒状杆菌中鉴定获得了与1,5-戊二胺分泌相关的通透酶cg2893,该元件的过表达使得菌株1,5-戊二胺的产量提高了20%;进一步通过敲除赖氨酸外排蛋白NCgl1469 和LysE, 获得工程菌株Corynebacterium glutamicumDAP-16,在葡萄糖分批补料发酵策略下,1,5-戊二胺产量达88 g/L[49]。Nguyen 等[18]通过转录组解析,同样发现了谷氨酸棒状杆菌中与1,4-丁二胺分泌相关的基因cgmA,该基因的过表达使得1,4-丁二胺的产量提高了24%。Li等同样通过过表达cgmA 转运蛋白,并系统集成前体合成模块和OdhA 调控模块的强度优化,使得1,4-丁二胺的产量达12.4 g/L[30]。以上研究证实了物质转运,尤其是产品外排模块对提高产品合成的关键作用,然而当前有关二元胺的转运系统研究较少,尤其是对于谷氨酸棒状杆菌,进一步挖掘同产品转运相关的元件,对优化工程细胞的性能至关重要。
基于以上研究,在构建二元胺工程菌株的研究工作中,大多采用过表达或异源表达关键功能元件脱羧酶组装二元胺合成途径,进而通过增强前体合成模块的代谢水平以及改造底盘细胞使之缺失对产品的利用和降解的能力的策略获得工程细胞,在此基础上,基于高通量的元件解析和筛选技术,组装获得了一系列同物质转运、细胞调控、辅因子合成等相关的功能模块,通过模块间的适配性调控和系统集成,进一步提高了二元胺工程细胞的产品合成性能。
同时,当前以大肠杆菌和谷氨酸棒状杆菌为宿主均开展了许多二元胺的途径构建和合成研究。其中大肠杆菌遗传背景清晰,易于改造,且细胞内二元胺合成、转运、调控等元件的研究较为成熟,是研究二元胺合成调控机制的理想宿主之一,可为二元胺在其他宿主中的改造提供指导。然而大肠杆菌存在氨基酸前体产量低、对二元胺耐受性低等问题,而谷氨酸棒状杆菌是天然的氨基酸高产菌株,且对二元胺具有较高的耐受性,尽管其缺乏二元胺的天然合成途径,基于上述系统生物解析和合成生物技术改造,可较好实现二元胺在谷氨酸棒状杆菌中的高效生产,被认为是合成二元胺的理想宿主。基于以上研究,如表1 所示,重组菌株发酵合成1,5-戊二胺的最高产量达103.78g/L[36],1,4-丁二胺达42.3g/L[39],1,3-丙二胺达13.06g/L[13],以上工作为生物基二元胺的产业化制备奠定了基础。

表1 不同宿主合成C3~C5脂肪族二元胺最高水平对比Tab.1 The highest production level of aliphatic diamines with 3~5 carbon atoms by different hosts
3 以非粮生物质为原料的生物基二元胺合成
第一代生物炼制以“粮食作物生物质”为原料,存在“与人争粮、与粮争地”等问题,随着粮食危机日益加剧以及粮食价格不断攀升,以粮食为原料的生物制造正面临严峻考验。为推进生物制造的可持续发展,提高生物制造的竞争力,当前生物炼制已步入第二代以木质纤维素原料为代表的“非粮生物质”时代。利用合成生物学技术,开发以木质纤维素、粗甘油等非粮生物质为原料的二元胺生产菌株(图3),对推动生物基二元胺的可持续发展具有重要意义。
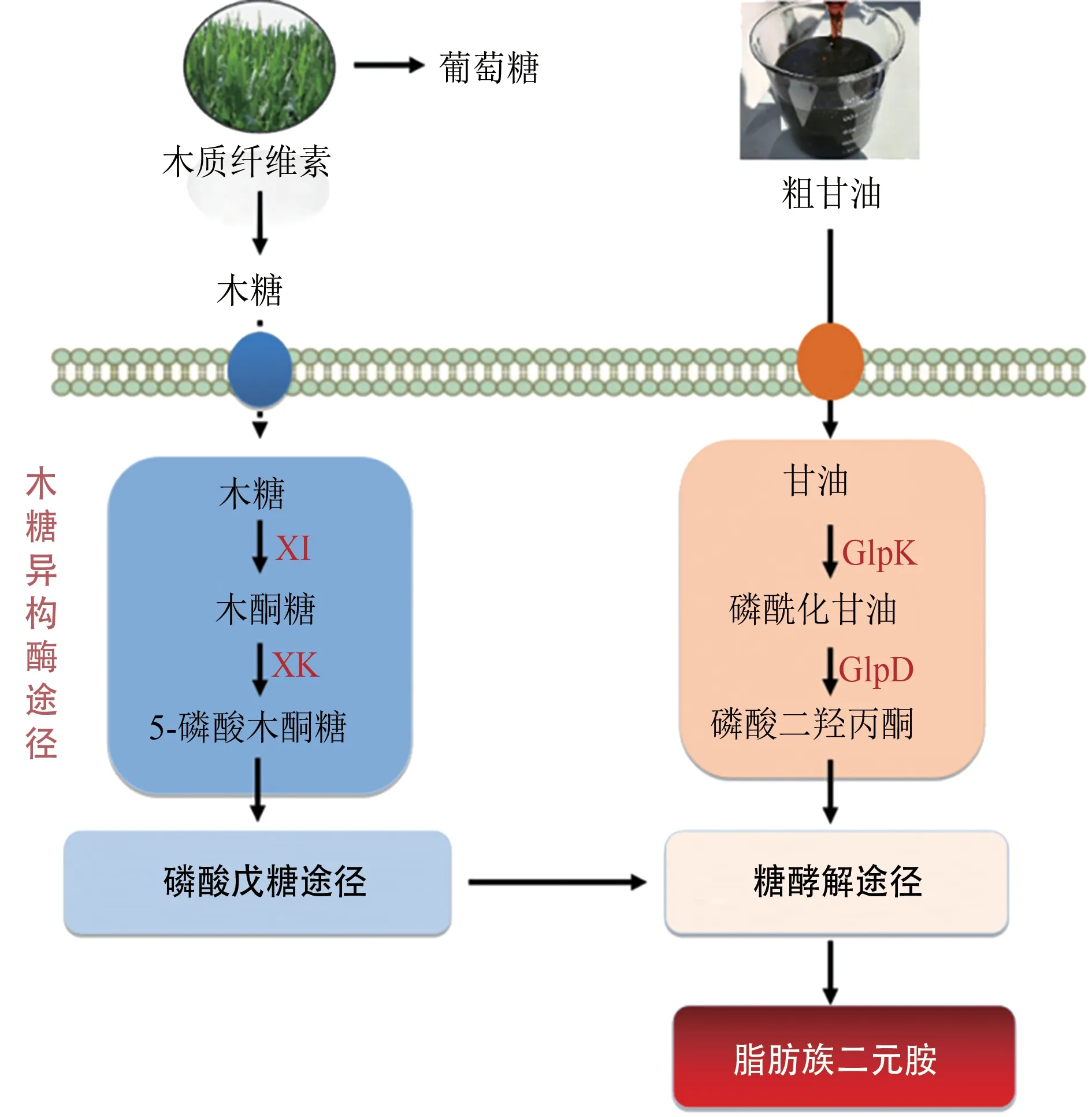
图3 以非粮生物质为原料的生物基二元胺合成[50-58]Fig.3 The biosynthesis of aliphatic diamines with non-food feedstock
3.1 利用木糖合成二元胺
木糖是木质纤维素原料中含量仅次于葡萄糖的单糖,含量约为18%~30%[50],因此,开发和研究菌株高效利用木糖转化合成二元胺的技术,是实现以木质纤维素为原料产业化制备二元胺的必要条件。野生型的谷氨酸棒状杆菌无法直接利用木糖作为发酵底物,当前通过在谷氨酸棒状杆菌中组装和优化木糖利用途径,已实现1,5-戊二胺、1,4-丁二胺的生物合成。在已发现的4 种木糖代谢途径中[51],木糖异构酶(XI)途径被广泛用于谷氨酸棒状杆菌的木糖代谢改造。例如通过在产1,4-丁二胺谷氨酸棒状杆菌中组装XI 途径,并对不同来源的木糖异构酶XylA 进行筛选,重组谷氨酸棒状杆菌代谢木糖合成1,4-丁二胺的产量由2.9mmol/L 增加到15.1mmol/L,同时以稻草秸秆水解液为发酵原料,成功检测到1,4-丁二胺的合成[52]。在产1,5-戊二胺的谷氨酸棒状杆菌中,通过组装来源于E. coli的XI 途径[53],进一步基于C13代谢通量分析和转录组学解析获得了影响木糖高效利用合成1,5-戊二胺的关键,通过系统改造磷酸戊糖途径(PPP)、TCA 循环途径、赖氨酸分泌蛋白LysE 以及1,5-戊二胺乙酰化途径,获得的重组谷氨酸棒状杆菌DAP-Xyl1icdGTG Peftu fbp Psod tktΔactΔlysE代谢木糖合成1,5-戊二胺的产量提高了54%,达103 g/L,转化率(以物质的量计)达32%,具有较好的工业应用价值[54]。
3.2 利用粗甘油合成二元胺
粗甘油是生物柴油和生物乙醇生产过程中不可避免的副产物,每年产生约6 亿吨[55]。鉴于粗甘油产量大、成本低等特点,被认为是大规模生物生产过程中的理想原料[56-57]。大肠杆菌天然具有甘油代谢途径,然而当前以大肠杆菌为宿主利用甘油生物转化合成二元胺的研究鲜有报道。谷氨酸棒杆菌同样具有天然的甘油代谢途径,然而内源甘油利用途径中的关键酶甘油激酶(GlpK)和3-磷酸甘油脱氢酶(GlpD)活性低,增加基因表达强度仅允许谷氨酸棒杆菌以甘油为碳源的缓慢生长。通过在谷氨酸棒状杆菌中组装大肠杆菌来源的甘油代谢途径,重组菌株可以快速利用甘油进行生长,且成功制备获得4.7mmol/L 的1,4-丁二胺[58]。
4 生物基二元胺合成过程中CO2的原位固定
由生物脱羧催化合成二元胺的生产过程伴随着大量CO2的释放,如每生产1 t 1,5-戊二胺产生0.43t CO2。CO2的释放不仅大大降低了产品的原子经济性,同时增加了温室气体的排放。南京工业大学Chen等[59]针对1,5-戊二胺合成过程中的脱羧CO2排放问题,通过构建由丁二酸合成菌和1,5-戊二胺合成菌组成的人工多细胞体系,实现了赖氨酸脱羧反应释放CO2的固定用于丁二酸的合成,减少了CO2排放,同时该耦合体系利用产物1,5-戊二胺与丁二酸自身的酸碱特性互为酸碱中和剂,整个过程中实现酸碱的零添加;且可一步发酵合成1,5-戊二胺丁二酸盐,用于PA54 的合成。人工合成的微生物多细胞体系已成功应用于医药、能源、材料等生物基产品的高效合成中,上述研究通过人工多细胞体系的构建实现CO2的再循环,为提高生物基二元胺合成过程的原子经济性提供了新思路。
此外,利用合成生物学技术,在产品合成菌株中增强或重构CO2固定途径,实现产品合成过程中CO2的再循环利用,减少温室气体排放,是有效提高生物基产品合成过程原子经济性的策略之一,近年来受到研究者的广泛关注(图4)。当前,已发现6 个天然的CO2固定途径,包括卡尔文循环、Wood-Ljungdahl 途径、还原性TCA 循环途径、3-羟基丙酸双循环、二羧酸/4-羟基丁酸循环和3-羟基丙酸/4-羟基丁酸循环[60]。研究者们通过在异养模式微生物中组装和调控CO2固定途径,成功实现了CO2的再循环利用。例如,通过在酿酒酵母异源表达卡尔文循环的关键酶1,5-二磷酸核酮糖羧化酶(RuBisCO) 和磷酸核酮糖激酶(PRK),成功实现了生物乙醇生产过程中CO2的原位固定,乙醇产量提高了10%,副产物甘油产量降低了90%[61];通过在大肠杆菌中异源表达RuBisCO 和PRK,同时与ATP再生途径相结合,使得苹果酸的产量提高了387mmol/L[62]。证实了通过合成生物学手段实现CO2原位固定改善化学品生产的巨大潜力,为提高生物基二元胺合成过程的经济性,发展绿色、低碳的生物基二元胺生产模式提供了借鉴。
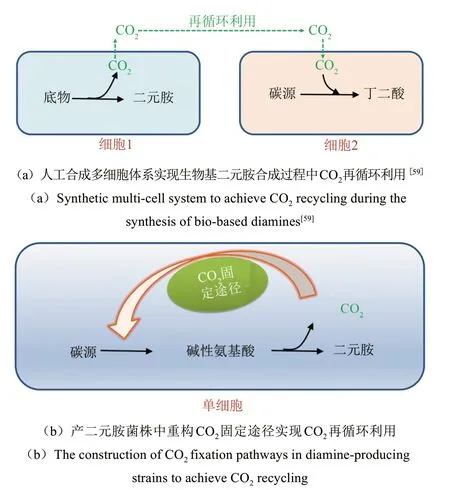
图4 生物基二元胺合成过程CO2的原位固定Fig.4 The in situ fixation of CO2 during the synthesis of bio-based diamines
5 展 望
脂肪族二元胺作为重要的材料单体,可用于聚酰胺和聚氨酯的合成,广泛应用于农业、医药和工业等领域。在以上的研究中,通过一系列的合成生物技术,如调控元件和功能元件的挖掘、设计与优化、模块的系统系统与适配性优化、发酵原料的途径构建等工程策略,初步实现了1,3-丙二胺、1,4-丁二胺、1,5-戊二胺等产品的发酵制备,然而重组菌株仍存在产率较低的问题,无法满足工业化需求。在未来的研究工作中如何提高工程菌株的产品合成能力和生物反应过程的经济性,是推进生物基二元胺产业化的关键。
二元胺对细胞具有毒性,其在发酵培养基中的过量积累会对细胞生长产生抑制并限制了最终产品的合成。例如大肠杆菌在40.4g/L 1,5-戊二胺存在时生长速率下降35%[63]。谷氨酸棒状杆菌在102g/L 的1,5-戊二胺浓度下生长速率下降约67%[64],在66g/L 的1,4-丁二胺条件下生产速率下降34%[10]。然而当前对二元胺抑制机理的深入研究较少,仅在大肠杆菌中发现,胞内1,5-戊二胺的积累可能会诱导孔蛋白的闭合,从而引起细胞对营养物质的吸收不足,影响细胞的生长和代谢。而对于谷氨酸棒状杆菌,二元胺属于非天然产物,其抑制机制研究尚未涉及。因此,明确1,5-戊二胺抑制细菌生长的机制,发掘相关抗逆元件,提高底盘细胞的二元胺耐受性是亟需解决的问题。
降低生物基二元胺生产过程中脱羧CO2的排放,实现CO2的再循环利用也是该领域未来所面临的重大挑战。CO2处于高度氧化的状态,将CO2生物转化为有机代谢产物的过程需要大量的能量,包括ATP 和NAD(P)H[60]。天然固碳途径较低的酶催化效率、较高的能量需求以及氧气敏感性等特点,目前不能满足工业化的要求,限制了天然固碳途径在改善产品合成中的应用。近年来,研究者们利用合成生物学技术,一方面通过挖掘、设计和改造新的功能元件,提高天然固碳途径的反应效率,一方面人工设计合成多条低耗高效的固碳途径,包括丙酮酸合成酶-丙酮酸羧化酶-乙醛酸(PPG)循环、丙二酰辅酶A-草酰乙酸-乙醛酸(MOG)循环、丁烯酰辅酶A-乙基丙二酰辅酶A-羟基丁酰辅酶A(CETCH) 循环以及还原性甘氨酸途径(rGly)[65-66],为突破天然固碳途径的效率瓶颈提供了可能。此外,纳米微反应器[67]、分子支架[68]、多酶组装[69]等新的技术不断涌现,为CO2循环利用效率的优化提供了新的启发。在部分自养菌中,存在一种基于碳酐酶(CA)和羧酶体微区室结构的CO2捕获和浓缩系统[70],在较低CO2浓度的环境中,可以高效捕获胞外的CO2,胞内羧酶体中CO2浓度是胞外环境中CO2浓度的近千倍[71],从而通过增加固碳酶周围的CO2浓度提高CO2固定效率。因此,如果将这些自养微生物中的固碳机制加以开发利用,在二元胺生产菌株将脱羧酶和CO2固定酶限制在亚细胞空间,构建CO2原位固定的纳米微反应器,或利用分子支架以及多酶组装技术,实现脱羧酶和固碳酶的共定位,有望提高二元胺合成过程中CO2的原位固定效率,增强二元胺合成过程的原子经济性。
合成生物学的快速发展,为设计构建高效的二元胺合成细胞工厂提供了可能,通过对底盘细胞的基因组改造和性能强化、对高效调控元件和结构元件的挖掘和改造、对二元胺合成代谢途径的再设计和优化,对胞内代谢调控机制的解析和模块的适配性调节等手段,合成生物技术有望创造出高效的二元胺合成人工细胞,实现绿色、低碳、高效的二元胺生物制造,推动生物基高分子材料领域的发展。

