芍药种胚启动培养及丛生芽诱导研究
刘雪婷 ,孙晓梅 ,李 妍 ,李 恒 ,李雪婷 ,宋莉莉
(1.沈阳农业大学 林学院,沈阳110161;2.鞍山创融发展有限公司,辽宁 鞍山114017)
芍药(Paeonia lactiflora)为芍药科芍药属多年生宿根草本植物,集观赏、药用、食用、经济价值于一体,是中国栽培历史最悠久的花卉之一。芍药传统的繁殖方法包括播种、分株、扦插等,但上述方法易受季节限制,繁殖系数低,难以满足花卉市场的需求[1-2]。与传统繁殖方式相比,组织培养技术不仅可以提高繁殖系数,缩短育种时间,也可以为新品种的繁育、遗传转化、生理生化以及野生种质资源保存提供科学依据[3-4]。目前,芍药的组织培养包括丛生芽、愈伤组织诱导再分化不定芽以及体细胞胚胎3种途径。芍药愈伤组织途径存在再分化困难、褐化、玻璃化等问题,很难形成完整的植株[5]。芍药的体胚诱导及成熟过程相较于其他植物,对培养基、植物生长调节剂及培养条件要求更加严格,不易诱导[6-7]。通过芍药种胚进行丛生芽诱导可以缩短育苗周期,短时间内可获得大量的丛生芽苗,目前已取得了一定的进展。杜霞[5]对杭白芍的种胚进行丛生芽诱导,增殖系数为1.27;张滕等[4]以“粉玉奴”及“杭白芍”的种胚进行丛生芽诱导,均获得质量较好的丛生芽苗。但丛生芽诱导过程中仍存在芽苗畸形、诱导率及增殖率较低等现象。本试验以芍药种胚为外植体,采用组织培养的方法,对种胚的启动培养、丛生芽诱导及增殖过程进行研究,以期为实现芍药高效扩繁、遗传转化及产业化发展提供理论依据。
1 材料与方法
1.1 材料
本试验采用的杂交种子(母本为粉玉奴、父本为粉玉楼)来自沈阳农业大学芍药资源圃,于2018年5月22日授粉,8月23日采集种子,阴干后于4℃冰箱中保存备用。胚龄试验的种子采于2019年5月23日授粉后的不同时期,即采即用。
1.2 方法
1.2.1 种胚最佳启动培养基的筛选 无菌水中浸泡种子48h后,剥去外层种皮,在无菌操作台中用75%酒精消毒30s,0.1%HgCl2消毒5min,无菌水冲洗3次,切成3mm×3mm带有种胚的胚乳块,分别接种于表1的培养基中,每个处理30个外植体,重复3次,以A0为对照。10d后观察种胚的萌发率,15d后观察胚苗的萌发状态。
1.2.2 暗培养诱导种胚萌发试验 种子处理方式同1.2.1。 接种在添加 0.5mg·L-1GA3、1.0mg·L-16-BA 的 MS培养基中,分别进行光培养(光照时间为14h·d-1)及两种暗处理培养(暗培养4d后转到正常光照条件下;暗培养8d后转到正常的光照条件下),10d后观察种胚的萌发率,15d观察胚苗的萌发状态。
1.2.3 胚龄诱导种胚萌发试验 分别取授粉后65,75,85,95d的种子,处理后接种到添加 0.5mg·L-1GA3、1.0mg·L-16-BA的MS培养基中,10d后观察种胚的萌发率,25d后观察胚苗的萌发状态。
1.2.4 种胚及子叶节丛生芽的初步诱导试验 将启动培养中萌发的完整胚苗转接到表2的丛生芽初步诱导培养基中进行诱导,培养30d后,观察丛生芽萌发趋势,筛选种胚初步诱导丛生芽的最佳培养基。将切除胚根的子叶节转接到种胚丛生芽初步诱导的最适培养基中进行诱导,观察两种外植体初步诱导丛生芽的差异。

表1 芍药种胚启动培养试验设计Table 1 Experimental design of initiation culture of peony embryo

表2 芍药种胚丛生芽初步诱导试验设计Table 2 Preliminary induction experiment design of multiple shoots of peony embryo
1.2.5 种胚及子叶节丛生芽的二次诱导试验 以初步诱导中有丛生芽趋势的胚苗为试验材料,转接到表3所示的培养基中进行种胚丛生芽的二次诱导,30d后观察丛生芽发育状态,筛选最适合种胚丛生芽二次诱导的培养基。将初步诱导中的子叶节丛生芽转接到筛选出的最适培养基中,进行子叶节丛生芽二次诱导,观察两种外植体二次诱导中丛生芽的差异。
1.2.6 水解酪蛋白对丛生芽增殖的影响 将诱导出的丛生芽苗转接到3.0mg·L-16-BA+1.0mg·L-1GA3+0.1mg·L-1NAA+1.0g·L-1PVP的MS培养基中,并添加不同浓度的水解酪蛋白CH(0,0.3,0.5g·L-1),30d后观察水解酪蛋白浓度对丛生芽增殖的作用。
1.2.7 NAA对丛生芽的增殖试验 将诱导出的丛生芽苗转接到3.0mg·L-16-BA+1.0mg·L-1GA3+0.3g·L-1CH+1.0 g·L-1PVP 的 MS 培养基中,并添加不同浓度的 NAA(0.05,0.1,0.2,0.3mg·L-1),30d 后观察生长素浓度对丛生芽增殖的作用。

表3 芍药种胚丛生芽二次诱导试验设计Table 3 Secondary induction experiment design of multiple shoots of peony embryo
2 结果与分析
2.1 芍药种胚的启动培养
2.1.1 不同激素组合对芍药种胚启动培养的影响 由表4可知,A1处理种胚萌发率最高,为71.94%;其次为A3处理,萌发率为63.89%,均显著高于未添加GA3的A0、A2处理(p<0.05)。表明GA3对提高芍药种胚的萌发率具有显著作用。然而随培养时间的增加,只添加GA3的A1处理胚根生长缓慢甚至停止生长,而添加GA3与6-BA的A3处理胚苗长势良好,子叶间有腋芽产生。A5处理是A3处理的基础上添加0.2mg·L-1NAA,其萌发率显著低于A3处理,胚根基部增粗,影响胚苗生长。表明NAA对芍药种胚启动培养无作用,甚至抑制种胚的萌发。综上,种胚的最佳启动培养基为MS+0.5mg·L-1GA3+1.0mg·L-16-BA。
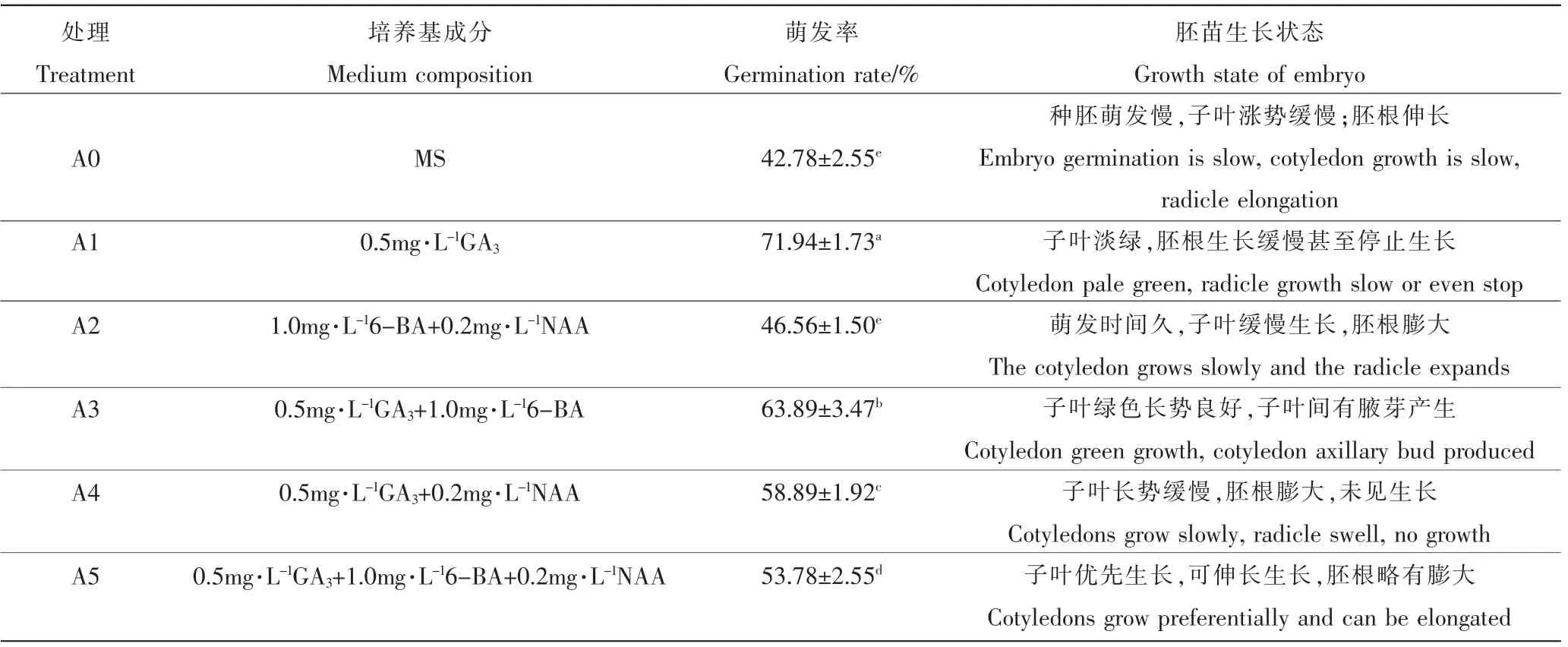
表4 植物生长调节剂对芍药种胚启动培养的影响Table 4 Effects of plant growth regulators on initiation culture of peony embryo
2.1.2 暗培养对种胚萌发的影响 由表5可知,暗培养4d时种胚萌发率最高,为73.47%,略高于正常光照下69.16%的萌发率,差异不显著。暗培养8d的种胚,萌发率下降为52.31%,显著低于另外两种处理(p<0.05)。
培养15d后,3种暗处理下的种胚均可脱离胚乳独立生长。此时,正常光照培养的胚苗,子叶偏浅绿色闭合状态,胚轴为白色,生长速度稍慢于经过暗培养的胚苗(图1A)。经过暗培养处理的胚苗,子叶均偏粉,正常展开并进行伸长生长(图1B和图1C)。综上,短期暗培养可以改善胚苗的发育状态,若暗培养时间过长,种胚的萌发率及成苗率均会降低。因此,暗培养4d为种胚萌发的最佳暗处理时间。

表5 暗培养对种胚萌发的影响Table 5 Effect of dark culture on seed embryo germination

图1 不同暗培养处理15d后种胚的发育状态Figure 1 Development status of embryo after 15 days in different dark culture treatments
2.1.3 胚龄对种胚萌发的影响 由图2可知,种胚的萌发率随胚龄的增加呈先增加后降低的趋势。当胚龄为65d时种胚的萌发率最低,仅为6.67%,胚苗长势较差,子叶皱缩弯曲。当胚龄为75d时,萌发率最高,达到63.33%,胚苗健壮,子叶紧密贴合在一起,长势良好。当胚龄增加至85d或95d时,种子已趋于成熟状态,相比于75d的萌发率差异不显著,且发育状态与75d无太大差异。综上,胚龄为授粉后75~95d均适宜诱导种胚萌发,胚龄不宜过小,胚不易萌发。
2.2 丛生芽的诱导及增殖
2.2.1 初步诱导中GA3与6-BA浓度对种胚丛生芽的影响 由表6可知,当GA3、6-BA浓度均为1.0mg·L-1时,种胚丛生芽的诱导率最高,为48.33%,显著高于其他处理(p<0.05),胚轴与子叶间明显膨大,丛生芽的萌发趋势较强,长势较好。当GA3、6-BA浓度降低时,诱导率会随之降低,子叶节间膨大的趋势也会降低。B1、B3处理中,6-BA的浓度均为0.5mg·L-1,此时丛生芽的诱导率均较低,分别为32.90%、33.95%。B2、B5组合中,6-BA的浓度均为1.0mg·L-1,诱导率略低于B4组合,但显著高于B1、B3,表明6-BA的浓度对丛生芽的诱导具有重要的作用。B5是在B4的基础上添加0.1mg·L-1NAA,胚根基部产生愈伤组织及瘤状突起,降低丛生芽诱导率,表明NAA对丛生芽的诱导起抑制作用。综上,种胚丛生芽初步诱导的最适培养基MS+1.0mg·L-1GA3+1.0mg·L-16-BA。

图2 胚龄对种胚萌发的影响Figure 2 Effect of embryo age on seed embryo germination
2.2.2 初步诱导中子叶与种胚对丛生芽诱导的影响 由表7可知,子叶节丛生芽的初步诱导率高于种胚,为64.28%。培养10d后,可观察到子叶节丛生芽明显伸长,培养20d,新芽高可达到2cm,芽与芽处于分散状态,有利于下一步的增殖分切(图3A)。种胚丛生芽长势略差,绝大多数都是由子叶间萌发出芽点,高度小于1cm,部分胚苗会在胚轴的周围萌发出芽点,形状类似于须根的状态(图3B)。综上,切除胚根基部更有利于胚苗的常规生长,但完整种胚诱导出的丛生芽具有更高的萌发潜质。

表6 初步诱导对种胚丛生芽的影响Table 6 Effects of initial induction on seed embryo multiple shoots

表7 外植体对丛生芽初步诱导的影响Table 7 Effects of explants on initial induction of multiple shoots

图3 子叶节丛生芽与种胚丛生芽对比Figure 3 Comparison between cotyledon node and embryo initial induction of multiple shoots
2.2.3 二次诱导中6-BA的浓度对种胚丛生芽的影响 由表8可知,1.0mg·L-1GA3与4种浓度的6-BA均可诱导丛生芽。当6-BA浓度为2.0mg·L-1时,种胚丛生芽诱导率最高,为63.89%,显著高于其他处理,丛生芽翠绿健壮,长势良好(图4B)。其次是6-BA为3.0mg·L-1时,诱导率为51.83%,该浓度下丛生芽分化程度较高,但部分胚苗有轻微褐化(图4C)。上述两种处理的部分丛生芽基部会膨大呈团状,表面有绿色凸起的芽点,可进一步分化为丛生芽(图4E和图4F)。当6-BA为1.0mg·L-1时,诱导率为45.94%,丛生芽健壮,但生长缓慢(图4A)。当6-BA为4.0mg·L-1时,诱导率为42.06%,丛生芽基部严重褐化(图4D)。 综上,MS+2.0mg·L-16-BA+1.0mg·L-1GA3为丛生芽二次诱导的最佳培养基,将3.0mg·L-16-BA作为丛生芽增殖试验的浓度。
2.2.4 二次诱导中子叶与种胚对丛生芽诱导的影响 由表9可知,子叶节丛生芽在二次诱导中的诱导率为52.17%,略低于种胚丛生芽。子叶节丛生芽在转接5d后,即可观察到丛生芽有明显伸长的趋势,在20d时芽高可达3cm,且各丛生芽间都处于分离状态,芽苗纤细并未紧密贴合(图5A),但部分子叶节丛生芽二次诱导时会出现丛生芽数量较少,迅速高生长后逐步萎蔫的现象,影响后期芽苗的增殖质量(图5B)。种胚丛生芽二次诱导的生长速度较慢,转接15d后可观察到新芽萌发,丛生芽紧密贴合,植株健壮,长势较好(图5C)。综上,种胚丛生芽的二次诱导效果优于子叶节丛生芽。

图4 不同激素浓度下种胚丛生芽二次诱导状态Figure 4 The state of secondary induction of embryo multiple shoots under different hormone concentrations

表9 外植体对丛生芽二次诱导的影响Table 9 Effects of explants on secondary induction of multiple shoots
2.2.5 水解酪蛋白对丛生芽增殖的影响 由表10可知,当水解酪蛋白浓度为0.3g·L-1时,平均增殖系数最高,为2.29,该浓度下胚苗翠绿健壮,丛生芽数量多,且生长速度快(图6B)。当浓度为0时,丛生芽数量会减少,长势良好,但生长速度慢(图6A)。当浓度为0.5g·L-1时,丛生芽会在胚轴周围横向增殖,但并未伸长生长,随着培养时间增加,茎叶逐渐枯萎,植株严重褐化,未能进一步生长(图6C)。综上,在一定浓度范围内,水解酪蛋白可以促进丛生芽的增殖生长,最适宜的浓度为0.3g·L-1。

图5 子叶节丛生芽与种胚丛生芽对比Figure 5 Comparison between cotyledon node and embryo secondary induction of multiple shoots

表8 二次诱导对种胚丛生芽的影响Table 8 Effects of secondary induction on embryo multiple shoots

图6 不同浓度水解酪蛋白处理下丛生芽增殖状态Figure 6 The state of proliferation from multiple shoots under different concentrations of hydrolyzed casein

表10 水解酪蛋白对丛生芽增殖的影响Table 10 Effect of acid hydrolysis of casein on the proliferation of multiple shoots
2.2.6 NAA对丛生芽增殖的影响 研究发现,NAA对丛生芽的增殖率无显著影响,但其浓度变化可以影响丛生芽苗的质量。由表11可知,当NAA的浓度为0.05mg·L-1时,新芽高度小于1cm,植株健壮,但生长速度较慢;当NAA为0.1mg·L-1时,芽苗的生长状态最好,可明显观察到丛生芽伸长,且高度大于1cm。当NAA浓度进一步提高至0.2mg·L-1时,胚根基部凸起逐渐明显,褐化程度逐渐加剧,新芽萎蔫。当NAA升高为0.3mg·L-1时,褐化严重,培养一段时间后,丛生芽会枯黄萎蔫甚至停止生长。综上,低浓度NAA可提高芽苗质量,最适宜丛生芽增殖的NAA浓度为0.1mg·L-1。

表11 NAA对丛生芽增殖的影响Table 11 Effect of NAA on the proliferation of multiple shoots
3 讨论与结论
在启动培养过程中,激素起着至关重要的作用。6-BA是形成腋芽的必要条件[8]。GA3是启动培养中打破种子休眠最主要的因素[9-10]。前人多选用GA3与6-BA组合对种胚进行启动培养,既可以打破上胚轴休眠又可以刺激茎的伸长[11]。本试验结论与前人大致相符,但在研究过程中发现,单一GA3未能使种胚形成完整植株,而GA3与6-BA组合诱导既可提高种胚的萌发率,又产生新的腋芽,由此推断,6-BA可诱导胚苗产生新芽,GA3与6-BA组合既可诱导种胚萌发,也可用于丛生芽的诱导。
目前,芍药属植物关于胚龄的研究多见于牡丹,有前人发现牡丹种胚的萌发率会随着胚龄增加逐渐提高,盛花期后75d萌发率最高,可达到58.3%[12]。也有研究者发现,并非胚龄越大成活率越高,诱导率会随胚龄的增加呈现先增加后降低的趋势,在花后110 d时诱导率最高[13-14]。本研究发现,胚龄为授粉后75~95d的诱导率差异不显著,均适宜诱导种胚萌发,胚龄不宜过小,胚不易萌发。
有研究发现高浓度的6-BA会使胚苗抽叶停滞,发育迟缓[5]。低浓度的GA3、6-BA组合虽然适合芍药“粉玉奴”的丛生芽诱导,但丛生芽的生长速度慢,且增殖系数较低[4,15]。由此推测胚苗幼期对高浓度6-BA敏感,随着丛生芽的分化及胚苗自身的生长,对6-BA的需求量会增加。因此,本研究采用两步诱导法,使胚苗适应由低到高的浓度变化。本试验结果表明,种胚丛生芽的初步诱导最佳激素配比为MS+1.0mg·L-1GA3+1.0mg·L-16-BA;种胚二次诱导最佳培养基为MS+1.0mg·L-1GA3+2.0mg·L-16-BA;增殖培养的最佳培养基为MS+1.0mg·L-1GA3+3.0mg·L-16-BA+0.1mg·L-1NAA+0.3g·L-1CH。从诱导到增殖的过程中6-BA的浓度由低到高逐渐递增,既可以提高诱导率,又可以降低胚苗的畸形率。
前人对子叶节诱导从生芽的研究较少。主要通过TDZ与6-BA对子叶节进行丛生芽诱导,诱导率过低且胚苗畸形膨大,阻碍子叶节丛生芽进一步生长[5,16]。本试验发现,种胚丛生芽的最佳诱导激素同样适用于子叶节,且子叶节丛生芽的初步诱导状态要优于种胚丛生芽,但后期子叶节丛生芽的叶数量要少于种胚丛生芽,增殖后期生长状态略差。
水解酪蛋白是由多种氨基酸组成的添加物,在植物组织培养的各阶段均有重要的意义[17]。有人对芍药及牡丹进行快繁研究时发现,水解酪蛋白对丛生芽的增殖具有重要的作用[18-19]。李刘泽木[20]发现,0.25 g·L-1水解酪蛋白对伊藤杂种‘Bartzella’的组培苗具有明显的促进作用。以上研究结果均与本研究相符。本研究发现,0.3g·L-1酸水解酪蛋白可显著提高丛生芽的增殖率。
本试验已通过两步诱导法,解决了芍药丛生芽诱导率低、增殖困难的问题,获得大量增殖的丛生芽苗,缩短了芍药的育苗周期,但在增殖后期丛生芽的基部褐化较为明显,会限制丛生芽生根,因此,下一步应着重解决增殖过程中丛生芽基部褐化的问题,提高芽苗质量,进而诱导生根,实现芍药丛生芽再生。
综上,0.5mg·L-1GA3与1.0mg·L-16-BA的激素组合最适合芍药种胚启动培养,有腋芽产生,利于丛生芽诱导;授粉75d后采收的种子均适宜胚启动培养;暗培养4d可提升胚苗的质量。两步进行诱导可以逐步提高胚苗对高浓度激素的适应能力,降低高浓度激素对胚苗的直接伤害。1.0mg·L-1GA3与1.0mg·L-16-BA的激素组合最适合种胚丛生芽初步诱导;1.0mg·L-1GA3与2.0mg·L-16-BA的激素组合最适合种胚丛生芽二次诱导;3.0mg·L-16-BA为丛生芽增殖最适宜的浓度,配合0.3g·L-1CH更有利于丛生芽增殖生长。完整的种胚丛生芽比子叶节丛生芽具有更高的分化程度,在二次诱导及增殖中效果显著。

