虾肝肠胞虫病的研究进展
姜宏波,陈裕文,陈启军
(沈阳农业大学 畜牧兽医学院,沈阳 110161)
1 肝肠胞虫的发现和生物学特征
早在2001年,HUDSON等[1]通过透射电镜在日本囊对虾(Penaeus japonicus)的肝胰腺上皮细胞内发现了一种微孢子虫,形态学上观察与当时已知的微孢子虫均不一致,但是只介绍了形态特征并没有进行深入研究,后期通过临床症状和电镜图片比对推测这种微孢子虫为虾肝肠胞虫 (Enterocytozoon hepatopenaei,EHP)。2004年,研究者在泰国生长缓慢的斑节对虾(P.monodon)肝胰腺小管上皮细胞内发现了一种未知微孢子虫[2],虽未命名但后期证实为EHP。直到2009年,TOURTIP等[3]才通过组织病理学、超微结构和分子技术等分析手段首次对EHP进行了命名。最终将其分类于真菌界、微孢子虫门、单倍期纲、壶孢目、肠胞虫科、肠胞虫属。同其他微孢子虫相似,EHP也属于严格细胞内寄生。成熟的孢子呈卵圆形,大小为0.7μm×1.1μm。EHP基本结构由胞壁、锚定盘、孢原质、5~6圈极丝、1个细胞核、极膜层、多个核糖体、1个后液泡等组成[3]。胞壁由3层结构组成,从外到内分别是高电子密度外壁(2nm),由蛋白质和几丁质组成的低电子密度的内壁(10nm)和原生质膜。孢子内具有独特的侵染装置——极管(直径在0.1~0.2μm),与孢子顶端的锚定盘相连接(图 1)[4]。
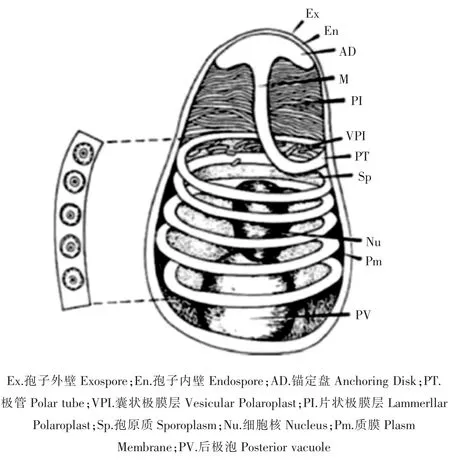
图1 微孢子虫的模式图Figure 1 Ultrastructure of microsporidian spore
2 流行情况
自2013年以来,我国各地养殖的凡纳滨对虾先后出现EHP感染,感染率居高不下。陈禄芝等[5]对粤西地区凡纳滨对虾进行检测发现,EHP的阳性检出率为41.38%,在检测样品中,成虾的EHP检出率最高达93.75%。2015年浙江省舟山市大棚养殖的凡纳滨对虾270份病虾样本中,EHP检出率高达85.19%[6]。2015年,王博雅等[7]在辽宁省营口市和盘锦市的对虾中EHP检出率达34.60%,在小虾样本中检出的阳性率高达100%,而大虾样本中均未检出。许杰等[8]在2015~2017年在天津市养殖凡纳滨对虾中均检测出EHP,2015年阳性检出率达57.33%,2016年阳性率高达70.19%。2019年,江苏泥塘虾的EHP患病率(79.5%)远高于大棚养殖(56.3%)。此外,值得注意的是大棚正常养殖的虾体中EHP的流行率(10.6%)远低于泥塘正常养殖的虾体(72.4%)[9]。2017年,国家虾蟹产业技术体系开展的被动监测结果显示,EHP已在我国虾类主要养殖区广泛分布,在山东、河北、江苏、上海、浙江、福建、广东、海南和新疆均有不同水平的检出。除我国外,泰国、印度、文莱、越南、委内瑞拉、印度尼西亚和马来西亚等国均有EHP检出[10]。在印度东海岸西孟加拉邦的对虾人工养殖中发病率高达84.9%,比在印度其他养殖区域检出率高21.4%。
3 感染宿主和传播途径
EHP宿主广泛,不仅仅感染凡纳滨对虾,目前已知感染的其他虾类宿主有斑节对虾、日本囊对虾、罗氏沼虾、南美蓝对虾(P.stylirostris)。除了虾之外,在鱿鱼、沙蚕、商品化冷冻桡足类、商品化卤虫卵、商品化卤虫幼体、冰冻成体卤虫均检测出可以携带EHP[11-12]。在EHP传播试验中表明,携带EHP的水体和投喂患病虾的方式均可以使健康虾感染[13],也可以通过摄食携带EHP的鲜活饵料、病死虾或环境中的孢子体进行水平传播,不需要中间宿主就可以在对虾中传播,在幼虾中也同样如此[14-16]。通过垂直传播试验取样,经PCR方法和组织病理学切片技术手段证明了亲本虾可以向子代进行垂直传播[17]。2017年,在伊朗西南部外来鸟814份粪便中,检测出319个样本呈现阳性,阳性比率达39.1%[18]。检测出微孢子虫主要包括比氏肠炎微孢子虫和兔脑炎微孢子虫属。这两种微孢子虫均属于人畜共患孢子虫,推测携带有微孢子虫的鸟类可能是该病的重要传染源之一,EHP能否通过鸟作为载体尚需进一步研究。但由于EHP的宿主广泛,传播过程中不需要中间宿主,即可通过水体又可以通过摄食进行传播,加大了EHP的预防难度。
4 主要危害
印度作为第二大对虾生产国,由于EHP在虾体中普遍检出,有报道称2014~2015年对虾的年产量减少10%~20%,损失达数千万美元[19]。研究表明,感染EHP后的对虾死亡率与正常虾没有显著差别,但感染后的虾生长缓慢,出现摄食减少或者摄食后生长缓慢的现象,成为危害我国对虾产业的主要原因之一。2017年河北省对虾养殖病害调查报告表明[20],虾EHP阳性群体个体大小不均匀,小个体重量只有大个体虾的十分之一。患有肝肠胞虫病的虾死亡率不高,但产量减产30%。刘雅梅等[21]发现EHP阳性群体体重偏差率是EHP阴性群体的2.34~3.45倍,体长相同时EHP阳性的体重波动变大。在越南,感染EHP的凡纳滨对虾后期幼体投入池塘后,在最初的25d内,对虾的生长速度保持在平均水平。但是随着时间推移,对虾的进食量减少50%~70%,肝胰腺变色,体积的生长只有未感染EHP虾的10%~40%[22]。SANTHOSHKUMAR等[23]发现在特定的年龄,患病虾的大小几乎是未感染的虾的一半。在120d时,正常虾的体重约为20~23g,而在同期EHP感染虾的体重约为8~13g。实验室内研究同样发现,EHP感染的小虾在30d后体重没有增加,而正常虾的体重在30d的试验期间增加2g。除降低生长性能外,感染EHP的虾可能引起免疫机能下降,机体更容易被细菌、病毒等微生物入侵,引起交叉感染。TANG等[24]在感染EHP的凡纳滨对虾的粪便中检出了杆状细菌。BIJU等[25]发现,在感染EHP的斑节对虾和凡纳滨对虾中伴随着细菌合并感染。ARANGUREN等[26]发现,EHP是导致凡纳滨对虾急性肝胰腺坏死(AHPND)和败血性肝胰腺坏死(SHPN)的一个风险因素。感染EHP后引成的生长缓慢等症状势必会影响到经济效益。2018年,RAVEENDRA[27]在统计印度养虾池塘效益时发现,感染EHP的凡纳滨对虾的平均体重、每日增长量、总产量均显著低于健康池塘。感染EHP的池塘可造成每池损失3.6~4.3万卢比(折合人民币约3500~4200元)。

图2 微孢子虫生活周期示意图[28]Figure 2 The life cycle of microsporidian
5 生活史和入侵机制
微孢子虫生活史大致分为3个部分[28]:(1)感染期。环境中的成熟孢子弹出极管,像“注射器”一样刺入宿主细胞的细胞质。孢原质通过弹出的极管管腔释放,极管先端形成芽体,芽体进入宿主细胞内。(2)裂殖增殖期。芽体在侵入宿主细胞内后的几小时内,保持最初的圆形,大小则逐渐增大,随后芽体以二分裂或多分裂逐渐增大发育为裂殖体,然后变异为母孢子,此过程反复进行,母孢子数量增加,从而进入孢子增殖期。(3)孢子增殖期。母孢子以二分裂方式形成孢子母细胞,并由孢子母细胞发育为成熟的孢子,标志着一个生活史的完成(图2)。TOURTIP等[3]利用透射电镜观察到EHP在裂殖体阶段的核分裂,同时也看到了多孢子的增殖形态,但未观察到早期裂殖子时期以及感染期等阶段。因此,关于EHP的生活史仍然需要继续开展深入的研究工作。
关于微孢子虫的入侵机理主要有两个假说:一是微孢子虫在一定外界环境的刺激下 (可能是温度、Ca2+浓度、水压变化等,具体的条件尚未清楚),弹射出极管通过机械力刺破宿主细胞膜,然后将具有侵染性的孢原质通过极管注入到宿主细胞质内部;二是极管弹出其顶端并未刺破宿主细胞膜,而是极管在细胞膜表面形成凹陷,然后将孢子的孢原质注入到该凹陷结构内部,随后内陷结构从细胞表面向内脱落形成侵染泡,从而侵染宿主[29]。EHP的入侵途径到底是哪种方式尚不清楚。JAROENLAK等[30]鉴定并描述EHP的第一个孢子壁蛋白(EhSWP1)。通过体外结合试验、竞争试验和诱变研究等表明EhSWP1是一种肝素结合蛋白,能够与细胞表面肝素结合,肝素能够被疟原虫和利什曼原虫等胞内寄生虫识别,推测EHP主要通过肝素途径入侵宿主。WANG等[31]在家蚕微孢子虫的孢壁蛋白NbSWP16中,也预测到肝素结合位点。免疫电镜定位显示NbSWP16定位于孢子外壁,通过体外实验阻断NbSWP16后使得孢子粘附宿主细胞减少了20%以上。
程东远等[32]通过原位杂交技术检测了EHP在凡纳滨对虾不同组织间感染的差异性,结果在肝胰腺、中肠、血淋巴、鳃和肌肉中均出现阳性信号,但在肝胰腺和中肠内容物的杂交信号强,而血淋巴、鳃和中肠上皮细胞杂交信号弱。SANTHOSHKUMAR等[23]对自然感染凡纳滨对虾的不同器官进行组织学和PCR检测,检测结果为肝胰腺最亮,鳃、血淋巴和心脏次之,肠道和肌肉也有条带出现但较暗。推测主要寄生于肝胰腺上皮细胞,然后通过循环系统到达各个器官并逐渐积累,但仍需要进一步研究进行证实。
6 检测方法
EHP个体微小,感染EHP的对虾症状不明显。因此,很难在现场确诊。传统的组织切片方法制作时间长,制作流程复杂,在肝肠胞虫含量低的条件下不容易发现,不适合作为判断是否感染发病的技术手段。相比之下,分子生物学方法具有快速、简便和灵敏度高等特点,已成为实验室检测EHP的常规手段。目前常用的方法有普通PCR、巢式PCR、qRT-PCR、原位杂交、环介导等温扩增技术(LAMP)等方法。
6.1 PCR方法
由于组织切片方法检测效率低,观察困难,PCR方法已经成为最常用的EHP检测手段之一[33-37]。普通PCR针对肝肠胞虫的特异性片段只进行一次扩增,目前针对EHP的检测技术大多根据small subunit ribosomal RNA(SSU rRNA)序列设计引物进行检测。但是在含有目的基因中混合Enterospora canceri和Hepatospora eriocheir两种微孢子虫时,会呈现假阳性的状况,而且假阳性条带的位置与目的条带位置不易辨别,无法准确判断是否为EHP感染[33]。巢式PCR反应有两次PCR扩增,增加了检测的敏感性和特异性。JAROENLAK等[33]根据孢壁蛋白质spore wall protein(SWP)序列设计引物,建立了巢式SWP-PCR检测技术。SWP-PCR相比较SSU-PCR具有更好的准确性。目前,全国水产技术推广总站推荐检测EHP病原也是巢式SWP-PCR检测技术。此外,有学者以EHP的β-tubulin序列设计引物,建立巢式PCR也具有很好的敏感性和特异性[34]。
qRT-PCR是PCR反应系统与荧光集团相结合,利用荧光信号积累实时检测整个PCR进程,通过标准曲线对未知模板进行定量分析。刘珍等[35]研究发现虾肝肠胞虫SYBR Green I荧光定量PCR检测方法的灵敏度要显著高于常规PCR和巢式PCR。比较结果显示,SYBR Green I荧光定量PCR至少比常规PCR定性检测的灵敏度高1个数量级,是巢氏PCR灵敏度4倍。骆云慧等[36]建立TaqMan实时荧光定量PCR方法,该方法对EHP标准质粒的检测灵敏度为5.20×102copies·μL-1,比常规PCR高10倍。整个检测反应只需2h,提高了检测效率和敏感性。此外,对白斑综合征病毒、传染性皮下及造血组织坏死病毒、高致病性副溶血弧菌、对虾微孢子虫感染的棉花虾组织样品等均没有交叉反应,具有良好的特异性和可重复性,变异系数仅为0.94%~1.13%。张娜等[37]建立TaqMan荧光qPCR方法的检测灵敏度较常规PCR方法至少高出1个数量级。宋增磊等[38]通过基于Taq-Man荧光qPCR的EHP检测的并样分析,国际标准中推荐的5∶1并样检测方式可以扩展到50∶1的检测方式,可为群体中存在7%以上的感染率提供准确性且低成本的检测方案,其诊断特异性和诊断灵敏度与5∶1并样检测接近,缩短了检测时间,节约了检测成本。
6.2 原位杂交(in situ hybridization,ISH)
ISH技术具有灵敏度高、特异性强、定位和相对定量检测的优势,因此被经常用于EHP的检测。TANG等[22]利用ISH技术对凡纳滨对虾肝胰腺小管上皮细胞进行了检测,发现了明显的杂交信号。相比较组织学ISH对病原体的检测更为敏感,组织学在细胞中未见明显包涵体和EHP的孢子,而ISH呈现阳性。在含有白便的池塘中[23],对20只虾的肝胰腺进行了EHP ISH试验,结果均呈阳性。探针对细胞质内嗜碱性包涵体反应强烈,从ISH中析出的蓝紫色沉淀物与H&E组织学观察到的包裹体相一致。此外,检测的肝胰腺样品都患有败血性肝胰腺坏死(SHPN)。原位杂交能够直接显示肝胰腺组织病灶的位置,感染患病越严重的区域,信号反馈也就越强烈。对于同一患病组织同时进行原位杂交检测与H&E染色分析[16],可以更好地估计EHP对组织侵染程度和定位,不足的是组织病理学是冗长而费时的过程。
6.3 环介导等温扩增技术(LAMP)
LAMP为新型核酸扩增方法,具有高灵敏度、高特异性、高准确度和低成本等优点,适用于生产中对虾肝肠胞虫的快速诊断。KARTHIKEYAN等[39]首次采用实时LAMP技术对虾体内EHP进行检测和定量分析。实时LAMP技术可以检测到10-3~10-1,实时PCR技术也可以检测到10-3,巢式PCR显示在10-2~10-0之间。孙妍等[40]比较LAMP法和常规PCR的灵敏度,LAMP法的检出限为3.71个质粒拷贝·μL-1,PCR方法的检出限为371个质粒拷贝·μL-1,灵敏度是普通PCR方法的100倍。LAMP方法可在1h内得出检测结果,反应装置要求不高且操作简单。目前,科研工作者已开发出商品化试剂盒和仪器投入市场使用,非常适用基层和现场的EHP快速检测。

表1 EHP检测技术优缺点比较Table 1 Comparison of advantages and disadvantages of EHP detection technology
7 防治措施
EHP属于胞内寄生,目前没有有效药物进行治疗。因此,在养殖过程中的预防显得更为重要。养殖的环节众多,每一个环节都可能引起EHP的感染,因此需要在养殖各个环节中多方面实施预防手段,进而减少EHP的感染。维持水体中的氨氮在一定浓度可以有效控制虾体中EHP携带量[41],但是并不能杀死EHP。研究表明,通过体外药物作用和低温等方式有效抑制EHP的极丝排放,如在-20℃冷冻2h,用15mg·L-1KMnO4处理15min,40mg·L-1的65%活性氯处理15min,20%乙醇作用15min均可100%抑制EHP极丝释放[42]。KMnO4和活性氯可适用于农业设备、管道、水箱、池塘等表面,乙醇可用于养殖场进出人员的消毒杀菌。但“失活的”肝肠胞虫是否丧失侵染性,在环境条件改善后是否会重新侵染还需进一步研究证实。目前,尚未有研究表明有药物可以杀灭虾体内的EHP。烟曲霉素对东方蜜蜂孢子虫的具有良好的治疗效果,但对EHP没有治疗效果[24]。PTASZYNSKA等[43]用蔗糖-卟啉类化合物混合的糖浆饲喂受感染的蜜蜂,与对照组的蜜蜂相比,孢子数量显著减少。扫描电镜下观察试验组蜜蜂中的EHP,EHP的孢壁表现出明显的变形。因此,卟啉类药物对微孢子虫的作用机制可能是破坏其孢壁,孢壁失去了保护作用造成孢子死亡,这些药物在防治EHP时是否有作用尚不清楚。将携带家蚕微孢子虫(Nosema bombycis)的蚕卵进行高温即时浸酸处理[44],用real-time PCR对带毒蚕卵进行定量检测,经对照组比较发现,高温即时浸酸对家蚕微孢子虫病有良好的防治作用。对于虾卵可以尝试采取类似措施,具体温度和酸度及对应虾卵时间还需进一步试验验证是否具有显著效果。RNA干扰技术在控制蜜蜂以色列急性麻痹病毒(IAPV)已崭露头角,RNA沉默机制已经在蜜蜂微孢子虫基因组中被发现[45-47],这表明通过RNA干扰调控基因表达控制甚至杀灭微孢子虫在防治方面具有潜在价值,值得开展深入研究。
8 展望
近些年,凡纳滨对虾肝肠胞虫的感染率居高不下,造成对虾生长缓慢,养殖户经济效益显著下降,已经成为制约凡纳滨对虾养殖业健康发展的最主要病害之一。但关于肝肠胞虫仍有很多问题尚不清楚,这也阻碍了对肝肠胞虫病的防治。因此,在接下来的研究工作中,明确EHP的传播途径和宿主范围,做好预防措施,解析EHP的入侵机理,开发有效治疗EHP的药物,以及筛选抗EHP的对虾优良种质是解决虾肝肠胞虫病的根本途径。

