刺槐体细胞胚发生的同步化调控
习洋,孙宇涵,李云
(1.国家知识产权局专利局专利审查协作北京中心 医药生物部,北京 100160;2.北京林业大学 生物科学与技术学院,北京 100083)
体细胞胚发生是体细胞向胚胎发生途径转变的重建过程,也是证明细胞全能性理论的经典实例.
建立一个高频率、同步化发生的体细胞胚培养系统,对深入揭示植物胚胎发育机制以及在植物遗传转化和人工种子等方面应用均很重要[1].早在1973年Okamura[2]就在胡萝卜细胞培养中采用低温处理和饥饿处理相结合的方法获得了较好的细胞同步化结果.陈春玲[3]通过控制培养基中2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)的质量浓度来调控龙眼体胚的发育,研究表明经过不同质量浓度2,4-D处理后的材料染色体数目正常,且仍然保持着很强的体细胞胚发生能力,通过对龙眼整个体细胞胚发生过程的研究,根据不同发育阶段材料对培养基中2,4-D的质量浓度需求不同,实验设计了多种同步化培养基并分别获得了非胚性愈伤组织、胚性愈伤组织Ⅰ( 1 mg/L 2,4-D) 、胚性愈伤组织Ⅱ( 0.8 mg/L 2,4-D) 、胚性紧密结构、不完全胚性紧密结构、球形胚、玻璃化早期子叶形胚、成熟子叶形胚等 8 个阶段的同步化调控材料.目前,通过调控培养得到同步化的植物体细胞胚仍是尚未解决的难题,进行过细胞同步化和体细胞胚发生的同步化培养研究的仅有胡萝卜、水稻、枸杞、龙眼等少数几种植物[1].
本实验室前期利用不同时期的刺槐未成熟合子胚诱导愈伤组织,研究了幼胚胚龄和不同植物生长调节剂对于体细胞胚诱导的影响[4],并建立了刺槐胚性细胞悬浮系[5].本文是在已建立了刺槐体细胞培养体系基础上,进一步对刺槐胚性愈伤组织的体细胞胚发生及同步控制进行了研究,建立了刺槐体细胞胚发生及同步控制的培养体系,以期有助于生理生化和分子水平上的刺槐体细胞胚发生机制研究.
1 材料与方法
1.1 实验材料
由刺槐55 d胚龄的未成熟合子胚诱导得到的嫩黄绿色、松散易碎、颗粒状的刺槐胚性愈伤组织由北京林业大学生物科学与技术学院李云课题组提供.
1.2 低温处理控制体细胞胚同步化
将多次继代的胚性愈伤组织接种到体细胞胚诱导培养基中,置于4 ℃的低温条件下分别处理0、7、14、21、28 d后转移到正常温度条件下培养,7 d后观察体细胞胚生长情况,且每7 d统计体细胞胚的发生数目.体细胞胚诱导培养基为MS(Murashige & Skoog)+NAA(naphthylacetic acid) 0.5 mg/L+ BA(benzyladenine ) 0.5 mg/L+2-吗啉乙磺酸 (MES) 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白 500 mg/L+蔗糖30 g/L+琼脂6 g/L[4].
1.3 蔗糖质量浓度控制体细胞胚同步化
将多次继代的胚性愈伤组织接种到附加不同质量浓度(0,20,30,50,70 g/L)蔗糖的体细胞胚诱导培养基中,每7 d观察体细胞胚生长情况,并统计体细胞胚的发生数目. 体细胞胚诱导培养基为MS+NAA 0.5 mg/L+ BA 0.5 mg/L+MES 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L +琼脂6 g/L.
1.4 外源植物生长调节剂质量浓度控制体细胞胚同步化
将多次继代的胚性愈伤组织接种到附加不同质量浓度(0,0.1,0.3,0.5,1.0 mg/L)2,4-D的体细胞胚诱导培养基中,每7 d观察体细胞胚生长情况,并统计体细胞胚的发生数目. 体细胞胚诱导培养基为MS+BA 0.5 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L+蔗糖30 g/L+琼脂6 g/L.
1.5 悬浮培养控制体细胞胚同步化
选择嫩黄绿色、颗粒状、生长较快的胚性愈伤组织,置于培养基成分为1/2 MS+MES 500 mg/L+NAA 2.5 mg/L+BA 0.5 mg/L+蔗糖30 g/L的悬浮培养基中,得到分散度较好、稳定性较强且具有胚性的悬浮培养细胞[5].
用吸管吸取悬浮液,将悬浮培养的胚性细胞用50目筛(孔径0.28 mm)过滤,将留在筛上的细胞团均匀地接种到表面垫有滤纸的MS+NAA 0.5 mg/L+ BA 0.5 mg/L+MES 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L+蔗糖30 g/L+琼脂3 g/L半固体愈伤组织的诱导培养基上,进行看护培养.使用SPSS 17.0进行数据分析,每个处理3个重复.
2 结果与分析
2.1 低温对体细胞胚发生同步化的影响
将前期诱导得到的胚性愈伤组织在4 ℃条件下低温处理,经过42 d的恢复培养,发现随着低温处理时间的延长,体细胞胚子叶期同步化率逐渐降低(图1).低温处理7 d的子叶体细胞胚同步化率最高,为37.3%,而低温处理14 d的子叶体细胞胚同步化率仅为27.3%,与低温处理7 d的子叶体细胞胚相比延长低温处理时间(21 d和28 d)的子叶体细胞胚同步化率均显著降低(P<0.05).
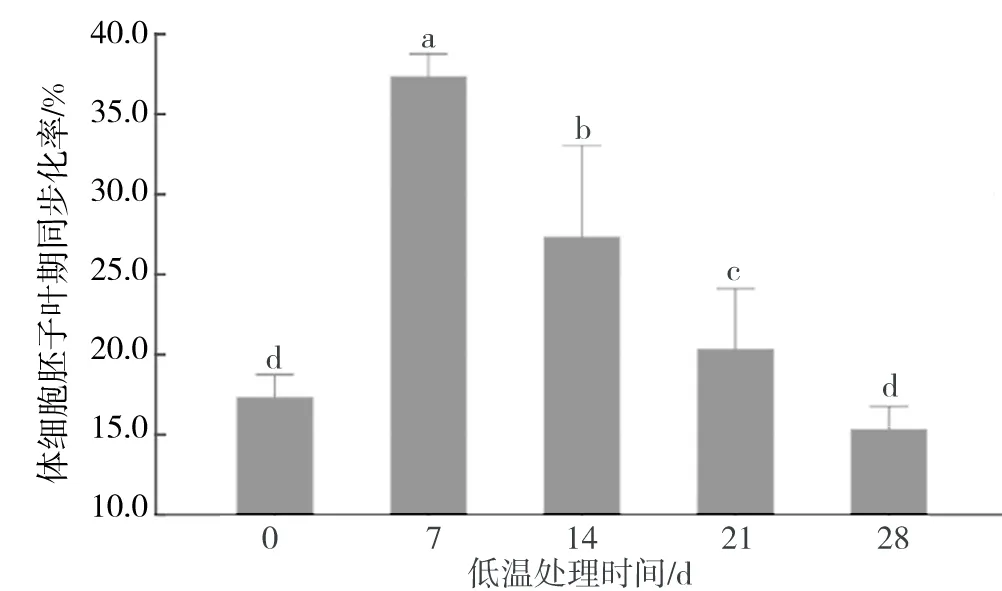
图1 不同低温处理时间对体细胞胚子叶期同步化率的影响Fig.1 Effects of different freezing time on the synchronization of cotyledon somatic embryos
实验观察发现,低温处理7 d的胚性愈伤组织颜色接近正常,愈伤组织基部边缘有轻微褐化的现象.随着低温处理时间延长,胚性愈伤组织的褐化现象渐渐加重(表1).当低温处理21 d时胚性愈伤组织出现明显的褐化现象,整个愈伤组织块呈现褐色.而低温处理28 d时其褐化现象与低温处理21 d时差别不大,只是个别部位褐化更为严重.这一现象可能是由于低温处理对刺槐胚性愈伤组织造成的伤害主要取决于温度变化,而当低温处理温度一定时,处理时间的长短对刺槐胚性愈伤组织造成的伤害没有显著差异.然而,较长的低温处理时间会抑制刺槐胚性愈伤组织的体细胞胚发生.统计实验数据,分析发现低温处理7 d的子叶体细胞胚同步化率与对照有显著差异 (P<0.05).

表1 不同低温处理时间对体细胞胚发育的影响
胚性愈伤组织经过低温处理后畸形胚的发生率明显降低(表1).徐元红[6]在平贝母体细胞胚诱导和植株再生的过程中发现,未经低温处理(0~5 ℃冰箱中处理60 d)的体细胞胚会发育成为畸形胚.Mahesh[7]认为低温处理与低培养温度综合作用,可明显提高体细胞胚的发生数量,且有利于体细胞胚的正常发育.从表1中可以发现,随着低温处理时间的延长,畸形胚的发生率逐渐降低,但下降幅度不大.综合分析低温处理实验结果,在低温(4 ℃)条件下将胚性愈伤组织处理7 d最有利于刺槐体细胞胚的同步化.
2.2 蔗糖质量浓度对体细胞胚发生同步化的影响
将经过多次继代的胚性愈伤组织接种到5种不同蔗糖质量浓度的体细胞胚诱导培养基上,培养基为MS+NAA 0.5 mg/L+ BA 0.5 mg/L+MES 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L+琼脂6 g/L.培养28 d后观察体细胞胚的发育情况,56 d后统计子叶期体细胞胚的同步化情况和畸形胚的发生情况及体细胞胚的败育情况.
如图2所示,在蔗糖质量浓度升高的培养基中诱导得到的体细胞胚其同步化率远高于对照组(P<0.05).当蔗糖质量浓度为50 g/L时,其子叶体细胞胚的同步化率最高,可达35.0%,与蔗糖质量浓度为30 g/L的对照组的体细胞胚同步化率(17.3%)相比有显著差异(P<0.05).Bomal[8]在对黑云杉的体细胞胚诱导实验中发现,渗透压升高导致的水分饥饿能够促进体细胞胚的同步化发生.本实验中得出相同的结论.当培养基中的蔗糖质量浓度升高到50 g/L时,培养基中的碳源丰富,能够满足胚状体发生的需要,与对照组相比,此时的培养基渗透压升高,水分相对不足,胚性愈伤组织在水分饥饿的条件下渐渐停止增殖分裂,随后细胞开始分化,向胚状体方向发展.当培养基中的蔗糖质量浓度降低为20 g/L时,体细胞胚的同步化率也略有升高,为18.3%,与对照组相比差异不显著.分析原因,可能是由于培养基中的蔗糖质量浓度较低,此时体细胞胚的发育主要受到能量供给的限制,而渗透压的调节作用处于次要地位造成的.当培养基中无蔗糖存在时,其子叶体细胞胚的同步化率显著低于有蔗糖条件下的子叶体细胞胚的同步化率.这可能是由于愈伤组织转移到无糖培养基后,其能量供应不足,组织停止发育,使得体细胞胚生长缓慢甚至褐化死亡.

图2 不同蔗糖质量浓度对体细胞胚子叶期同步化率的影响Fig.2 Effects of different sucrose mass concentration on the synchronization of cotyledon somatic embryos
在植物体细胞胚的诱导培养过程中,长久以来没有克服的技术难题是无法抑制畸形胚的发生,本研究中也存在同样的问题.如图3所示,畸形胚的发生率随着蔗糖质量浓度的改变而发生变化.当培养基中的蔗糖质量浓度过高或过低时都会导致畸形胚的发生率显著升高.培养基中蔗糖质量浓度降为0时,畸形胚发生率达到最高,为78.3%,分析原因,可能是因为在不含蔗糖的培养基中培养基渗透压过低,供应细胞合成的碳源不充足等原因导致的.然而,统计分析显示培养基中蔗糖质量浓度为20和50 g/L时体细胞胚畸形率彼此之间无显著性差异.

图3 不同蔗糖质量浓度对体细胞胚败育和畸形发生的影响Fig.3 Effects of different sucrose mass concentration on the abortive somatic embryogenesis and abnormal embryogenesis
实验中发现,体细胞胚的败育现象存在于体细胞胚诱导、同步化及体细胞胚成苗的全过程中.观察实验中处于不同蔗糖质量浓度培养条件下的刺槐体细胞胚的败育情况,结果发现培养基中蔗糖质量浓度降为0时,败育率最高,为59.0%(图3).这可能是由于培养基中不添加蔗糖时胚性细胞难以增殖,而此培养条件适宜非胚性细胞的增殖,此时,愈伤组织中的胚性细胞逐渐丧失胚性,转化为非胚性细胞,因此在这种无蔗糖的培养条件下,恢复培养物中胚性细胞的体细胞胚发生潜能是不可能的.提高培养基中的蔗糖质量浓度虽然也会使体细胞胚的败育率增高,但是这种影响远低于蔗糖质量浓度降低时的影响.当培养基中的蔗糖质量浓度为50 g/L时,体细胞胚的败育率为15.0%,且大部分败育的胚状体都分布在与培养基接触的部分.
综合上述实验结果,培养基中蔗糖质量浓度为50 g/L时最适宜调控刺槐的体细胞胚同步化.
2.3 外源植物生长调节剂质量浓度对体细胞胚发生同步化的影响
将经过多次继代的胚性愈伤组织接种到含有不同2,4-D的体细胞胚诱导培养基上,培养基为MS+ BA 0.5 mg/L+MES 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L+蔗糖30 g/L+琼脂6 g/L.培养28 d后观察愈伤组织上体细胞胚的发育情况,培养56 d后统计刺槐子叶期体细胞胚的同步化发生情况和畸形胚的发生情况.
实验结果如图4所示,2,4-D不仅对体细胞胚的诱导起决定作用,还可以控制体细胞胚的同步化发育,随着培养基中2,4-D质量浓度的降低体细胞胚的同步化率相应升高.当培养基中2,4-D的质量浓度为0.1 mg/L时,体细胞胚的同步化率最高,为43.6%.刘选明[9]在对杂交水稻的体细胞胚同步化研究中发现2,4-D能够影响胚性细胞的活力,高质量浓度的2,4-D显著抑制体细胞胚的发生和发育,使胚性愈伤组织进入周而复始的增殖周期而无法分化成胚状体.当培养基中不含2,4-D时,体细胞胚的同步化率有所下降,但此时的同步化率与2,4-D质量浓度为0.3 mg/L时差异不显著.
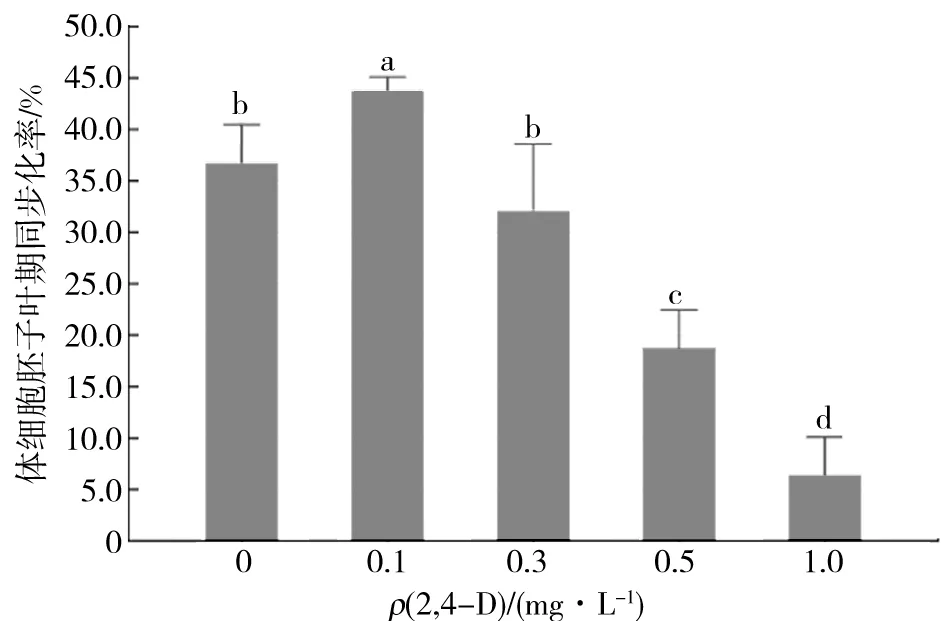
图4 2,4-D质量浓度对体细胞胚子叶期的同步化率的影响Fig.4 Effects of different 2,4-D mass concentration on synchronization of cotyledon somatic embryo
袁澍等[10]研究发现2,4-D通过与细胞内的激素受体蛋白结合而对某些控制植物体胚发生的特异表达基因起调控作用,它可以激活某些控制细胞胚性的相关基因,增加胚胎发生特异蛋白的表达量;此外,2,4-D对畸形胚的发生有较好的抑制效果,在适宜的质量浓度下,2,4-D能够抑制多种畸形体细胞胚的发生.本研究也得出了相同的结论,随着培养基中2,4-D质量浓度的升高,畸形胚的发生率逐渐降低.但是2,4-D质量浓度为0.1~0.5 mg/L时的畸形胚发生率差异并不显著(图5).
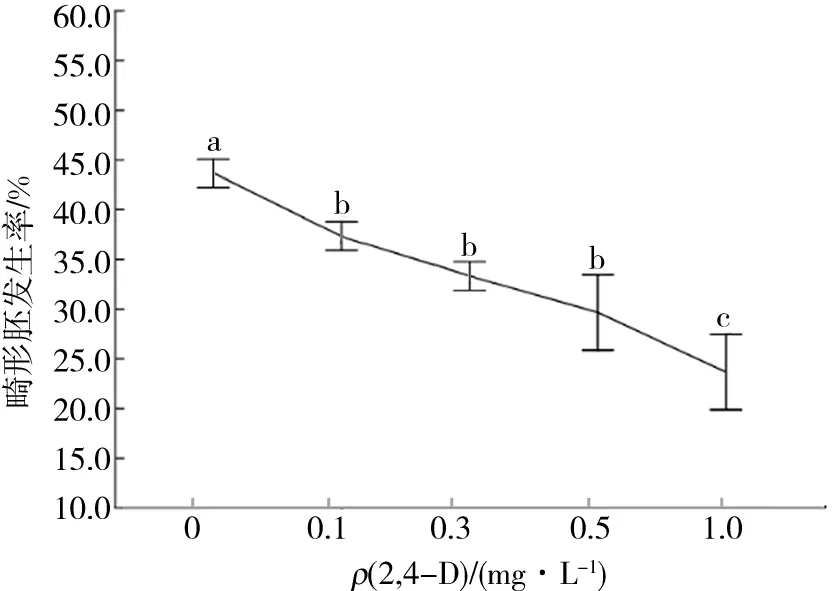
图5 2,4-D质量浓度对畸形胚发生率的影响Fig.5 Effects of 2,4-D mass concentration on abnormal embryogenesis
综合上述实验结果,培养基中的2,4-D质量浓度为0.1 mg/L时最适宜体细胞胚同步化的调控.
2.4 悬浮培养细胞的体细胞胚同步化诱导
图6a-i显示了各发育阶段的同步化体细胞胚.将悬浮培养的胚性细胞用50目筛(孔径0.28 mm)过滤,将留在筛上的细胞团接种到铺有滤纸的半固体体细胞胚诱导培养基上(图6g),培养基为MS+NAA 0.5 mg/L+ BA 0.5 mg/L+MES 500 mg/L+谷氨酰胺 500 mg/L+水解酪蛋白500 mg/L+蔗糖30 g/L+琼脂3 g/L.培养7 d后观察到细胞团的数量明显增多,14 d左右可以发现有少量体细胞胚发生(图6h).培养21 d左右,球形胚大量发生(图6i),占到总胚状体数目的67.3%.在得到的胚状体中,有部分球形胚进入了鱼雷胚期和子叶胚期,但二者的数目仅占总胚数的20.4%和12.3%(表2).随着总胚数的逐渐增加,球形胚数量逐渐减少,鱼雷期和子叶期的体细胞胚数量逐渐增加,但球形胚期的体细胞胚仍占主要地位.实验中没有观察到典型的大量心形胚的发生时期.这可能是由于心形胚的发育时期较短,不易观察.培养至28 d时,总体细胞胚数的增加开始减缓,球形胚向鱼雷胚和子叶胚的转化也逐渐停滞,畸形胚的数量显著增加.分析原因可能与营养物供给不足有关.将培养21 d的球形胚转接至新鲜的垫有滤纸的诱导培养基上继续培养能够有效降低畸形胚的发生比例,得到大量同步化的正常发育的体细胞胚.

a.同步化的球形体细胞胚;b.同步化的鱼雷胚;c.同步化的子叶胚;d.起始密度为2 g时的悬浮培养细胞团;e.悬浮培养 21 d后的胚性细胞团;f.悬浮培养21 d后的胚性培养物;g.接种到看护培养基上的悬浮培养物;h.看护培养14 d后 得到的球形胚;i.看护培养21 d后得到的球形胚和个别鱼雷胚.图6 同步化的各发育阶段的体细胞胚Fig.6 Synchronized somatic embryo at different developmental stages
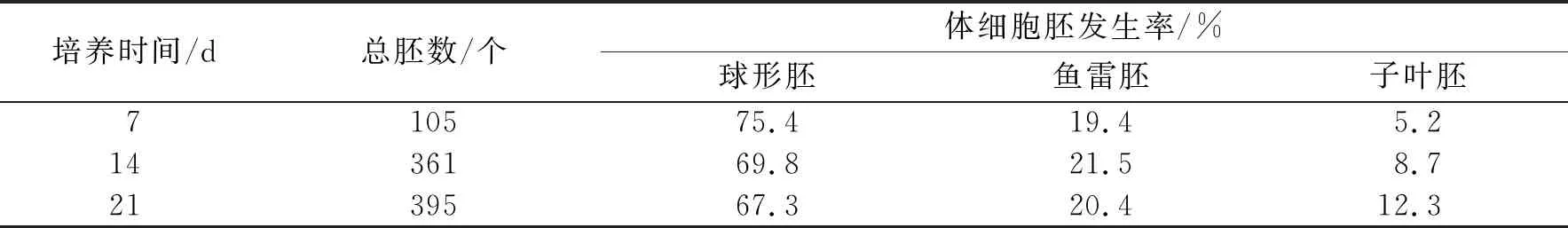
表2 看护培养下不同时期的体细胞胚发生率
表中数据为每个时期统计3个培养皿中体细胞胚数目.
3 讨论
1)低温可以导致细胞发育的停滞,即形成温度伤害,这种温度伤害常可以用来调控体细胞胚的同步化发生.李凤荣[11]研究了不同低温处理时间下蚕豆根尖细胞分裂的同步化情况,结果发现,低温处理时间对细胞的同步化率有显著影响.周爱文[12]的研究表明,温度对于植物细胞的有丝分裂具有显著的影响,在一定温度范围内,随着温度的下降细胞分裂速度减缓、细胞周期延长,相应地延长了细胞分裂期的时间,分裂指数相应提高,细胞的同步化率也相应升高.当培养温度恢复至正常水平时,大量细胞即进入DNA的合成期,随后出现一个明显的细胞分裂高峰.低温处理可以提高红豆杉悬浮培养细胞的同步化程度,以4 ℃处理24 h后,再恢复培养24 h,红豆杉悬浮细胞分裂指数可达到10.26%[13].毛春娜[14]在对半夏悬浮培养细胞的同步化调控中采用了低温处理的方法,并发现低温处理可以显著提高细胞的同步化率,有效地提供高细胞分裂指数.本实验结果也显示,低温处理可以促进刺槐体细胞胚的同步化发生,且低温处理后的刺槐体细胞胚大小均一、发育良好,畸形胚的发生率明显降低.低温处理操作简单、方便,且短暂的低温处理一般不会引起细胞DNA和染色体的变异,目前,低温培养在动物细胞和植物细胞培养领域是倍受青睐的同步化调控方法.
2)蔗糖作为碳源,为植物细胞的呼吸代谢提供必要的能源,同时蔗糖还是培养物与培养环境维持渗透压平衡的主要调节者.在植物细胞培养方面,目前的研究大多集中在蔗糖对植物胚性愈伤组织的影响上,而针对蔗糖在体细胞胚同步化调控方面的研究却很少.本实验发现,在添加不同质量浓度蔗糖培养基中,刺槐体细胞胚发生的同步化水平存在显著差异.这说明蔗糖质量浓度对刺槐体细胞胚的同步化发生有着重要影响.分析原因,可能是由于不同发育阶段的植物体细胞胚对渗透压有着不同的需求,因此可以通过调节培养基中蔗糖的质量浓度来调节渗透压从而控制体细胞胚的发育,使其停滞在某一发育阶段[15].但是长期处于高蔗糖质量浓度的培养基中会极大地降低愈伤组织的胚胎发生能力,导致畸形胚的发生和胚状体败育.本实验综合了蔗糖质量浓度对畸形胚和胚状体败育的影响,认为培养基中蔗糖质量浓度为50 g/L时最适宜调控刺槐的体细胞胚同步化,此时的体细胞胚同步化率达到35.0%.
3)在调控植物体细胞胚的同步化发育方面外源植物生长调节剂也发挥着重要作用.杨映根[16]在青杄体细胞胚发生的实验中发现,在含有脱落酸(ABA)的分化培养基中青杄子叶期体细胞胚的同步化率可达80%以上.Merkle[17]在对针叶树体细胞胚的同步化发生研究中也发现,经过ABA处理后可产生大量高质量同步化的成熟体细胞胚.2,4-D是诱导愈伤组织必不可少的生长激素[18],2,4-D对内源激素的调节和平衡起重要作用[19],57.7%的双子叶植物和几乎所有的单子叶植物在体细胞胚的诱导阶段均使用了2,4-D[20].低质量浓度的2,4-D不仅能够促进体细胞胚的发生,而且还能够调控体细胞胚的同步化.在本实验中,低质量浓度的2,4-D能够显著促进刺槐体细胞胚的同步化发生,且同步化率可达43.6%.然而2,4-D促进体细胞胚同步化的机制尚不清楚,还有待于进一步的研究.
4)植物细胞悬浮培养具有促进胚性细胞大量快速增殖、形成均一的小细胞团和单细胞等优点,是建立体细胞胚同步化的良好实验体系[21].本实验通过建立刺槐的胚性细胞悬浮培养体系,探索了植物生长调节剂和培养方法对体细胞胚同步化的影响.细胞悬浮培养对刺槐体细胞胚的同步化调控是有效的,与固体培养相比,悬浮培养时胚性愈伤组织能够更均匀更充分地吸收营养[22-23],有利于体细胞胚胎发生的同步化[24].在一些植物的体细胞胚同步化诱导中,悬浮培养往往和ABA处理[25-26]、肌醇饥饿[27]、密度梯度离心[28-29]等方法结合使用,以实现体细胞胚的同步发育.本实验中将悬浮培养和半固体看护培养相结合,将悬浮培养16 d的胚性细胞接种到垫有滤纸的半固体培养基上,使其与培养基充分均匀接触,解决了固体培养时通常存在的培养物与培养基接触不均匀的问题.结果表明,当悬浮培养物在半固体培养基上培养21 d左右时,球形胚大量发生,占到总胚状体数目的67.3%.
4 展望
目前,能够成功进行体细胞胚同步化的植物品种还很少,对于植物体细胞胚同步化条件的优化还有待进一步研究. 本研究探索了刺槐体细胞胚同步化发生的培养条件,并综合畸形胚和胚状体败育的情况得出了各方法诱导刺槐体细胞胚同步化发生的最适条件,希望能够为其他植物种类的体细胞胚同步化调控提供参考.通过对体细胞胚发生中调控基因的研究,进一步明确外源培养条件在体细胞胚发生各阶段的调控机理,必将对于更多植物品种的体细胞胚发生同步化,以及利用体细胞胚技术制备转基因受体奠定基础,为实现通过基因修饰进行体细胞胚同步化控制创造条件.

