牛共刺激分子CD80、CD86 SYBR Green Ⅰ荧光定量PCR检测方法的建立
(西昌学院动物科学学院,西昌 615000)
T细胞作为机体重要的免疫细胞,若想发挥其功能,就需要两种信号的刺激来使其活化。第一种刺激是T细胞抗原受体与抗原肽-MHC复合物的特异性结合,第二种刺激是抗原提呈细胞表达的共刺激分子与T细胞表面的相应受体作用提供的共刺激信号[1]。在这两种信号中,仅凭第一种信号无法引起细胞因子的分泌,也无法引起T细胞的增殖。而第二种信号,即共刺激信号,虽是非抗原依赖性的,但它决定了接受第一种信号后的T细胞到底是开始活化增殖还是转为无能[2],对T细胞的功能表达具有至关重要的作用。B7家族分子是主要的共刺激分子,而CD80、CD86是B7家族分子的重要成员,也是近年来受到关注较多的成员。CD28、CTLA-4都是T细胞表面的受体,但CD80、CD86与它们结合后产生的效果却截然不同。前一种受体可以刺激T细胞活化,而后一种受体则会抑制T细胞活化[3]。荧光定量PCR作为一种新的定量试验技术相比于传统PCR有更多的优点,它不仅可以完成对DNA模板的定量检测,而且灵敏度更高、特异性更好、更加可靠,且没有气溶胶污染的风险[4]。目前已有很多关于使用荧光定量PCR技术来检测细胞因子的研究[5~9]。本研究旨在建立一种特异性强的SYBR Green Ⅰ荧光定量PCR方法,通过该方法能快捷检测牛共刺激分子CD80、CD86,为抗病毒相关研究提供技术支持。
1 材料与方法
1.1 试验材料
取健康牛新鲜的脾脏,加适量生理盐水后搅碎,静置,取上层液体,小分装-20℃冻存备用。
1.2 主要试剂与仪器
UNIQ-10柱式Trizol总RNA抽提试剂盒、M-MuLV第一链cDNA合成试剂盒和2×SG Fast qPCR Master Mix,均购自上海生工生物工程股份有限公司;2×Taq Plus PCR MasterMix,购自北京天根生化科技有限公司;PCR仪,为Eppendorf公司的Mastercycler nexus系列产品;荧光定量PCR仪,为德国Analytik Jena公司产品。
1.3 引物设计与合成
根据GenBank牛CD80、CD86的基因序列,分别设计引物(见表1),由上海生工生物工程股份有限公司完成引物合成。

表1 引物序列、大小及退火温度
1.4 标准品的制备
1.4.1 总RNA提取
取300μL牛脾脏组织悬浮液样品,10 000rpm离心3min,取上清300μL加至干净的1.5mL EP管中,再向其中加入500μL Trizol,充分混匀,剩余步骤参照UNIQ-10柱式Trizol总RNA抽提试剂盒说明书进行。
1.4.2 反转录
用M-MuLV第一链cDNA合成试剂盒进行总RNA的反转录。反转录体系为:5μL总RNA,2μL特异性引物(10 pmol),5μL RNase free ddH2O,轻轻混匀后离心3~5s,反应混合物在65℃温浴5min后,冰浴30s,然后离心3~5s。将反应管冰浴,再加入4μL 5×Reaction Buffer,1μL RNase inhibitor(40U/μL),2μL dNTP Mix(10mmol/L),1μL M-MuLV RT(200U/μL),组成20μL体系。反转录程序为:42℃ 60min;70℃10min;15℃保存。
1.4.3 CD80、CD86的PCR扩增
将得到的cDNA进行PCR扩增,PCR体系为:12.5μL 2×Taq PCR MasterMix,9.5μL ddH2O,0.5μL上游引物,0.5μL下游引物,2.0μL cDNA组成25μL体系。PCR程序为:94℃ 5min;94℃ 30s,60℃ 30s,72℃ 30s,共35个循环;72℃ 5min;4℃保存。
1.4.4 标准品构建及鉴定
PCR产物进行琼脂糖凝胶电泳,切胶,按胶回收试剂盒回收DNA片段。将纯化的DNA片段连接于pMD18-T载体上,再加入到TOP10感受态细胞进行转化,挑取阳性克隆于含有抗生素的液体LB培养基中过夜培养,提取重组质粒,进行鉴定,将鉴定为阳性的重组质粒送往上海杰李生物技术有限公司进行测序。测序正确的重组质粒作为标准品-20℃冻存备用。
1.4.5 CD80、CD86标准品浓度、纯度测定及初始拷贝数计算
测定CD80、CD86标准品的浓度、纯度,选用1.8<A260/A280<2.0的CD80、CD86标准品进行10倍系列稀释,稀释后置于-20℃保存备用。根据拷贝数计算公式[10],计算CD80、CD86的拷贝数。
1.5 标准曲线建立
选取7个稀释度的标准品,进行SYBR Green Ⅰ荧光定量PCR,建立标准曲线。荧光定量PCR反应体系为:10μL 2×SG Fast qPCR Master Mix,2μL DNF Buffer,0.4μL10mM上游引物,0.4μL 10mM下游引物,5.2μL ddH2O,2μL模板 DNA。反应程序为:95℃ 3min;95℃ 5s,退火温度30s,72℃ 10s,共40个循环。在每个循环的最后一步收集荧光信号计算Ct值,根据Ct值及其对应的拷贝数的对数做标准曲线。
1.6 特异性试验
用荧光定量PCR仪对每次试验的荧光定量PCR产物作熔解曲线,观察熔解曲线是否为单一的特异峰,若曲线为单一的特异峰则表明该方法特异性良好。熔解曲线设置为:初始温度60℃,终点温度95℃,每步温度变量1℃,平衡时间15s。
1.7 重复性试验
从已经制备好的标准品中任意选取3个梯度,每个浓度设置3个重复进行组内重复性试验。间隔1d以同样的方法再重复一次试验,共重复3次,作为组间重复性试验。计算变异系数,分析离散程度,评价该方法的稳定性。若变异系数小于5%[11],则证明所建立的荧光定量PCR方法稳定性良好。
1.8 敏感性试验
选取浓度为101~104copies/μL的标准品进行SYBR GreenⅠ荧光定量PCR,判断其敏感性。如果所检测样品在40个循环内的Ct值>0,则判定为阳性[12]。
2 结果
2.1 标准品制备
2.1.1 标准品构建及鉴定结果
根据试验设计可知,经RT-PCR扩增得到的CD80大小应为114bp,CD86大小应为112bp。试验结果显示,经RT-PCR扩增、琼脂糖凝胶电泳后,在凝胶成像系统下看到的条带如图1,与预期条带一致。阳性重组质粒测序所得序列与参考序列比较,结果显示同源性为100%,所得片段为目的片段。
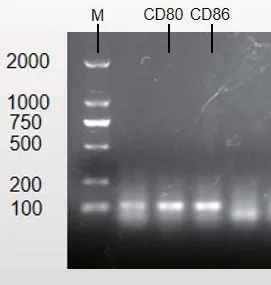
图1 CD80、CD86 PCR产物琼脂糖凝胶电泳结果
2.1.2 CD80、CD86标准品浓度、纯度及拷贝数
测定CD80、CD86的浓度、纯度,选用1.8<A260/A280<2.0的CD80、CD86进行10倍倍比稀释,将稀释后的标准品保存于-20℃备用。本试验中最后选用的CD80的OD260=0.339,A260/A280=1.88;CD86的OD260=0.321,A260/A280=1.82。根据拷贝数计算公式计算拷贝数,得CD80的初始拷贝数为1.379×1020copies/μL,CD86初始拷贝数为1.329×1020copies/μL。
2.2 CD80、CD86标准曲线
选取拷贝数为1012~1018copies/μL的标准品进行SYBR Green Ⅰ荧光定量PCR,得到CD80、CD86的荧光定量PCR扩增曲线(见图2),根据得到的Ct值及其对应的拷贝数的对数建立标准曲线(见图3)。结果显示见表2。

表2 CD80、CD86标准曲线数据结果
由表2可知,试验所得的相关系数均大于0.984,表明所建立的标准曲线线性良好。CD80的标准曲线线性方程为y=-3.14x+64.66;CD86的标准曲线线性方程为y=-2.96x+61.13(y表示Ct值,x表示样品浓度对数)。

图2 CD80、CD86荧光定量PCR扩增曲线
2.3 特异性试验结果
CD80、CD86的特异性试验结果如图4所示,熔解曲线显示为单一的特异峰,CD80的Tm值在80.4~80.8℃范围内,CD86的Tm值在80.2~80.9℃范围内,表明建立的荧光定量PCR方法特异性良好。

图4 CD80、CD86熔解曲线
2.4 重复性试验结果
选拷贝数为1016~1018copies/μL的3个梯度的标准品,用建立的荧光定量PCR方法进行组间及组内重复性试验,计算其变异系数。结果显示(见表3、表4)无论是CD80还是CD86,它们的所有重复性试验的变异系数均在4.71%以内,表示建立的荧光定量PCR方法稳定性良好。
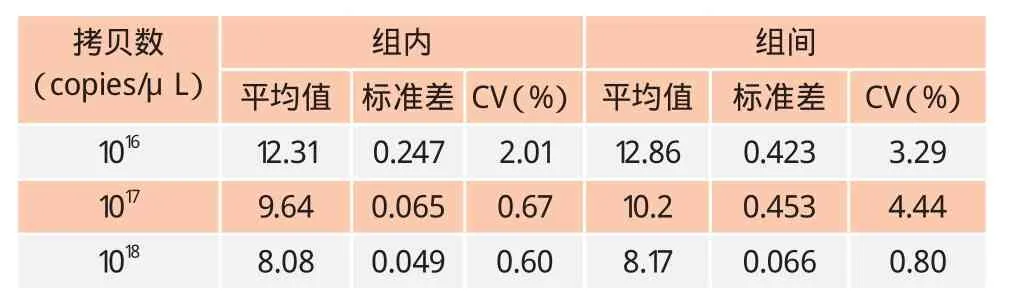
表3 CD80重复性试验

表4 CD86重复性试验
2.5 敏感性试验结果
选拷贝数为101~104copies/μL的4个梯度的标准品进行荧光定量PCR,检测所建立的方法的敏感性。试验结果如图5。结果显示在浓度为10copies/μL时,CD80、CD86荧光定量PCR均有扩增曲线,且在40个循环内的Ct值>0,故所建立的荧光定量PCR方法检出下限为10copies/μL,敏感性较高。

图5 CD80、CD86敏感性试验
3 讨论
CD80、CD86是刺激T细胞活化的一对共刺激分子,位于抗原提呈细胞表面,是B7家族的主要成员。CD80、CD86通过与T细胞表面的受体CD28结合来传递信息刺激T细胞活化,同时它们也可以与T细胞表面的抑制性受体CTLA-4结合从而抑制T细胞过度扩增。当有限的CD80、CD86表达时,因为CD80、CD86对CTLA-4的亲和力更高,故CD80、CD86主要与CTLA-4结合,抑制T细胞的进一步活化。而当大量的CD80、CD86表达时,因为CTLA-4的表达水平有限,CD28与CD80、CD86的结合逐渐变为主要趋势,从而进一步促进T细胞的活化增殖[13]。所以可以通过研究CD80、CD86的表达量来了解免疫过程[14]。故本研究建立了一种检测CD80、CD86的荧光定量PCR方法,为抗病毒相关研究奠定基础。
实时荧光定量PCR是目前确定样品中核酸拷贝数最敏感和最准确的方法,与传统的免疫学方法相比,荧光定量PCR不仅更加准确、快速,而且可以对被检测物质进行定量检测,拥有其他方法不具备的优势,故可借助此方法研究CD80、CD86表达量的变化。
在本次试验中采用的是SYBR GreenⅠ荧光定量PCR。为减少干扰因素的影响,在荧光定量PCR后进行熔解曲线的绘制,通过熔解曲线来分析所建立的方法的特异性。当熔解曲线只有一个特异峰时表明所建立方法特异性良好,无引物二聚体及非特异性扩增产物。试验结果显示CD80、CD86的熔解曲线均只有一个特异峰,表明所建立的荧光定量PCR方法特异性良好,无引物二聚体及非特异性扩增产物的产生。
为了验证所建立的方法的稳定性,保证方法的可重复性,对所建立的荧光定量PCR方法进行组内、组间重复性试验,计算、分析其变异系数,当变异系数小于5%时表明建立的方法稳定性好,可重复性高。本次试验结果显示CD80、CD86荧光定量PCR的所有重复性试验的变异系数均在4.7%以内,所以建立的SYBR GreenⅠ荧光定量PCR方法稳定性良好。
荧光定量PCR技术是目前检测样品中核酸拷贝数最敏感的方法,为检测本试验所建立的荧光定量PCR方法的敏感性,取拷贝数为101~104copies/μL的4个梯度的标准品进行荧光定量PCR,如果所检测标准品在40个循环内的Ct值>0,则认为所建立的荧光定量PCR方法在该拷贝数时仍能检测出目标因子。结果显示在浓度为10copies/μL时荧光定量PCR仍有扩增曲线,且在40个循环内的Ct值>0,故所建立的荧光定量PCR方法检出下限为10copies/μL,敏感性较高。
本次试验所建立的SYBR Green Ⅰ荧光定量PCR方法特异性、稳定性良好,敏感度较高,为抗病毒研究提供了技术平台。

