人巨细胞病毒IE1蛋白、WD重复蛋白5在高级别胶质瘤中的表达及意义
邱勇 周军格 陈俊瑜

【摘要】目的 探讨人巨细胞病毒IE1蛋白(HCMV-IE1)及WD重复蛋白5(WDR5)在高级别胶质瘤中的表达及意义。方法 采用免疫组织化学(免疫组化)方法检测HCMV-IE1和WDR5在60份高级别胶质瘤组织及20份正常脑组织中的表达,分析HCMV感染与WDR5的相關性及两者对胶质瘤预后的影响。结果 53 份(88.3%)高级别胶质瘤组织中的HCMV-IE1呈阳性表达,20份正常脑组织中均无HCMV-IE1表达(P < 0.001);HCMV-IE1表达程度低者总生存率优于表达程度高者(P = 0.037)。49份(81.6%)高级别胶质瘤组织中WDR5表达阳性,11份(5.5%)正常脑组织中WDR5表达阳性(P = 0.009)。在60份高级别胶质瘤组织中,HCMV-IE1与WDR5同时高表达有27例(45.0%),同时低表达有14例(23.3%),HCMV-IE1表达与WDR5表达呈正相关(r = 0.336,P = 0.009)。结论 HCMV-IE1与高级别胶质瘤发生发展相关,是判断高级别胶质瘤预后的指标,其机制可能与HCMV-IE1和WDR5呈正相关有关联。
【关键词】人巨细胞病毒;高级别胶质瘤;WD重复蛋白5
【Abstract】Objective To investigate the expression and significance of human cytomegalovirus (HCMV)-IE1 protein and WDR5 protein in high grade glioma (HGG). Methods The expression of HCMV IE1 and WD repeat-containing protein (WDR5) proteins was detected by immunohistochemistry in 60 HGG tissues and 20 normal brain tissues. The correlation between HCMV infection and WDR5 protein and their influence on glioma prognoses were analyzed. Results HCMV-IE1 protein was positively expressed in 53 HGG tissues (88.3%) while not expressed in 20 normal brain tissues (P < 0.001). The overall survival rate of HGG patients with low expression level of HCMV-IE1 was better than those with high expression level of HCMV-IE1 (P = 0.037). WDR5 protein expression was positive in 49 (81.6%) HGG tissues and in 11 (5.5%) normal brain tissues (P = 0.009). Among 60 HGG tissues, 27 cases (45.0%) had simultaneously high expression HCMV-IE1 protein and WDR5 protein, and 14 cases (23.3%) had simultaneously low expression. The expression of HCMV-IE1 protein was positively correlated with that of WDR5 protein (r = 0.336, P = 0.009). Conclusions HCMV-IE1 protein is associated with the initiation and development of HGG and is an indicator of the prognosis of HGG.The mechanism may be associated with the positive correlation between HCMV-IE1 and WDR5.
【Key words】Human cytomegalovirus;High grade glioma;WD repeat-containing protein
胶质瘤是最常见的原发性神经上皮细胞恶性肿瘤,WHO依据肿瘤的恶性程度将胶质瘤分为Ⅰ ~ Ⅳ级,其中低级别胶质瘤(LGG)包含Ⅰ、Ⅱ级,高级别胶质瘤(HGG)包含Ⅲ、Ⅳ级[1]。近年来随着神经外科显微手术技术及手术器械的发展,胶质瘤的手术治疗效果取得改善,但胶质瘤患者的预后未能获得根本的改善,尤其是HGG,肿瘤细胞呈侵袭性生长,术后肿瘤短期内就复发。手术辅以同步放射治疗或化学治疗的标准化方案是目前脑胶质瘤的主要治疗手段,由于HGG本身发生发展的分子机制,其容易对放射治疗及化学治疗发生抵抗,虽然各种新治疗方法不断涌现,但治疗效果仍较差[2]。目前肿瘤的靶向及免疫治疗等个体化精准治疗成为新的热点,而我们对于神经胶质瘤的病因学及遗传表征知之甚少。目前认为胶质瘤是一种“冷肿瘤”,肿瘤突变负荷较低,对传统放射治疗、化学治疗以及免疫治疗等方法响应有限,因而迫切需要研究胶质瘤可利用的新的靶点和遗传学表征,为胶质瘤的治疗提供新的思路。
最近的研究表明,病毒感染可能与肿瘤的发生发展相关[3]。人巨细胞病毒(HCMV)属于疱疹病毒家族,人巨细胞病毒基因组编码有200多种蛋白质,包括HCMV IE1蛋白(HCMV-IE1)和PP65抗原等。它们的表达发生在感染后的一系列阶段。有研究表明HCMV感染及病毒蛋白与多种恶性肿瘤相关[4]。同时已陆续有研究报道胶质瘤中存在HCMV抗原的表达甚至完整病毒,而其邻近正常脑组织中则检测不到,特别是在胶质母细胞瘤样本中,胶质瘤中存在蛋白的阳性率高达93% ~ 100%,甚至有报道称术后抗病毒治疗能明显延长患者生存期,但其具体机制尚未清楚。在我国,健康人群中HCMV的感染率(90%左右)高于欧美国家(60% ~ 70%)。WD重复蛋白5(WDR5)是组蛋白甲基转移酶复合物中的核心组分之一,参与介导H3K4基因转录激活过程,研究显示WDR5在肿瘤发生发展过程中发挥着重要的作用[5]。
本研究采用免疫组织化学(免疫组化)方法检测了HCMV-IE1及WDR5在HGG组织中的表达水平,并进一步分析了两种蛋白的相关性及其对胶质瘤预后的影响。
材料与方法
一、组织标本
60份HGG组织均为武汉脑科医院2013年至2018年神经外科手术切除的原发肿瘤标本,20份正常脑组织为该院同时期的脑外伤内减压手术患者标本。60份HGG组织来自男性患者33例、女性患者27例,年龄(48.2±16.2)歲;标本均经福尔马林固定、石蜡包埋。按照2016年WHO中枢神经系统肿瘤分类和分级标准进行确诊,其中WHO Ⅲ级44例,包括间变型星形细胞瘤35例、间变型少突胶质细胞瘤9例;WHO Ⅳ级16例,均为胶质母细胞瘤。所有患者术后均持续随访,最长随访时间5年。本研究经武汉脑科医院伦理委员会批准。
二、免疫组化方法
采用聚合物-过氧化物酶免疫组化两步法。组织蜡块连续切片,厚5 μm,65℃烤片2 h后备用。二甲苯常规脱蜡,浸入乙二胺四乙酸缓冲液中高热修复。切片用3% 过氧化氢于室温下孵育15 min,以封闭内源性过氧化物酶活性。非免疫正常山羊血清100 μl封闭内源性过氧化物酶活性,室温孵育60 min。滴加一抗HCMV-IE1(英国Abcam公司)稀释度1∶100及WDR5(上海生工生物公司)稀释度1∶100。于4℃冰箱孵育过夜,再用Biotin标记的山羊抗鼠二抗工作液室温孵育30 min。用辣根过氧化物酶标记链霉亲和素,室温孵育30 min。用二氨基联苯胺显色,苏木素复染,常规脱水、透明、中性树胶封片。以HCMV-IE1、WDR5表达阳性的结肠癌组织切片作为阳性对照,磷酸盐缓冲液代替一抗作为阴性对照。
三、建立免疫组化分级和强度量表,
免疫染色切片由2名独立的组织病理学专家进行评估,所有的免疫组化染色均给予一个等级(基于阳性百分比)。在高倍镜下从每例标本中肿瘤细胞免疫反应较强的区域随机选取5个视野,共计数1000个细胞,根据阳性细胞的估计百分比确定4个等级:(-)<5%;(+)≥5% ~ 30%;(++)≥30% ~ 50%;(+++)≥50%。依据阳性表达的等级,我们将脑肿瘤标本分为2组,低表达组(-或+)和高表达组(++或+++)。
四、统计学处理
采用SPSS 20.0进行统计学分析, HCMV-IE1及WDR5表达水平在HGG与正常脑组织之间的差异采用Wilcoxon秩和检验。进行HCMV-IE1蛋白与WDR5表达相关性关联分析。采用GraphPad Prism 7.0软件进行生存分析,生存曲线的绘制采用Kaplan-Meier法,生存曲线比较采用log-rank检验。P < 0.05 为差异有统计学意义。
结果
一、HCMV-IE1、WDR5在胶质瘤中的表达
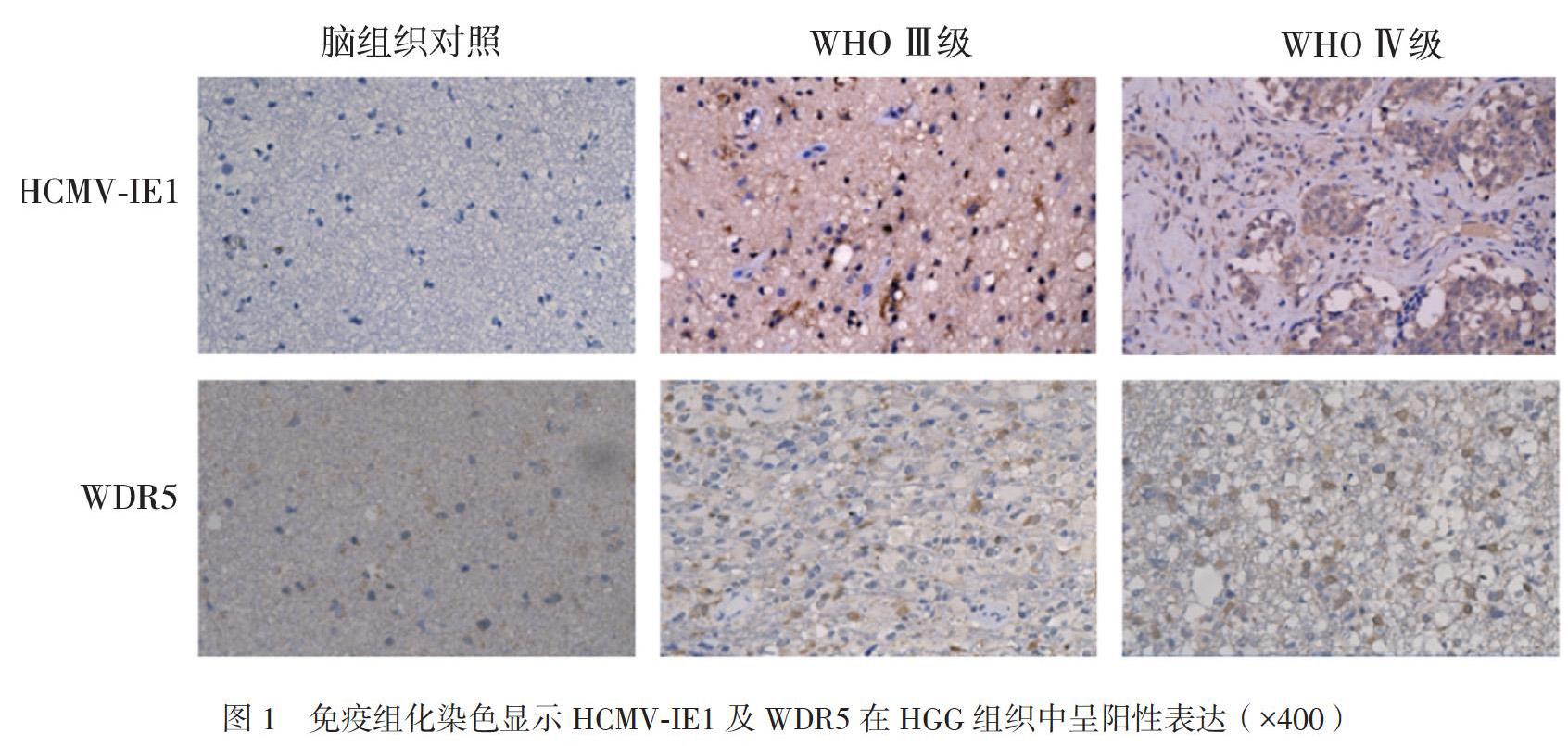
在60份HGG组织中有53份HCMV-IE1呈阳性表达,阳性表达率88.3%。其中16份(+)、18份(++)、19份(+++),HCMV-IE1位于肿瘤细胞的胞核和胞浆。在60份胶质瘤组织中,高表达组有37份(61.7%)、低表达组有23份(38.3%)。HCMV-IE1在20份正常脑组织中均无表达。HGG组织中HCMV-IE1表达水平高于正常脑组织(Z = -6.110,P < 0.001),见图1。
在60份HGG组织中有49份WDR5呈阳性表达,阳性表达率为81.6%。其中13份(+)、19份(++)、17份(+++)。WDR5位于肿瘤细胞的胞核。在60份胶质瘤组织中,高表达组有36份(60.0%)、低表达组有24份(40.0%)。在20份脑组织中11份WDR5呈阳性表达,阳性表达率55%,其中高表达组6份(30.0%)、低表达组14份(70.0%),HGG组织中WDR5表达水平高于正常脑组织(Z = -2.569,P = 0.009),见图1。
二、HCMV-IE1与WDR5的相关性
在60份HGG中,HCMV-IE1与WDR5同时高表达有27份(45.0%),同时低表达有14份(23.3%),HCMV-IE1表达与WDR5表达相关(r = 0.318,P = 0.009)。
三、HCMV-IE1表达与HGG预后的关系
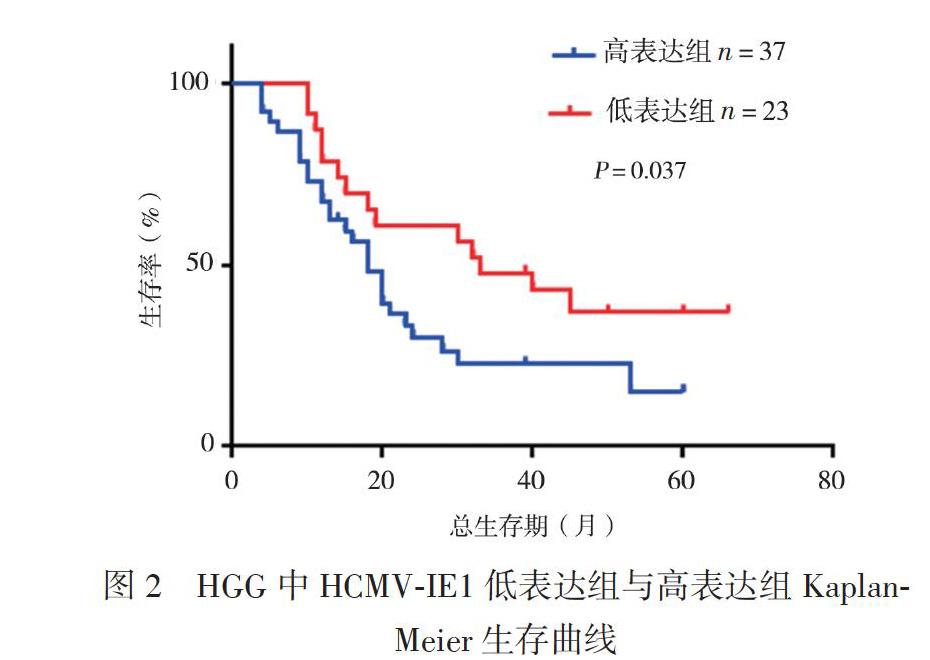
HCMV-IE1低表达组23例的中位生存期为33个月,高表达组37例的中位生存期为18个月,低表达组患者总生存率优于高表达组(P = 0.037),见图2。
讨论
HCMV是人类疱疹病毒,其基因组大小约235 kb。病毒基因表达呈时序性,分为立即早期、早期和晚期。对于免疫力正常的健康人群,HCMV感染常无明显临床症状,但在有免疫缺陷或免疫力低下的人群,HCMV感染常导致严重临床后果,表现为病毒性肺炎、先天性脑畸形、脑炎等。依据不同国家和人种,HCMV在健康人群中的感染率可达70 % ~ 100 %,本课题组调查了本地区的303名健康人HCMV的感染情况,结果显示感染阳性率为93.7%,进一步证实HCMV感染在我国健康人群中高发[6]。
目前的研究显示,病毒感染可以通过干预肿瘤微环境来影响肿瘤的进展,从而影响肿瘤细胞的生物学行为。现在研究表明HCMV与多种恶性肿瘤相关,如消化系统肿瘤、肺恶性肿瘤及乳腺癌等。HCMV-IE1通过激活环氧酶-2(Cox-2)诱导炎症介质的合成,激活血管内皮生长因子(VEGF)的表达,促进肿瘤血管生成和肿瘤发生发展[7]。但HCMV与胶质瘤的具体关系及机制不明,存在巨大争议。有学者认为HCMV与胶质瘤的发生有关,是一个起始因素,但与胶质瘤的病理级别及预后无关[8-9]。而其他学者的观点与之截然相反,认为HCMV-IE1在胶质瘤组织中的表达水平明显高于对照脑组织,其表达程度与胶质瘤病理级别有相关性[10]。同时HCMV与胶质瘤的预后明显相关[11]。但有学者提出异议,认为上述实验研究未能将患者肿瘤病理级别对胶质瘤预后的影响因素进行剔除。本课题组发现HCMV感染与HGG预后的国内相关研究甚少,故进行了本项研究。
WDR5是WD-40蛋白家族的成员之一,具有高度的保守性。WDR5作为MLL复合体的重要成员,能引起组蛋白H3K4的甲基化,从而参与多项细胞的生命活动,包括调节细胞自我编程以及更新,诱导细胞分化、信号转导、mRNA处理、基因调控、囊泡转运和细胞周期的调节[12]。最近的研究表明,WDR5在多种癌症的发生发展过程中起着重要作用,Xu等[13]在甲状腺肿瘤中发现WDR5的过表达促进了肿瘤细胞的增殖和迁移,并且与患者生存率密切相关。Chen等[14]的研究表明,WDR5蛋白在膀胱癌中也呈高表達状态,可以促进肿瘤细胞增殖及对化学治疗的耐药性,进一步研究表明WDR5是通过对细胞周期蛋白的调节进而激活其转录从而实现其功能的。WDR5在胶质瘤组织中的作用尚无报道。
本课题组收集60份HGG标本并对患者持续随访,结果显示HCMV感染仅在胶质瘤中存在,不存在于正常脑组织中,提示HCMV感染与HG的发生发展存在一定联系。同时HCMV-IE1低表达组患者总生存率高于高表达组患者,本组患者均为HGG患者,剔除了病理级别因素对胶质瘤预后的影响,这项结果提示HCMV-IE1与胶质瘤恶性进展相关,可以作为判断HGG预后的指标。本研究还显示,HGG组织中WDR5表达高于正常脑组织,我们认为WDR5与胶质瘤的发生发展也密切相关。目前有研究表明HCMV感染时,其通过HCMV-IE1上调WDR5的表达,进而导致细胞增殖分化,同时WDR5促进病毒的复制[15]。本研究显示HCMV-IE1表达与WDR5表达呈正相关,结合前述研究,我们认为HCMV可能通过调节WDR5,最终激活胶质瘤相关靶基因MMP-9、c-myc、 Cox-2等的转录, 从而参与肿瘤发生发展,同时影响胶质瘤对化学治疗药物的敏感性[5, 14, 16]。
胶质瘤患者经标准规范治疗后预后仍极差,特别是HGG。因而针对HGG的靶向治疗和免疫治疗等个体化精准治疗已成为研究的热点。但即使应用新的靶向治疗及肿瘤电场治疗等方法,治疗效果仍然差强人意,患者预后极差。所以利用HCMV抗原作为胶质瘤治疗的新靶点可为HGG患者带来新的希望。临床实验研究显示,常规综合治疗辅助抗病毒药物可能是一种新的治疗胶质瘤方案[17]。HCMV抗原也可以作为免疫治疗的有效靶点[18]。多项针对HCMV抗原设计的免疫治疗临床试验例如自体巨细胞病毒特异性T淋巴细胞,靶向HCMV的CARs和多肽类疫苗等,均明显改善患者的无进展生存期及总生存期[19]。另外,针对WDR5的药物可通过阻断MLL-WDR5蛋白复合体的形成,干扰癌基因的转录,从而抑制肿瘤的生长[20]。
综上所述,HCMV感染及其蛋白HCMV-IE1通过调节WDR5的表达,影响胶质瘤的恶性进展,这不是一种伴随的偶然现象,HCMV-IE1可以作为判断HGG预后的生物学标志物,同时也为HGG患者的治疗提供新的靶点。
参 考 文 献
[1] Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D,Cavenee WK, Ohgaki H, Wiestler OD, Kleihues P, Ellison DW. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuro-pathol,2016,131:803-820.
[2] Brown TJ, Brennan MC, Li M, Church EW, Brandmeir NJ, Rakszawski KL,Patel A, Rizk EB, Suki D, Sawaya R, Glantz M. Association of the extent of resection with survival in glioblastoma:a systematic review and meta-analysis. JAMA Oncol,2016,2:1460-1469.
[3] Lawler SE. Cytomegalovirus and glioblastoma; controversies and opportunities. J Neurooncol,2015,123:465-471.
[4] Bishop RK, Valle Oseguera CA, Spencer JV. Human Cyto-megalovirus interleukin-10 promotes proliferation and migration of MCF-7 breast cancer cells. Cancer Cell Microenviron, 2015,2(1): e678.
[5] Thomas LR, Wang Q, Grieb BC, Phan J, Foshage AM, Sun Q, Olejniczak ET, Clark T, Dey S, Lorey S, Alicie B, Howard GC, Cawthon B, Ess KC, Eischen CM, Zhao Z, Fesik SW, Tansey WP. Interaction with WDR5 promotes target gene recognition and tumorigenesis by MYC. Mol Cell,2015,58:440-452.
[6] Wen L, Qiu Y, Cheng S, Jiang X, Ma YP, Fang W, Wang W, Cui J, Ruan Q, Zhao F, Hu F, Luo MH. Serologic and viral genome prevalence of HSV, EBV, and HCMV among healthy adults in Wuhan,China. J Med Virol,2018 ,90(3):571-581.
[7] Soroceanu L, Matlaf L, Khan S, Akhavan A, Singer E, Bezrookove V, Decker S, Ghanny S, Hadaczek P, Bengtsson H, Ohlfest J, Luciani-Torres MG, Harkins L, Perry A, Guo H,Soteropoulos P, Cobbs CS. Cytomegalovirus immediate-early proteins promote stemness properties in glioblastoma. Cancer Res, 2015,75:3065-3076.
[8] Herbein G. The human cytomegalovirus, from oncomodulation to oncogenesis. Viruses, 2018,10(8):E408.
[9] Stangherlin LM, Castro FL, Medeiros RS, Guerra JM, Kimura LM, Shirata NK, Nonogaki S, Dos Santos CJ, Carlan Silva MC. Human cytomegalovirus DNA quantification and gene expression in gliomas of different grades. PLoS One,2016,11:e0159604.
[10] 李鹏起,闫志丰,董秋峰,杨鑫, 陈晓燕. 人巨细胞病毒IE1-72 蛋白在胶质瘤中的表达及意义.现代生物医学进展,2017,17(18):3447-3450.
[11] Shamran HA, Kadhim HS, Hussain AR, Kareem A, Taub DD, Price RL, Nagarkatti M, Nagarkatti PS, Singh UP. Detection of human cytomegalovirus in different histopathological types of glioma in iraqi patients. Biomed Res Int,2015,2015: 642652.
[12] Lu K, Tao H, Si X, Chen Q. The histone H3 lysine 4 presenter WDR5 as an oncogenic protein and novel epigenetic target in cancer. Front Oncol,2018,8:502.
[13] Xu W, Wang L, An Y, Ye J. Expression of WD repeat domain 5 (WDR5) is associated with progression and reduced prognosis in papillary thyroid carcinoma. Med Sci Monit, 2019, 25:3762-3770.
[14] Chen X, Xie W, Gu P, Cai Q, Wang B, Xie Y, Dong W, He W, Zhong G, Lin T, Huang J. Upregulated WDR5 promotes proliferation, self-renewal and chemoresistance in bladder cancer via mediating H3K4 trimethylation. Sci Rep,2015,5:8293.
[15] Yang B, Liu XJ, Yao Y, Jiang X, Wang XZ, Yang H, Sun JY, Miao Y, Wang W, Huang ZL, Wang Y, Tang Q, Rayner S, Britt WJ, McVoy MA, Luo MH, Zhao F. WDR5 facilitates human cytomegalovirus replication by promoting capsid nuclear egress. J Virol,2018,92(9):207-218.
[16] Gu P, Chen X, Xie R, Han J, Xie W, Wang B, Dong W, Chen C, Yang M, Jiang J, Chen Z, Huang J, Lin T. lncRNA HOXD-AS1 regulates proliferation and chemo-resistance of castration-resistant prostate cancer via recruiting WDR5. Mol Ther,2017,25(8):1959-1973.
[17] Adnan Ali SM, Mirza Y, Ahmad Z, Zahid N, Enam SA. Human papillomavirus and human cytomegalovirus infection and association with prognosis in patients with primary glioblastoma in pakistan. World Neurosurg,2019,121:e931-e939.
[18] Mitchell DA, Batich KA, Gunn MD, Huang MN, Sanchez-Perez L, Nair SK, Congdon KL, Reap EA, Archer GE, Desjardins A, Friedman AH, Friedman HS, Herndon JE 2nd, Coan A, McLendon RE, Reardon DA, Vredenburgh JJ, Bigner DD, Sampson JH. Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients. Nature,2015,519(7543):366-369.
[19] Rizzo D, Ruggiero A, Martini M, Rizzo V, Maurizi P, Riccardi R. Molecular biology in pediatric high-grade glioma: impact on prognosis and treatment. Biomed Res Int,2015,2015:215135.
[20] Aho ER, Weissmiller AM, Fesik SW, Tansey WP. Targeting WDR5: a WINning anti-cancer strategy? Epigenet Insights,2019,12:2516865719865282.
(收稿日期:2020-03-26)
(本文編辑:洪悦民)

