过氧化钠与水反应机理的探究实验
陈头平
摘 要:过氧化钠与水反应后的溶液中滴入酚酞溶液,振荡后出现红色褪色的现象。为探究该反应的褪色的原因而进行实验设计、实验验证,进而探究出过氧化钠与水反应的机理。
关键词:过氧化钠;酚酞溶液;褪色;反应机理;过氧化氢
问题提出:在学习“钠的重要化合物”(人教版)时,P55实验3-5:把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞溶液,有什么现象发生?
实验中向反应后的溶液中滴入酚酞溶液,观察到的溶液先变红振荡后又出现褪色的现象。酚酞溶液变红后为何会褪色呢?
猜想:1.实验中Na2O2过量,Na2O2的强氧化性将红色漂白;2.过氧化钠与水反应生成氢氧化钠和氧气,可能氢氧化钠的浓度对酚酞变色的影响,也可能产生的氧气使酚酞变色;3.过氧化钠与水反应不是一步完成的,中间产物有漂白性。
理论探讨:
查阅《化学》必修一教师教学用书(人教版):Na2O2易潮解,与水或稀酸作用时生成過氧化氢并放热,过氧化氢不稳定,立即分解放出氧气:先与水发生复分解反应,生成过氧化氢:Na2O2+2H2O===2NaOH+H2O2,过氧化氢不稳定分解2H2O2===2H2O+O2↑。查阅高等无机化学教程,也有类似的解释。
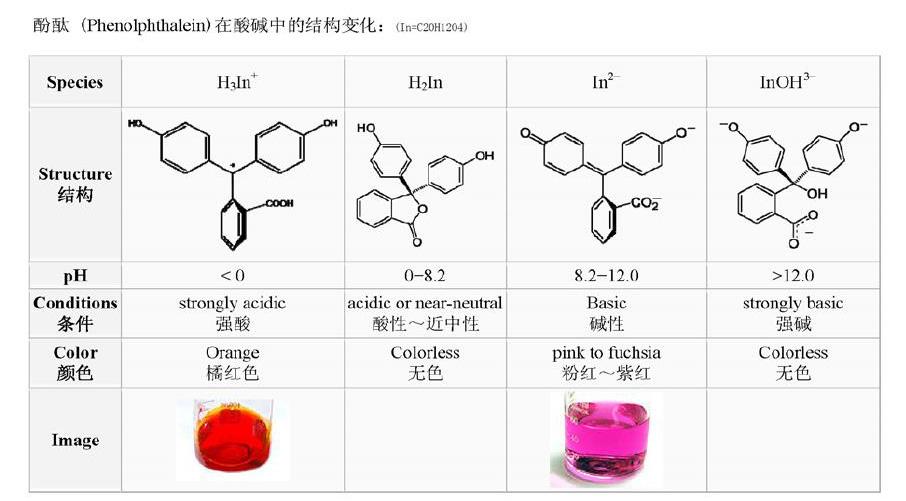
酚酞溶液在不同酸碱环境下的结构:
实验一:
实验目的:酚酞溶液在不同酸碱环境下变色实验对照。
实验药品:5mol/L H2SO4的溶液、0.05 mol/L H2SO4的溶液、0.001 mol/LNaOH的溶液、1 mol/LNaOH的溶液、酚酞溶液。
实验仪器:pH试纸(或pH计)、比色卡、玻璃棒。
实验步骤:1.分别测出四种溶液的pH。
2.分别取少量四种溶液滴入酚酞溶液观察现象。
实验现象:5mol/L H2SO4的溶液呈橘红色,0.05 mol/L H2SO4的溶液呈无色,0.001 mol/LNaOH的溶液呈紫红色,1 mol/LNaOH的溶液呈无色。
实验结论:溶液的碱性过强(pH>12)滴入酚酞溶液也呈现无色现象。
实验二:
实验目的:探究O2是否能使显红色的酚酞溶液褪色。
实验药品:H2O2、酚酞溶液、MnO2。
实验仪器:试管、试管架、带有导气管的单孔胶塞、胶头滴管。
实验步骤:1.将少量NaOH固体投入蒸馏水中,制成低浓度的NaOH溶液,再将酚酞试剂滴入NaOH溶液中使其变红。
2.向一只试管中加入H2O2,再向其中加入MnO2,并将制得的氧气通入红色NaOH溶液中,并观察现象。
实验现象:滴有酚酞显红色的NaOH溶液无褪色现象。
实验结论:O2不能使滴有酚酞显红色的NaOH溶液褪色。
实验三:
实验目的:探究H2O2是否能是红色酚酞褪色。
实验药品:H2O2(浓、稀)、酚酞溶液、NaOH固体。
实验器材:试管、胶头滴管、药匙。
实验步骤:
1.将少量NaOH固体投入蒸馏水中,制成低浓度的NaOH溶液,再将酚酞试剂滴入NaOH溶液中使其变红。
2.将红色NaOH溶液分别倒入两只试管中。
3.分别向两只试管中加入浓、稀H2O2,并观察现象。
实验现象:加入稀H2O2的试管中无明显现象,而加入浓H2O2的试管,不久红色褪去。
实验结论:浓度高的H2O2能使滴有酚酞显红色的NaOH溶液褪色。
实验四:
实验目的:探究Na2O2的用量对实验的影响。
实验药品:Na2O2粉末、水、酚酞溶液。
实验仪器:试管、药匙。
实验步骤:
1.取3支试管均装10ml水。
2.分别向3支试管中加①1/3药匙的Na2O2、②1/2药匙的Na2O2、③1药匙的Na2O2。
3.用带火星的木条放在试管口。
4.向反应后的溶液中滴入酚酞溶液并振荡。
实验现象:①号试管带火星的木条变明亮,酚酞溶液红色褪色时较长。③号试管带火星的木条复燃,酚酞溶液的红色迅速褪去。
实验结论:Na2O2的用量越多,酚酞溶液红色褪去得越快。
实验五:
实验目的:证明H2O2的存在与作用。
实验药品:Na2O2粉末、MnO2、冰水。
实验仪器:药匙、试管、烧杯。
实验步骤:
1.用药匙将Na2O2加入试管中,再加入少量冰水,并将试管置于装有冰的烧杯中反应。
2.用带火星的木条放在试管口检验(现象不明显)。
3.取上层清液分别装于两支试管中,向其中一支加入MnO2,用带火星的木条放在试管口检验,待完全反应后,再次取上层清液于另一试管中并向其中滴入酚酞溶液并振荡。
4.向另一试管中直接滴入酚酞溶液。
实验现象:当向溶液中加入MnO2后,有气泡产生,待反应完全后,取上层清液于另一试管中,向试管中的液体内加入水稀释后,再加入酚酞试剂,可看到溶液变为红色。
实验结论:因为加入MnO2后,有大量气体生成,则证明溶液中存在过氧化氢,当H2O2完全分解后,将所得溶液稀释后加入酚酞,溶液变为红色振荡后不褪色,即可说明溶液红色褪色的确是溶液中过氧化氢的作用。
探究结论:
过氧化钠与水反应后的溶液,加入酚酞后,溶液先变红后褪色,其中溶液褪色是因为反应过程中产生了过氧化氢,主要是过氧化氢的作用使溶液褪色。当然,由于反应后,溶液中氢氧化钠的浓度较大,所以它也应该起到了一定作用。因此我们认为酚酞褪色是由于过氧化氢的强氧化性和氢氧化钠溶液的pH过高超出酚酞变色范围共同作用所致。通过实验探究证明,“过氧化钠与水反应的机理”与所查阅资料所相吻合。
★ 基金项目:本文系湖南省教育科学“十二五”规划2015 年度湖南省教育科学研究基地专项课题“‘魅力课堂学习共同体建构的实践与研究”(课题批准号:XJK015BJD031)的阶段性成果

