钛酸锂负极的相分离机制
卢 侠,陈伟鑫
(中山大学材料学院,广州 510006)
锂离子电池自从诞生以来,在便携设备、电动汽车等领域掀起了一场革命,为人类带来巨大的生活便利. 尖晶石钛酸锂(Li4Ti5O12)具有高功率密度、高安全性和高稳定性等优势,是一种理想的锂离子负极材料. 钛酸锂负极材料通过一个相分离过程(Li4Ti5O12/Li7Ti5O12)存储能量,平衡电位高达1.55 V (vs Li/Li+),可以有效遏制锂枝晶的生长,拥有比碳基材料更好的安全性能. 嵌锂前后两相晶格常数基本不变,具有“零应变”特点,避免了电极材料的来回伸缩和结构破坏,带来高度循环可逆性[1-3].
近年来,为了进一步提高钛酸锂的电化学性能,大量研究致力于改善其较差的电子/离子电导,并遏制严重的“胀气”问题,包括纳米化、掺杂、形貌调控、表面修饰、包覆等[4-7]. 尽管如此,现阶段对于Li4Ti5O12本征性质的认识仍不够完善,尤其是两相分离过程中的诸多细节,比如物相结构演变、两相界面、电子传输和Li+扩散等与电化学性能的发挥密切相关,还没有被完全理解. 其次,对气体释放现象背后的关键因素缺乏有效的认识,气体产生与材料的电子/离子传输和表面结构之间的联系也需要进一步确认.
本文从尖晶石钛酸锂的相分离角度出发,结合本研究组多年的研究结果,对其基础性质进行综述. 首先讨论晶体结构及稳定性,在原子尺度上叙述锂化过程的结构演化、界面特征、电荷补偿机理和电子/离子输运特性;然后介绍材料表面弛豫/重构和自发反应及其与纳米材料电化学特性、气体产生等的联系;最后简要提出钠离子嵌入引起的三相分离,期望对于钛酸锂的优化设计及大规模应用提供新的方法和思路.
1 晶体结构
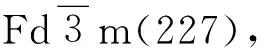
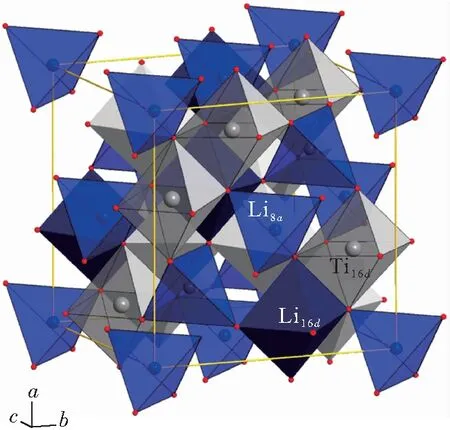
图1 尖晶石Li4Ti5O12的晶格结构[10]
COLBOW等[11]在1989年将Li4Ti5O12应用于锂离子电池,发现它具有理想的充放电平台和良好的循环稳定性. 目前认为,Li4Ti5O12通过一个可逆的两相反应进行储能,当外界的Li嵌入时将优先占据八面体16c位点,同时原先8a位点的Li也迁移到邻近16c位点,Ti的价态发生变化,进行电荷补偿,转化为岩盐结构的Li7Ti5O12,相变后保持相同的结构框架[Ti5Li]16d[O12]32e,晶格常数a=0.835 38 nm[12]. 具体反应方程式为:
[Li3]8aV16c[Ti5Li]16d[O12]32e+3Li++3e-
[V]8a[Li6]16c[Ti5Li]16d[O12]32e
图2为C/20电流下半电池的充放电曲线[3]. 电位窗口为1.0~2.2 V,电压平台约1.55 V,放电比容量接近175 mAh/g,首次循环效率达96%. 电压维持在一个非常平稳的平台上,具有典型的两相反应特征,即Li+在具有稳定化学势的两物相之间进行脱嵌[14].
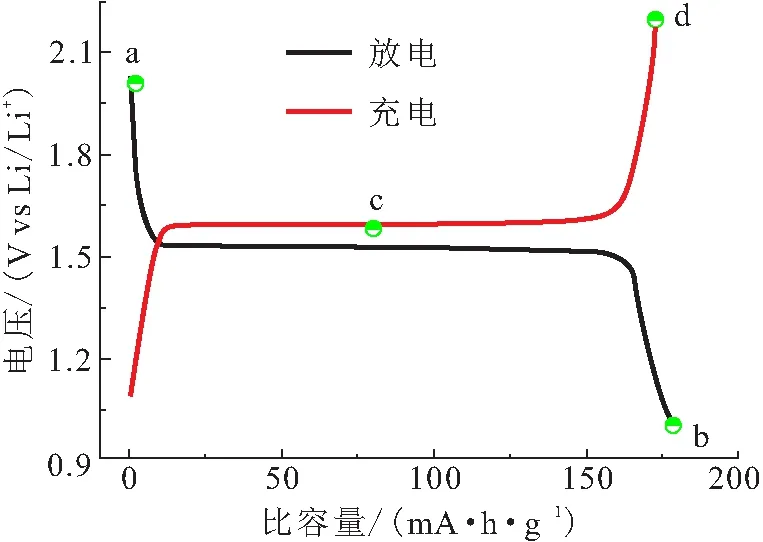
图2 C/20电流下的充放电曲线[3]
基于第一性原理,我们对钛酸锂晶格稳定性进行了研究[3],两相的分离实际上是Li的数量、分布构型和静电斥力之间博弈的结果. 表1为两相中不同活性Li+(Li8a和Li16c)构型的能量. 对于Li4Ti5O12,当所有Li位于8a位点时体系能量最低;一旦某个Li占据16c,由于Li16c与相邻Li8a间强烈的库伦排斥,将自动迁回8a位点;当全部Li都占据16c时,LiO4四配位转换为LiO6八配位,2个八面体间至少存在1个四面体空位,结构不稳定. 对于Li7Ti5O12,新嵌入的Li与原先占据的Li8a之间发生强烈排斥,当所有Li位于16c位点时能量最低,因此充放电过程中呈现出两相分离,两相间的固溶体行为并非热力学基态. 可以预测,如果Li进一步嵌入,可能继续占据其他空位,直到结构崩解. 前不久,LIU等[15]已经通过中子衍射证明,在过放电至0.01 V时,Li能够嵌入到8a和48f位点,形成Li8Ti5O12等相.

表1 Li4Ti5O12/Li7Ti5O12超晶胞中不同锂离子构型的总能量计算值[3]Table 1 The calculated total energy of different Li ion arrangements in Li4Ti5O12/Li7Ti5O12 supercell[3]
2 两相分离机制
2.1 相转变
早期研究中,SCHARNER等[12]利用高角X射线衍射研究了钛酸锂充放电时两相的转换过程. 随后各种表征技术,如中子衍射、拉曼光谱等也被用于探究嵌脱锂过程的物相演化[16-17]. 此外,由富锂相外壳和贫锂相内核构成的核壳模型被提出,并成功地解释了钛酸锂的电化学以及阻抗特征[18-19]. 2012年,我们利用亚埃级分辨率的球差校正扫描透射电镜(STEM)[3],在原子尺度上获取到尖晶石钛酸锂的结构照片,实现了对脱嵌锂过程的直接观测与表征,其研究结果进一步为两相分离机制提供了直观的可视化证据.
STEM有2种常见的成像模式:高角暗场像(HAADF)和环形明场像(ABF). 前者图像衬度与原子序数Z1.7成正比,后者与Z1/3成正比,所以氢、锂等轻元素在HAADF中难以辨认[20]. 对于Li4Ti5O12,沿着[110]方向可以观测到分离良好的原子栏,非常适合研究嵌脱锂机制. 图3A的晶格模型中,以8个Ti原子栏组成的平行四边形格子为基本单元,可以清晰分辨出Ti16d(位点1)、O32e(位点2)、Li8a(位点3)以及2个Li8a中心的16c空位(位点4)[3,10].

图3 Li4Ti5O12晶格沿[110]轴方向的原子尺度表征[3]
图3B、3C提供了Li4Ti5O12沿着[110]方向的HAADF和ABF照片[3]. HAADF图片呈现出清晰规整的格子图案,可以直观辨别出Ti16d和O32e原子栏,没有出现Li的衬度,Ti16d栏有2种不同的衬度,主要是由于2种原子栏中Ti的含量不同[1];ABF图中可以观测到平行四边形格子中心两侧的Li8a,A点至B点的衬度线扫描(图3D)对原子排列提供了更加直观的描述,由于晶格热振动等因素,2个Li8a的位置有些波动. 通过表征不同锂化状态下钛酸锂电极的ABF图和衬度扫描图[3]表明,放电至1.0 V时,平行四边形中心仅显示出1个Li的衬度,且强度明显提高,原有2个Li8a消失,该观测结果表明Li全部占据在16c位点,Li7Ti5O12单晶相产生. 充电到85 mA/g时,ABF图中显示体系存在2个明显不同的物相:仅出现Li16c的衬度,属于Li7Ti5O12相;只出现2个Li8a的衬度,属于Li4Ti5O12相. 充电到2.2 V时,ABF图像中重新出现Li8a的衬度,体系恢复为Li4Ti5O12单晶相:表明锂化过程是可逆的. 因此,尽管不同充放电状态下体系具有不同的Li含量,但是Li仅单独占据16c位点,形成Li7Ti5O12相;或者单独占据8a位点,形成Li4Ti5O12相.
由于钛酸锂宏观上的“零应变”特性,在实验中确认锂化过程中的纳米结构演化非常困难. 2014年,PANG等[21]通过原位中子粉末衍射仪对2种不同粒径的钛酸锂颗粒进行测试,发现它们在充放电过程中存在相同的体相结构演化,伴随Li的持续嵌入,晶格先发生膨胀,然后逐渐收缩,随后又重新膨胀,并且,晶格常数的变化趋势与Li在晶格结构中特定位点的占据情况相一致,即Li从8a迁移到16c位点.
除了晶格常数的细微变化,我们在2015年基于STEM图像的研究[2]表明,不同荷电状态下,材料中TiO6八面体会发生明显的结构扭曲,表现为Ti—O键的收缩或拉伸,类似于生物的“呼吸”过程.
图4展示了不同充放电下电极材料晶格中平行四边形格子的对角线长度比(dAB/dCD),Li4Ti5O12的初始比值为0.718(状态Ⅱ),该比值在半锂化时下降到0.681(状态Ⅴ),全锂化时重新上升到0.691(状态Ⅵ),进一步过锂化时为0.669(状态Ⅶ),脱锂过程也呈现一种无规律的波动. 这种波动反映了尖晶石晶格适应Li的脱嵌而产生的自调节作用,是体系中多种成分(Li4Ti5O12、Li7Ti5O12、两相界面等)共同参与的结果. 带来的晶格畸变可能有利于引入电子/空穴俘获中心(Ti3+/Ti4+),降低电子跳跃能垒,从而有效促进电荷转移,且基本不会影响Li在晶格中的传导,这是材料表现出优良倍率性能的重要条件.
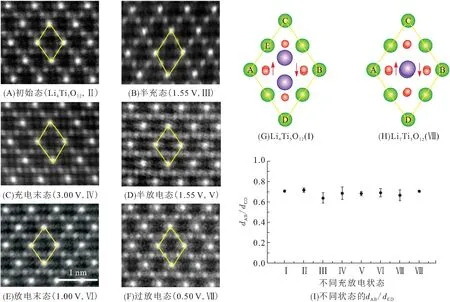
图4 不同充放电状态下Li4Ti5O12沿[110]方向的HAADF图[2]
2017年,WANG等[22]结合理论计算模拟和X射线吸收近边结构(XANES)分析同样验证了充放电过程中TiO6八面体的扭曲,计算得到Ti—O键的平均键长从Li4Ti5O12的0.197 nm转变为Li7Ti5O12的0.202 nm. 他们提出一种储能过程中的多阶段结构转变模型:在锂化初期,体系为赝固溶体状态,包含大量细小的纳米或亚纳米级Li7Ti5O12区域,此时两相界面处丰富的亚稳态共面Li8a/Li16c结构将引起邻近TiO6八面体额外的局域变形,这种界面处的扭曲结构实际上是Li快速传输的重要基础(在下一节讨论);随着Li的持续嵌入,Li8a开始迁移到16c位点,Li7Ti5O12的纳米区域逐渐生长成大尺寸晶体,从而出现宏观相转变.
2.2 两相界面
界面结构的测定有助于研究和理解材料的载流子输运和相界面移动过程,这两种因素与电极材料的倍率表现息息相关. 通常情况下,界面为二维或准二维结构,维系着两相之间截然不同的化学势和晶体结构,是非常重要的过渡区域. 电极材料的界面在宏观上一般难以观察,尤其是对于两相结构差别不大的体系. 由于Li的脱嵌,半锂化状态将出现Li7Ti5O12和Li4Ti5O12两相,WAGEMAKER等[23]的研究认为,只有在快速动力学过程中才能实现两相分离,室温下的嵌锂体系平衡态将以均匀固溶体形式存在,随着温度降低逐渐出现两相纳米区域,直到温度在100 K以下时达到长程相分离.
然而,在局部化学锂化的Li4+xTi5O12(x=0.15)颗粒表面,通过STEM技术可以获取到两相共存的HAADF图片(图5),表明室温下的相分离状态是可以稳定维持的[3]. 图5A中黄色线显示了两相边界的位置,边界锋利平滑,两侧的晶体结构没有明显变形,验证了宏观零应变的特性. 一般来说,在实验中捕获3D或2D的相分离结构非常困难,但该研究发现这个相界面可以在颗粒表面和内部同时被观测到,这与以往提出的核壳结构存在明显区别.
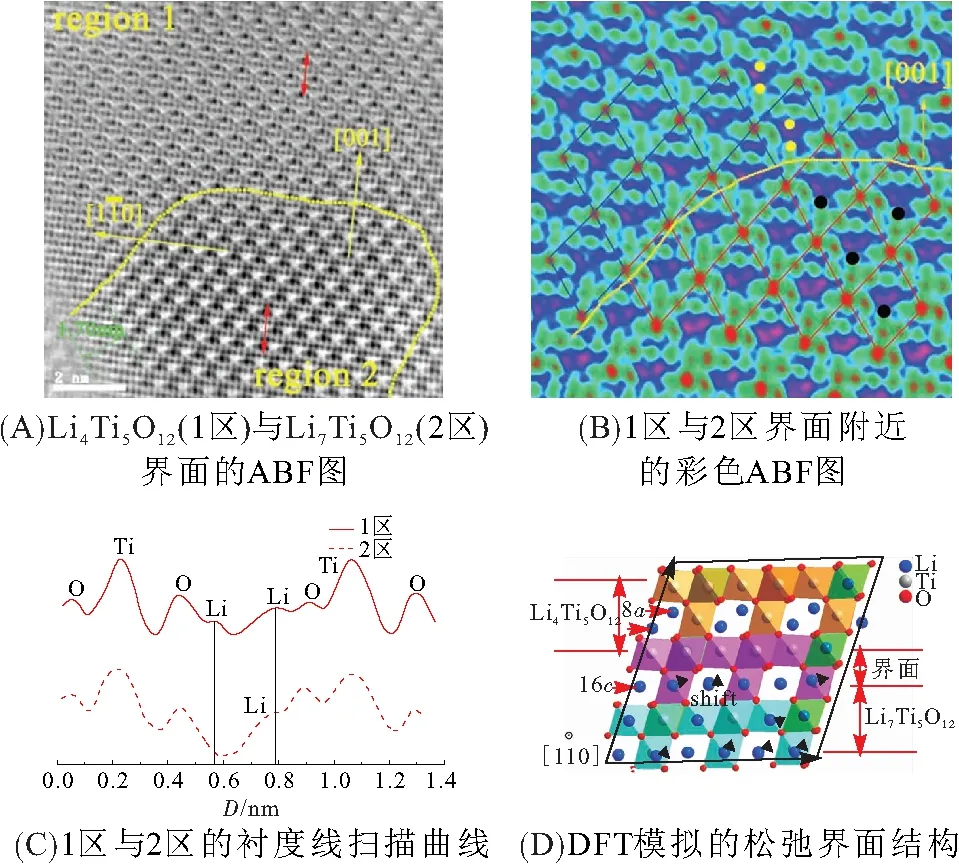
图5 化学锂化Li4+xTi5O12(x=0.15)颗粒的两相界面特性[3]
由于两相结构的差异,Li7Ti5O12在界面附近的部分Li16c向着界面处有明显的偏移(0.030 nm),界面附近局部小区域存在结构扭曲. 这种特殊结构扭曲实际对于体系的离子运输具有重要的价值. 假设Li在颗粒中以体相扩散为主导,对于一阶相变,Li在中间态Li4+xTi5O12的激活能应该是2个末端物相的线性叠加[24],WEGEMAKER等[25]却在2009年通过核磁共振(NMR)发现矛盾,Li在尖晶石或岩盐相中几乎不移动,但在中间态晶格中可以轻易扩散,似乎存在未知的Li扩散机制. 他们推测原因可能是中间态丰富的界面以及界面处Li同时占据共面8a/16c位点引起的结构扭曲.
SCHMIDT等[13]在2015年同样观测到,只需极少量的Li嵌入到晶格中,即可使材料的离子电导率显著提升,认为与大量共面Li8a/Li16c结构引起的强烈库伦排斥力相关. 根据前面提到的晶格稳定性研究,Li在体相中的8a/16c共占据是对热力学不利的,但是,GANAPATHY等[26]在2017年通过计算发现,Li—Ti的16d互占位能够稳固两相界面,这使得具有大量共面Li8a/Li16c结构的亚稳态Li4+xTi5O12可以存在. ZHANG等[27]进一步用XANES观察到TiO6八面体的扭曲,认为是界面处共面Li8a/Li16c结构作用的结果.
2020年,ZHANG等[27]结合第一性原理和原位电子能量损失谱EELS对Li+的迁移路径进行实时追踪,首次确定中间态Li4+xTi5O12的结构,同时揭示了两相界面处Li的快离子通道机制(图6). 他们证实:界面处存在大量扭曲的共面Li多面体结构,其形变程度和结构数量具有倍率依赖性,在快速动力学条件下数量增加并趋于高度扭曲,这些扭曲的Li多面体构成一种高效的Li运输通道. 在这个通道中当Li处于迁移过渡态时,Li—Li之间的库伦排斥力将会降低,同时氧配位数下降,具有很低的激活能,而且在Li运输过程中共面Li多面体的数量近似恒定,可以保证Li的快速迁移. 在界面两侧除了晶体结构的差异,还有电子电导的截然不同,Li4Ti5O12近似于绝缘体,Li7Ti5O12则接近于导体,具有典型的异质结结构. 2018年,WEN等[28]使用原位电子全息术在两相界面处首次观测到双电层的存在(图7). 当Li7Ti5O12相开始产生和两相界面出现时,中间区域的相位大幅度降低,颗粒中产生从外向内的内建电场. 在锂化过程中,由于界面两侧不同的导电性和Li+含量的差异,电子可能会注入聚集在Li4Ti5O12的表面,与富锂相Li7Ti5O12表面的Li形成界面双电层,这种现象同样有利于缩短界面间Li+的扩散时间.
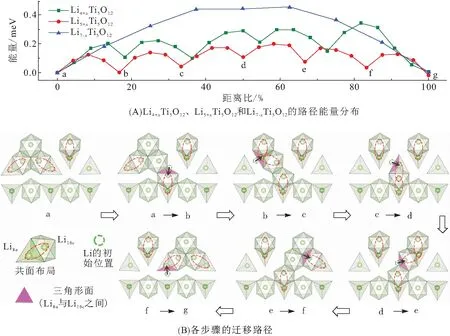
图6 中间态的锂离子迁移路径及相应的能垒[27]
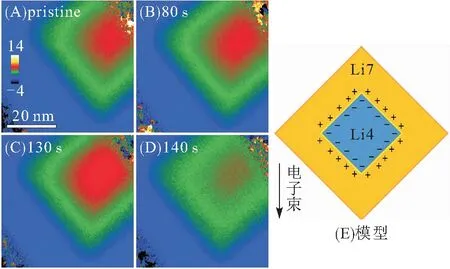
图7 钛酸锂两相界面形成的双电层[28]
2.3 电子转移
根据电中性原理,在相转变过程中1个分子的钛酸锂在嵌入3个Li+的同时,体系中的Ti4+将获得3个多余电子. 从平均意义上讲,Ti将从+4价还原为+3.4价,而基于原子分辨的EELS谱图对锂化Li7Ti5O12中Ti的价态及位置信息进行研究发现,嵌锂后Ti的价态并非空间均匀分布,多余的电子实际处于局域状态[3]. 图8给出了Li7Ti5O12的彩色HAADF图及从中获取的Tia/Tib栏L2,3边的EELS谱图. 通常情况下,Ti的L2,3边EELS谱图中有4个特征峰,Ti-2p芯电子和空穴(3d空轨道)的自旋轨道耦合导致L2和L3发生能级约5.0 eV的劈裂;邻近O引起的强烈晶体场作用又将每一边劈裂为2个峰. 由于电子占据的差异,Ti3+在谱图中有2个峰会发生弱化或消失,可以与Ti4+进行区分[29]. 由图8可判别,Tia和Tib栏主要属于Ti4+和Ti3+,意味着额外电子被局域束缚在部分Ti-3d轨道上.
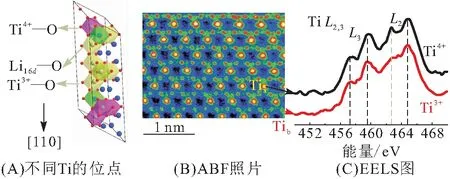
图8 Ti的L2,3边EELS谱图[3]
Li7Ti5O12的Ti离子Bader电荷分析也验证了这一点(表2). 当使用GGA泛函时,所有Ti 的化学态近似平均,3d电子发生离域;而在GGA+U(Ueff=4.5 eV)条件下,Ti的电荷分布和原子体积具有明显差异,大致可以指认为Ti3+和Ti4+两种类型,两者数量之比为2∶3,与EELS谱的结果一致,因此后者提供了更合理的描述. 计算时还发现化学态的不均匀分布与TiO6八面体的紧邻配位有密切关系,Li16d的位置会影响Ti3+的分布,Li+-e-之间存在强烈的耦合作用,可能存在电荷有序结构.
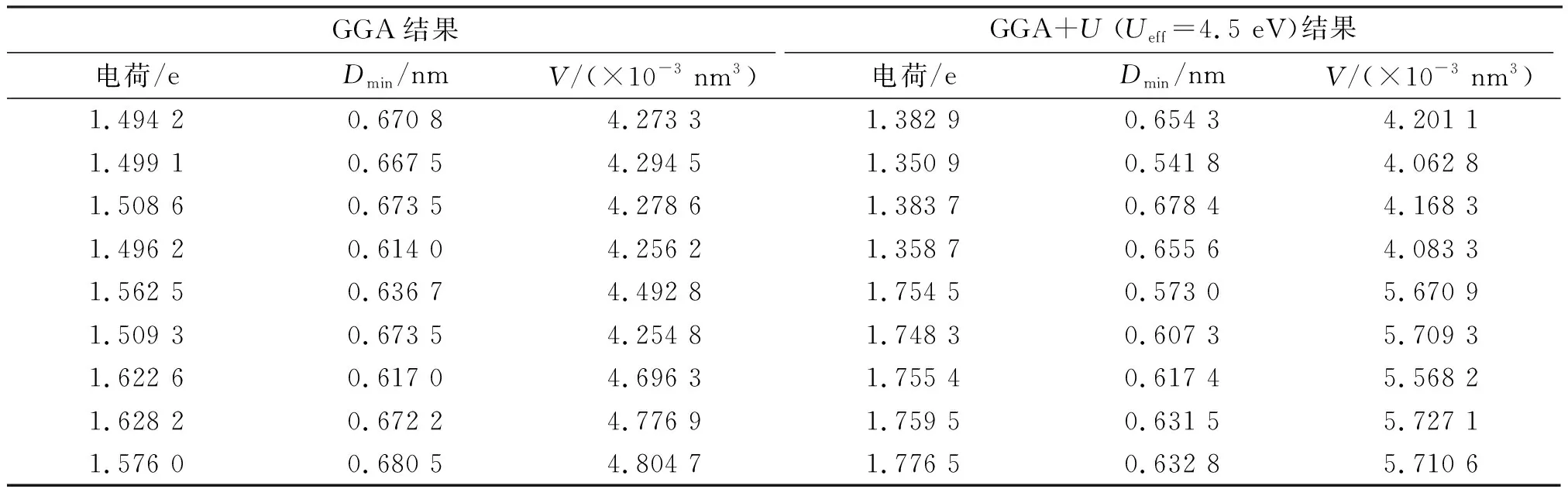
表2 Li7Ti5O12中Ti离子的Bader电荷分析[3]Table 2 The Bader atomic charge analysis of the Ti ions in Li7Ti5O12 supercell[3]
与其他电极材料相比,由于高达3.8 eV的禁带宽度,Li4Ti5O12的导电率(~10-13S/cm)并不占优势[30]. 有趣的是,锂化后Li7Ti5O12的导电能力发生了显著变化(~10-2S/cm),具有类金属性质[12]. YOUNG等[31]在2013年使用四探针法对不同荷电态的材料进行测试发现,只需少量Li嵌入到Li4Ti5O12晶格中,体系的电子电导率即可提升几个数量级,可以观察到烧结电极片从白色转变为深蓝色. 第一性原理对电子结构的研究也印证了两相导电性的巨大差异,计算得到Li4Ti5O12具有宽的禁带(~2 eV),表现为半导体性质;锂化时额外电子将占据Ti-3d轨道,费米能级向上移动贯穿导带,从而促进电子转移[32-33]. 由于GGA泛函不能正确处理电子间的交换关联作用,计算的禁带宽度相对实验值普遍偏小. 为此,VERDE等[34]采用HSE06杂化泛函进行计算,当Hartree-Fock交换的占比为30%时,禁带为3.87 eV,与实验值非常接近.
为了增加电极的倍率容量,各种途径被用于改善Li4Ti5O12的导电能力,最常见的有包覆、掺杂等. 导电层包覆主要改善颗粒间的电接触,而掺杂则可以调整体系的电子结构,从而显著改变导电能力[35]. 2006年,LIU等[36]从理论角度分析了不同金属离子掺杂(Cr、Mg、Fe、Ni)对尖晶石钛酸锂电子结构的影响,认为掺杂后体系的电子电导率提升的作用机理:Li4Ti5O12中Li或Ti的缺陷在禁带中引入施主能级,或出现了Ti3+/Ti4+的混合价态,从而形成n型半导体. 同样,ZHANG等[37]结合理论和实验研究,证实Li位的Ca掺杂可以显著提高钛酸锂的导电性(1.7610-2S/cm),计算结果(图9)表明:掺杂前后体系的能带分布基本相同,但由于Ca2+比Li+提供更多的价电子,部分Ti4+降价为Ti3+,费米能级向上移动并贯穿导带,从而提高了电子电导率.
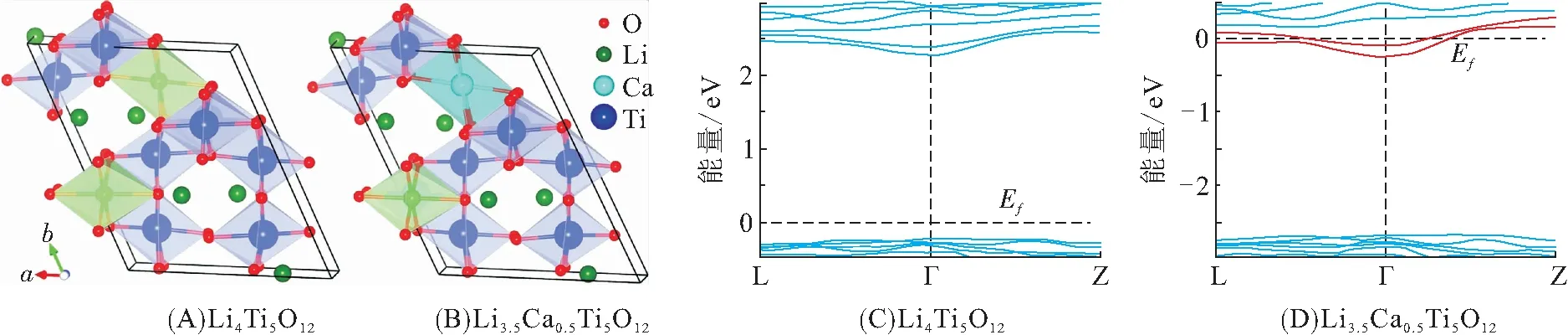
图9 Li4Ti5O12和Li3.5Ca0.5Ti5O12优化后的原子结构和能带图[37]
根据这些研究,在Li4Ti5O12中适当引入Ti3+似乎是提升电子电导率的有效思路. YOUNG等[31]提出,通过电池设计改善是更高效的方法,比如预锂化、调整充放电区间等,从而保证循环时体系中存在部分Ti3+. 此外,WOLFENSTEIN等[38]在2006年发现,在体积分数为3%的H2/Ar还原气氛中烧结样品,体系中的部分Ti4+将转化为Ti3+,产物导电率也提升几个数量级(~10-5S/cm). YAO等[39]同样使用H2对其制备样品进行处理,在体系中探测到除了Ti3+离子的形成,还存在大量的氧空位,说明Ti3+的产生是伴随着氧的逃脱. 最近KICK等[40]通过DFT在理论上预测:Li4Ti5O12中氧空位的引入可能会导致小极化子的产生,H2处理后体系的导电性提升与极化子跳跃机制相关,这种机制需要通过进一步的实验验证.
2.4 锂离子扩散
微观上,在一定温度下,粒子在固体的平衡位置存在随机跳跃,在外加驱动力作用下,粒子将偏离平衡位置形成宏观扩散现象,单晶中离子的扩散速率主要受间隙位或者空位间的热激活控制[41]. 在钛酸锂中,尖晶石框架[Ti5Li]16d[O12]32e非常稳固,Li主要沿晶格中共面的16c/8a间隙位扩散,形成一个三维的传输网络[42].
2007年,WILKENING等[43-44]先后通过NMR计算出尖晶石Li4Ti5O12及半嵌锂Li5.7Ti5O12中锂离子的跳跃能垒为0.86 eV和0.41 eV,测试温度分别为330~425 K和190~320 K. HAIN等[45]采用相同测试方法得到Li4Ti5O12、Li6Ti5O12及Li7Ti5O12的能垒分别为0.55、0.39和0.45 eV,测试温度为298~673 K. 尽管两者结果存在差异,但指明一个趋势:嵌锂后材料中Li的能垒降低,拥有更好的脱嵌能力. 这种差异可能来源于不同温度下体系离子构型和扩散机制的变化. VIJAYAKUMAR等[46]认为,当温度达到600 K以上时,部分Li8a会迁移到16c位点,产生大量8a空位,有利于Li+导电性的提升. 由于钛酸锂16d的Li—Ti互占位,同类位点的配位环境并非等价,理论研究更加复杂,是目前理论计算和实验测定不能很好吻合的部分原因. 2014年,BENEDIKT等[24]基于DFT计算出晶格中不同扩散路径的能垒,Li4Ti5O12的8a位点间能垒为0.30~0.48 eV,Li7Ti5O12的16c位点间为0.20~0.51 eV,与实验数据的趋势大体一致. 他们还发现,尖晶石相中16d位点非常容易捕获Li+空位,而岩盐相没有这种现象,可能是前者Li扩散速率慢的重要原因.
2004年,RHO等[47]使用PITT、EIS等电化学方法测得钛酸锂充放电过程中Li+的表观扩散速率仅为10-11~10-12cm2/s,因此大多情况下Li在晶格中的运输是电极反应的决速步骤. 提高初始态离子电导率似乎比改善电子电导率更加有效[31]. 纳米化、形貌调控或分级结构等,是目前电极材料制备最常见的思路,通过粒径的显著降低,或引入大量孔隙,使Li+在体相中扩散距离和输运时间大幅度缩短,进而提高电极反应动力学. 这种处理方式的弊端之一是振实密度太低,对于钛酸锂还需考虑比表面积增大后带来的界面稳定性恶化,胀气现象的有效抑制才是当务之急.
缺陷化学也是目前电极材料的一个重要发展方向. 掺杂过程中伴随着空位、通道和配位环境的改变,比如,异价元素替代改变空位占比,引入大半径的离子调控通道大小,替代骨架阴离子改变阳离子配位环境等,从而显著影响Li+的体相扩散能力[41]. 现有研究中,Li4Ti5O12的8a、16d或32e位点的掺杂都已经实现,16d位点的掺杂似乎更有益,因为不会降低活性Li+的数量和阻碍8a-16c-8a的扩散路径. 掺杂原子有不同固溶度和优先掺杂位点,但实际情况会更加复杂[36]. 杂原子可能占据多种位点,甚至产生第二相,调控掺杂体系的晶体结构和性质往往不容易. 典型例子:LIN等[48]将Cu引入到Li4Ti5O12晶格中,掺杂后晶格参数增大,降低了最近邻O的距离,促进Li的输运;但Cu在16d的占据致使部分Ti转移到8a位点,反而阻碍了Li+的扩散.
2018年,HUANG等[49]发表了尖晶石钛酸锂的压致非晶化的研究工作(图10),他们发现当外部施加压强达到47.4 GPa时,尖晶石框架将发生不可逆的结构倒塌,完全转换为非晶相,释放压强后也不能恢复,这个非晶相表现出更高的离子电导率. 第一性原理研究表明:16d位点的Li—Ti互占位及TiO6和LiO6八面体之间模量的巨大差异是高压强下形成非晶相的根本原因. 非晶相提供了大量缺陷,有利于Li+快速迁移,这种处理操作非常简便直接,为钛酸锂体相扩散能力的改善提供一个新的思路.
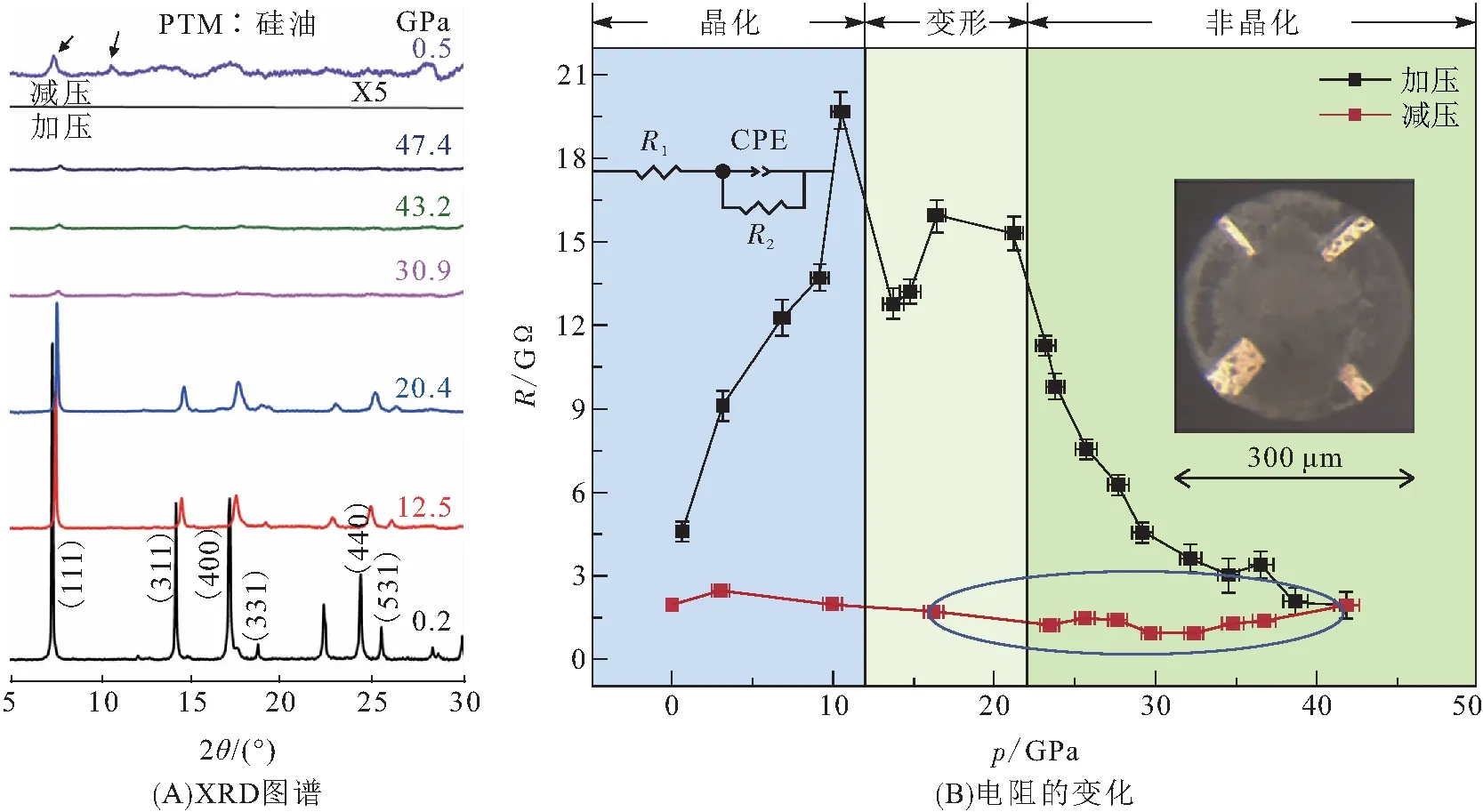
图10 Li4Ti5O12的高压非晶化[49]
不同离子的迁移能存在差异,在施加偏压时,通常只有一种离子反应并在晶格中运输,框架中其他固定离子发生价态变化以维持电中性. 由于Li4Ti5O12中Ti为+4价,在过度脱锂的情况下,不能继续升价. MENG等[50]在2019年通过STEM观察到,在过度脱锂时,为了保持体系的电中性,Li+和O2-会同时从LiO4四面体中逃脱,出现双离子的协同输运现象(图11).
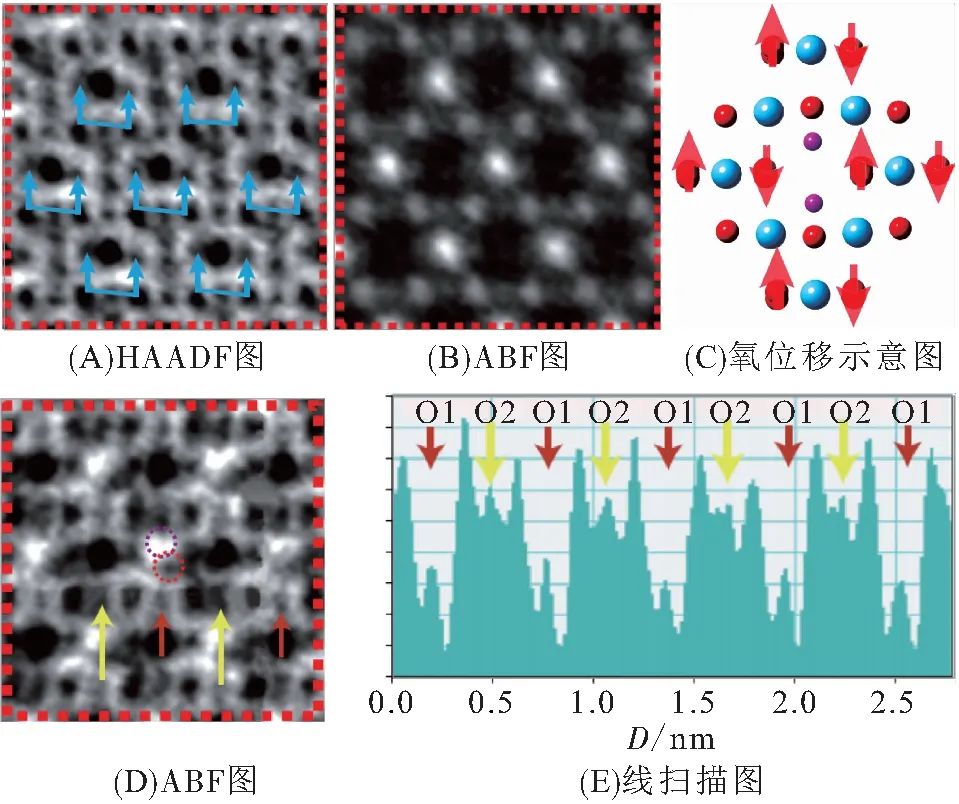
图11 不同偏压下的Li4-xTi5O12-y的STEM图像、氧原子移动方向及线扫描图[50]
在所构建的Si//Li4Ti5O12全电池中,当电压达到2.2 V,钛酸锂中氧栏发生垂直位移,同时Li8a偏离原先位置,体系中出现一定含量的氧空位和间隙氧;当电压增加到2.7 V时,上端8a位点的Li衬度消失,氧栏出现周期性衬度变化,发生锂氧离子的同时迁移并形成空位有序相. 理论计算得到双离子协同扩散的总能垒(1.48 eV)仅稍高于氧的单独扩散(1.33 eV),在动态输运过程中,两种离子间可能存在相互作用. 实际应用中过放电是难以避免的,氧的逃脱与气体产生和离子构型相关,这种现象对于产业化具有重要的研究价值.
3 表面结构
3.1 表面弛豫/重构
在实际的STEM观测中,总能发现Li4Ti5O12表面存在大量与体相不一致的结构,说明表面结构远非完美,存在显著的结构弛豫甚至重构,这种结构差异使得表层区域呈现与体相不同的电化学性质,并且与不可逆容量的产生及长期以来困扰研究者的“胀气”问题密切相关.
图12显示了初始状态Li4Ti5O12不同表面结构的HAADF图[2]. 通过比较表面和体相中的平行四边形格子边长可以发现,(110)晶面中表层区域的格子边长比体相大了约15%,而(111)晶面的弛豫现象则更加显著,达到50%. 图12B中还可以观察到,在原本没有原子占据的16c位点,出现了一个高衬度的钛原子栏,说明表面弛豫导致Ti16d移动到16c空位处,形成反常的表面Ti—O配位键,这种重构的表面在能量上似乎是更加有利的. 在弛豫的表面区域,Li的结构稳定性不如体相,制备过程中容易流失或吸收水分和CO2生成Li2CO3,因此可能存在富钛相. WANG等[51]在2012年使用水热法制备钛酸锂发现,当前驱体的n(Li)∶n(Ti)=4∶5时,通过STEM技术在材料表面观察到大约1 nm的类似结构,并认为是金刚石-TiO2相,他们猜测这种表面结构具有导电层的作用,有利于电子和Li的快速输运.

图12 Li4Ti5O12不同表面结构的HAADF图[2]
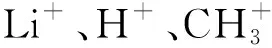
对于纳米材料,由于表面/体积比的大幅度增加,表面效应逐渐赶超体相而占主导地位,相较于微米级颗粒,纳米化导致Li4Ti5O12表现出截然不同的电化学特性,出现弯曲的电压曲线、更小平台区域及超过理论值的放电容量[52]. SWAPNA等[53]在2012年通过DFT计算发现,钛酸锂的表面储锂性质偏离体相性质,与其取向息息相关. 他们推测,弯曲电压曲线是表面环境向颗粒中延伸并过渡到体相环境的结果,最低能量的(110)面更有利于Li的嵌入,因此放电初期由于表面储能将出现更高的电位,随着弛豫效应的降低,逐渐向体相平台转变.
同时还发现,由于表面弛豫,(111)面相邻Li间的库伦排斥力被削弱,甚至允许Li在8a/16c位点的同时占据,这是额外容量的来源. CHIU等[1]在2017年使用XANES等技术对二维钛酸锂纳米片的表面弛豫进行了评估(图13),相比于块体材料,纳米片中Ti的K边蓝移,反映了Ti—O键长的伸长和离子化. 相反,Li的K边红移,反映了Li—O键的缩短和共价性的增加. 这种表面弛豫使得轨道杂化与电子结构分布发生变化,Li处具有更高的电荷密度,多余的电荷被离子化的Ti—O键所补偿,进而8a/16c位点间的库伦排斥力被屏蔽.
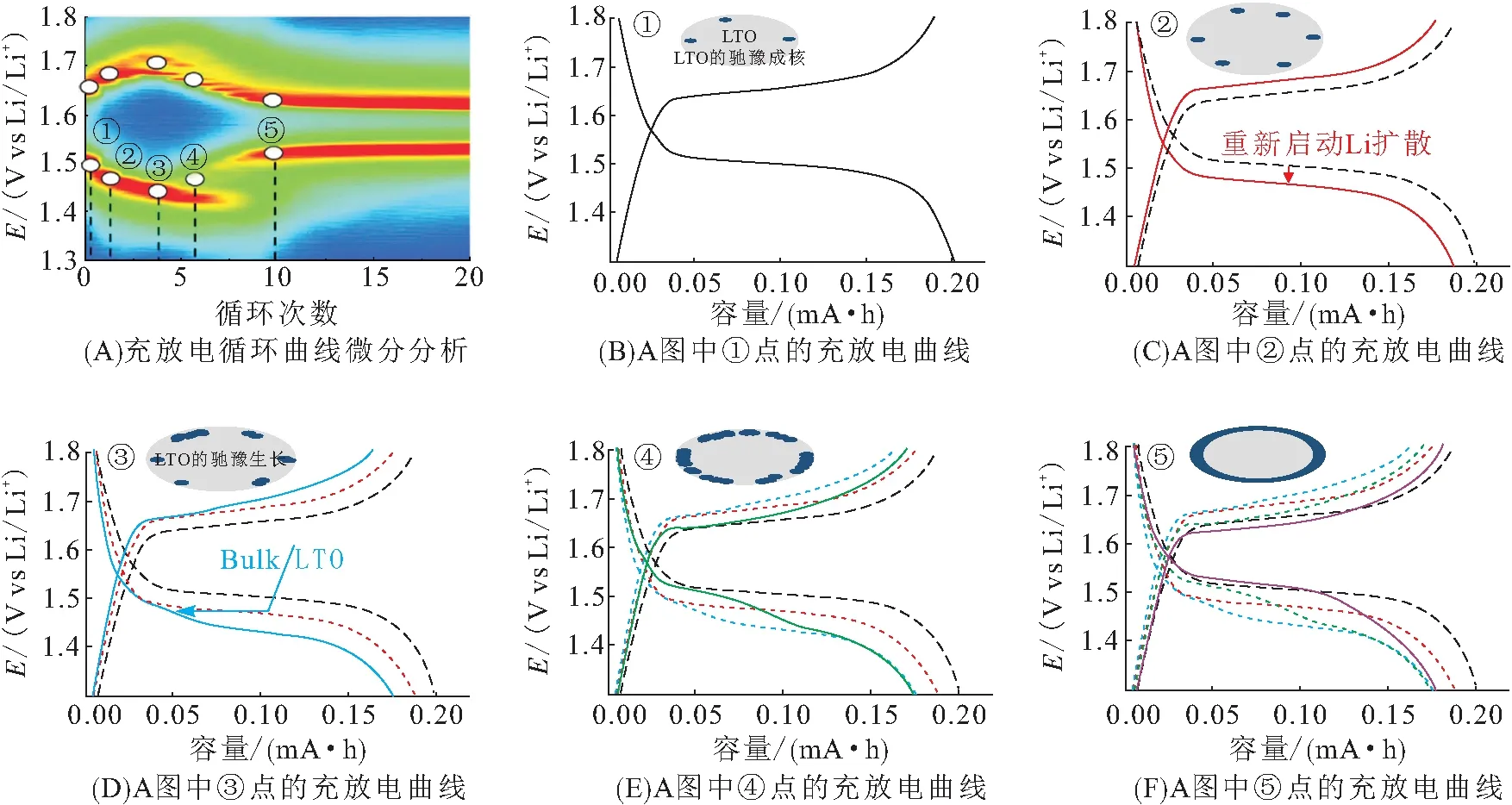
图13 循环过程电压曲线图及表面重构形成示意图[1]
这种结构弛豫已被证实可在循环过程中诱导表面重构. VERDE等[34]在2016年通过原子力显微镜(AFM)观察到钛酸锂薄膜电极在1.5~1.0 V区间电极表面形貌发生明显的变化,可能与电极/电解液副反应以及电极的过锂化引起的表面重构有关. CHIU等[1]使用STEM中确认了循环后纳米片表面区域出现Li—Ti混乱,由于8a/16c的共嵌入,大量Li不可逆地陷入到晶格中,使近表面区域转为富锂相,造成容量损失大. 他们提出了表面重构的微观生长模型(图13),在化成时,部分Li陷在材料表面,重构钛酸锂开始成核,并阻碍体相中Li的扩散,导致极化增大;循环前期,成核数进一步增加,极化随之增大;随着更多Li的自陷,晶核沿着Li扩散通道各向同性生长,形成准连续包覆层,Ti4+/Ti3+还原促进电子电导率增强,加速体相中Li的嵌脱,体相贡献增加,极化开始降低;直到近表面区域完全重构时,极化降低至稳定值.
这种晶格畸变来源于热转变过程中的残余应力,能够通过煅烧温度进行控制[9]. 不同煅烧温度会导致原子位置偏移到不同的亚稳平衡态,随着温度的降低,O离子移动远离Ti离子,从而改变Ti—O键角和键长,并使Li—O键缩短,出现配位环境和电子结构的差异. 相比于低温,在一个更高的温度下进行煅烧,可有效消除残余应力引起的结构弛豫,进一步减少共嵌入的“死锂”和改善电极动力学,提高材料的库伦效率和循环稳定性.
3.2 表面自发反应
“胀气”问题是现阶段钛酸锂大规模商业化应用最主要的挑战. 循环过程中,电池内部不断产生气体,导致电池发生鼓包,带来严重的安全隐患[54]. 尤其在纳米材料中,比表面积的增大还会带来更加严重的界面副反应和气体释放等热力学不稳定性. 目前钛酸锂的产气机理仍然众说纷纭,研究者大致认为痕量水分和表面自发反应是两个重要因素.
BELHAROUAK等[55]确认了Li4Ti5O12//LiMn2O4软包电池在老化过程中,内部产生的气体主要为H2,还有CO、CO2和少量碳氢化合物,猜测H2来自痕量水分的电解,CO、CO2等则是由强路易斯酸PF5引发的电解液分解. 随后HE等[56]对气体现象做了细致的研究,观察到钛酸锂电极直接浸泡在电解质溶剂中会产生CO2,在循环和老化时进一步释放H2、CO等气体,同时电极表面出现固态电解质界面(SEI膜),反映了胀气行为与钛酸锂的本征特性相关,来源于(111)晶面催化引发的电极和电解液界面反应,气体产生过程中的副产物在电极表面沉积产生SEI膜.
由于钛酸锂的电压平台高达1.55 V,而大多数电解液还原电位约0.70 V,以往认为在高于1.00 V的电位区间内循环不会形成SEI膜. 因此,SEI膜的发现表明其产生机理和特性与石墨电极完全不同,似乎是电极和电解液之间固有反应的结果. HE等[4]在2013年进一步研究发现,钛酸锂SEI膜的特征与材料的形貌和比表面积密切相关,主要成分为C—O类有机物,与石墨电极表面SEI膜的Li2CO3和ROCO2Li明显不同,推测来源于钛酸锂和电解液之间自发的脱羧反应.
2015年,我们发现钛酸锂表面存在Ti3+/Ti4+的自发转化[2],其释放的电子可能诱导电极/电解液界面发生副反应,是材料工作时产气的关键原因. 使用EELS线扫描获取Li7Ti5O12(100)面的Ti-L2.3谱图,发现从体相到表面Ti3+与Ti4+原子数之比逐渐降低,甚至在最外表处接近0(图14). CHIU等[1]也在钛酸锂纳米片表面观察到相同现象,即使Li4+xTi5O12已经充电到2.50 V,表层区域却具有比Li7Ti5O12更高的Ti3+含量. 这种反常现象揭示了锂化体系表面Ti4+自发维持的本征性质. 锂化时,除了常规的Ti4+还原为Ti3+外,材料表面还存在Ti3+氧化成Ti4+的自发可逆过程,释放的电子将进一步参与电解质/SEI膜等的氧化/还原过程,引发宏观的气体释放.
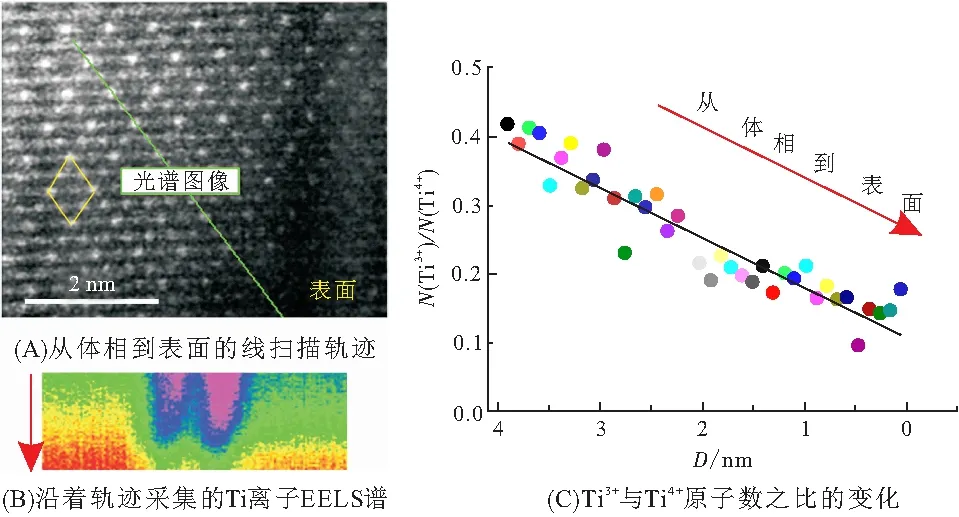
图14 Li7Ti5O12(110)晶面的EELS谱[2]
LIU等[57]在2017年的研究也表明Ti4+/Ti3+自发转化对胀气现象有重要作用. 不同荷电状态下,在软包电池在老化过程中,内部产生的气体含量明显不同. 由于高荷电下体系中含有更高的Ti3+,从而释放更多的电子,加剧电解液的分解. 从结果上看影响是非常显著的,在55 ℃下老化24 h后,100%荷电电池的气袋体系达到48.8 mL,无荷电的气袋体积仅为5.4 mL.
4 三相分离机制
2012年,ZHAO等[58]首次报道了尖晶石钛酸锂的可逆储钠行为,1 mol Li4Ti5O12可以容纳3 mol Na,可逆比容量达到145 mAh/g,具有相对较高的工作电位,是一种前景良好的高安全性钠离子负极材料. 他们通过非原位XRD观测嵌脱钠过程中的结构变化,推测放电阶段最终体系将转变为Li7Ti5O12和Na6LiTi5O12两相混合,并提出三相分离机制. 这种机制与锂化机制相似但又不同,放电过程中外界的Na优先占据Li4Ti5O12相的16c位点,与此同时原先占据8a位点的3个Li迁移到邻近Li4Ti5O12相的16c位点中,产生Li7Ti5O12和Na6LiTi5O12两种物相. 具体反应方程式为:
2[Li3]8aV16c[Ti5Li]16d[O12]32e+ 6Li++ 6e-
V8a[Li6]16c[Ti5Li]16d[O12]32e+
V8a[Na6]16c[Ti5Li]16d[O12]32e
由锂化过程的两相分离机制可知,外界Li嵌入后,在强烈的库伦排斥力驱动下,所有活性Li共同占据16c位点产生新相.
为了考察Na的引入对相变机制的影响,SUN等[10]基于第一性原理研究了锂钠固溶体V8a[LixNa6-x]16c[Ti5Li]16d[O12]32e的晶格稳定性(图15),结果表明:锂钠共占据16c位点的固溶体并非热力学基态,两种阳离子的尺寸差异促使放电产物趋于分离成更大晶格常数的Na6LiTi5O12相和更小晶格常数的Li7Ti5O12相.
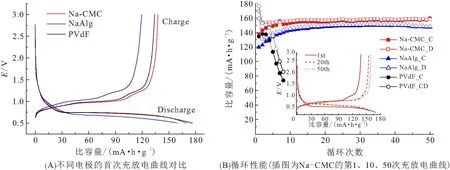
图15 C/10电流下不同粘结剂的Li4Ti5O12电极的充放电曲线及循环性能[10]
同步辐射原位XRD的分析结果也表明嵌钠反应是一个相分离过程(图16). 假设以固溶体机制为主导,钠化过程中相应的衍射峰会逐渐偏移,事实上,没有出现明显的衍射峰偏移过程,而是在14.4°、27.9°、33.6°等衍射角出现新峰. 可以发现新衍射峰的出现和消失远慢于充放电过程,放电结束时才出现新峰的信号,直到充电过程中峰值才达到最大. 考虑到XRD只有物相达到特定晶粒大小才能检测到信号,这从侧面暗示了尖晶石晶格中Na的缓慢扩散动力学行为.
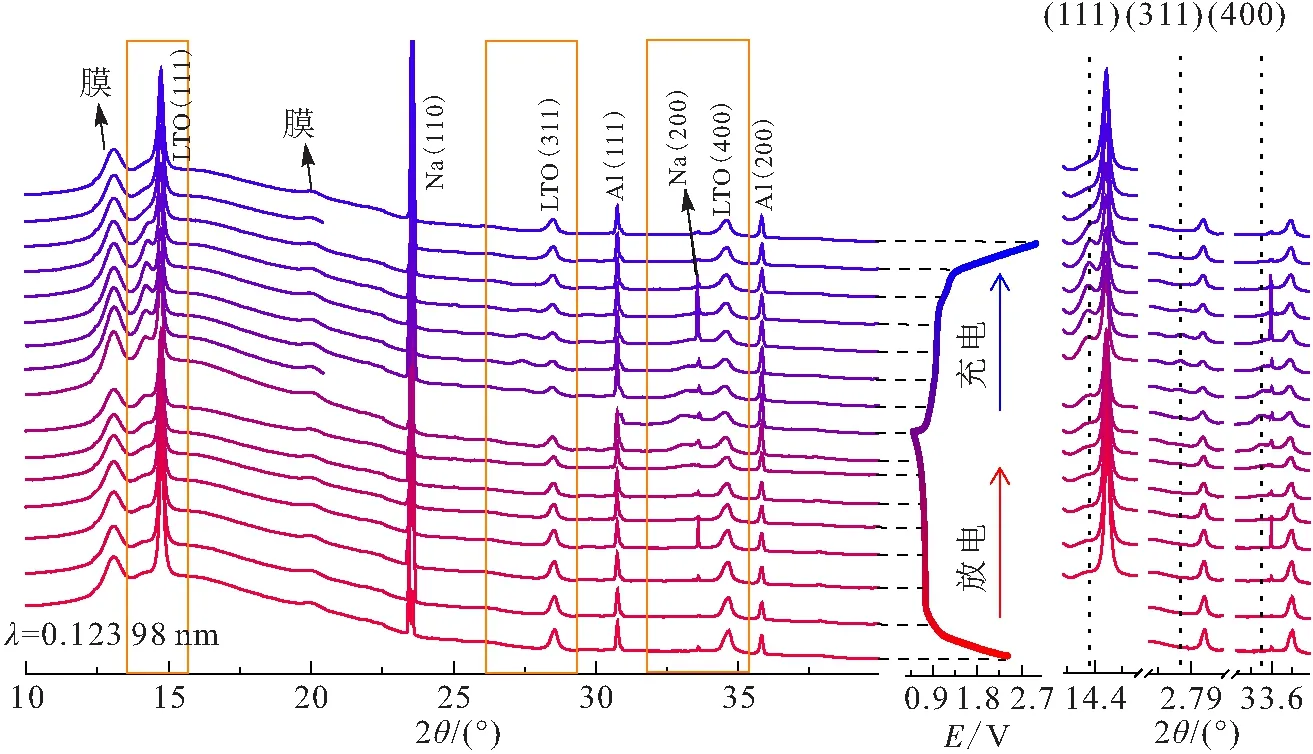
图16 C/10电流下不同粘结剂的Li4Ti5O12电极的同步辐射原位XRD谱[10]
随后,通过球差校正扫描电镜获取实空间原子图像,进一步为钛酸锂的三相分离机制提供了充分的证据(图17). 在一个部分被电化学钠化的钛酸锂颗粒中,发现了3种不同的物相结构. 对于Li4Ti5O12及Li7Ti5O12两相,两者具有相同的尖晶石框架[Ti5Li]16d[O12]32e,其HAADF图片没有明显区别;但通过ABF图片中8a/16c位点的衬度可以清晰辨别出嵌钠体系中Li4Ti5O12和Li7Ti5O12两相的存在. 此外,在颗粒部分区域的HAADF图中还可探测到16c位点处明显的衬度,此处占据着更大核电荷数的原子,这验证了Na6LiTi5O12新相的形成. 相应地,在半放电钛酸锂颗粒中寻找到三相共存的区域和清晰的相界面. 可以观察到不同物相间的界面非常锋利,没有明显的结构变形,与嵌锂过程的两相界面特征相似[3]. 不同的是,因为Li4Ti5O12/Li7Ti5O12相变时具有零应变特性,锂化体系中原子栏的排列近乎完美;但对于钠化体系,由于Na6LiTi5O12与其他两相之间晶格失配产生应变,原子栏排列不如锂化体系的规整.

图17 半电化学钠化Li4Ti5O12颗粒的STEM图、ABF及ABF衬度线扫描图[10]
由于嵌钠过程中钠离子半径更大和三相分离反应的参与,尖晶石钛酸锂表现出与嵌锂过程不同的电化学特性. 在C/10电流条件下,钠离子负极的电位窗口为0.50~3.00 V(图15A),平均电压为0.91 V,低于储锂的1.55 V,更有利于全电池能量密度的提升. 受限于缓慢的体相扩散以及低的交换电流密度,体系达到平衡所需时间非常漫长,在C/10电流下没有出现理想的电压平台,而是由两段略微倾斜的区域组成,存在严重的电压滞后现象(0.20 V).
YU等[59]基于原位XRD对电化学嵌钠过程进行了观测,发现Na6LiTi5O12相的结晶度较低,存在丰富的结构缺陷和较大的应变能,对嵌/脱钠反应热力学造成影响,可能与充放电曲线的滞后现象具有直接的联系. 他们计算得到Na+表观扩散系数仅为10-16cm2/s,比Li+低了5个数量级. 这与SUN等[3]理论计算的Li+、Na+跳跃能垒相吻合,Na+的16-16c位点之间的能垒高达0.90 eV,表现出超慢的扩散动力学. 钛酸锂负极的倍率性能将受到体相扩散的严重限制,其显著的尺寸效应进一步被证实,当粒径为440 nm时,1 mol Li4Ti5O12中仅有0.27 mol Na可以嵌入,比容量为16 mAh/g;当粒径降低到44 nm时,材料的容量基本达到理论水平,说明纳米化对于提升钛酸锂的储钠性能至关重要.
与另外两相晶格相比,Na6LiTi5O12的晶格常数(0.872 nm)更大,循环过程中活性物质将发生体积膨胀和收缩,涉及到电极开裂、材料脱落等一系列稳定性问题. 这使得钛酸锂负极性能对粘结剂的选择存在明显的依赖性,高弹性粘结剂展示出独到的优越性,有利于抑制电化学过程中的体积变化. 采用不同粘结剂组装电极,由其循环性能(图15B)可知,使用羧甲基纤维素钠(Na-CMC)为粘结剂时,首次比容量高达170 mAh/g,库伦效率为81.3%,循环数次后比容量稳定在155 mAh/g;使用海藻酸钠(NaAlg)为粘结剂时,初始比容量只有159 mAh/g,但循环20次后基本达到稳定;在相同条件下使用传统的聚偏氟乙烯(PVDF)时,电池表现出极差的稳定性,容量衰减非常迅速.
5 结语
尖晶石钛酸锂是目前取代碳基负极、带来更高安全性能和循环稳定性的最理想负极材料. 现阶段,钛酸锂电池已开始进入市场,然而各种基础性问题还没有得到充分的认识. “胀气”问题没有得到有效的解决,是影响钛酸锂未来发展的最大挑战. 大量研究者致力于构建纳米结构,以提升材料的倍率性能,却引发了更加严重的表面自发反应,对稳定性造成严重影响. 如何设计材料在提高反应动力学的同时,降低热力学不稳定性带来的负面效应,是未来研究的重点. 钛酸锂具有较高的嵌脱锂电位,为了提高全电池的能量密度,需要发展高电位的阴极材料与之匹配. 相应的,高抗氧化性、宽电压窗口电解液的开发成为另一个重要的挑战.
与此同时,基础性研究仍需要进一步推进. 比如确定钛酸锂的结构,找到Li与Ti互占位的规律;进而确定表面结构、相分离体系的三维模型、16d的Li-Ti互占位的分布及对离子输运特性的影响;两相界面的推进和传播图像、表面结构的演变过程、Ti3+/Ti4+自发转变与气体产生的深层联系、SEI膜成分与稳定性的关系等. 这些问题仍需重点关注研究,以准确认识材料的动力学特征及胀气的本质原因,寻找有效解决方案,加快尖晶石钛酸锂电极材料的普及和应用.

