海参i-型溶菌酶的制备及特性
马 锁, 丛 丽 娜, 谢 定 刚, 陈 清 平
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
溶菌酶又称胞壁质酶,在自然界中分布极为广泛,它主要通过破坏肽聚糖的支架,使细菌细胞壁肽聚糖中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键水解,导致细胞裂解死亡,从而起到杀菌的作用[1]。溶菌酶广泛存在于高等动物器官组织、分泌物以及部分植物体内和微生物细胞内[2-4],具有抗菌消炎、抗病毒、增强免疫力等独特功效,被广泛应用于食品和医药等行业[5-6]。i-型溶菌酶仅存于无脊椎动物中,在无脊椎动物先天免疫中起着重要作用[7-8]。与蛋清c型溶菌酶不同,水产动物i-型溶菌酶具有更广泛的抗菌谱,即对革兰氏阳性菌和革兰氏阴性菌都有明显的抗菌作用[9]。目前工业提取溶菌酶的方法繁多复杂,因此,探索出成熟的i-型溶菌酶分离提纯生产方法十分必要。
以本实验室已构建的能够高效表达海参i-型溶菌酶的毕赤酵母基因工程菌HS 3-1为出发菌株,利用5 L发酵罐进行发酵培养,并对发酵液进行分离纯化,制备出海参i-型溶菌酶;并对该溶菌酶进行pH、温度和热稳定性等理化性质及动力学模拟的初步研究。
1 材料与方法
1.1 材 料
1.1.1 菌 株
毕赤酵母菌株为本实验室已构建的毕赤酵母基因工程菌HS 3-1;供试菌株为溶壁微球菌(Micrococcuslysodeikticus)和铜绿假单胞菌(Pseudomonasaeruginosa)均为本实验室保藏。
1.1.2 培养基
YPD培养基:酵母提取物1 g,胰蛋白胨2 g,加水定容至90 mL,121 ℃灭菌20 min,待冷却至50 ℃时,加入10 mL 10×葡萄糖。
BMGY培养基:酵母提取物1 g,胰蛋白胨2 g,加水定容至70 mL,121 ℃灭菌20 min,待使用时加入10 mL 10%甘油,10 mL 10×YNB(含硫酸铵的酵母基础氮源)以及10 mL磷酸盐缓冲液 (pH 6.0)。
BSM (1 L)培养基:85%磷酸26.7 mL,硫酸钙0.93 g,硫酸钾18.2 g,七水硫酸镁14.9 g,氢氧化钾4.13 g,甘油40 g,自来水定容至1 L,灭菌后加入PTM1 4.35 mL,发酵过程中pH用30%氨水调节。
1.2 方 法
1.2.1 发酵罐种子液的制备
将活化后的毕赤酵母基因工程菌HS 3-1菌液,按1%的接种量接入YPD培养基,在30 ℃、180 r/min的条件下,摇床培养20~22 h。以1%接种量接入BMGY培养基,在30 ℃、220 r/min条件下摇床培养14~16 h。
1.2.2 发酵罐扩大培养
采用BSM基础盐培养基,转速400 r/min,pH维持在6.0,按10%接种量接入种子液。发酵过程中,待基础甘油耗尽后,向培养基中流加10%的甘油,流加时间约5 h,最终使酵母菌体湿重达到180~220 g/L;向发酵液中流加甲醇进行诱导发酵,利用甲醇检测仪在线控制发酵液的甲醇体积分数为1.0%,诱导发酵时间为96 h。
1.2.3 发酵液分离纯化
对发酵液进行离心,使用低温冷冻离心机12 000 r/min离心10 min,收集上清液,该上清液经过超滤浓缩仪进行初步的纯化,收集截留液。通过镍离子亲和层析柱进一步纯化,使用透析袋除去引入的盐离子。使用真空冷冻干燥机对该透析液进行24 h冷冻干燥,制得海参i-型溶菌酶。
1.2.4 溶菌酶的特性分析
对制得的海参i-型溶菌酶产品进行聚丙烯酰胺凝胶电泳分析,确定目的蛋白的表达量和分离纯度,进行抑菌性试验,并利用MALDI-TOF测定相对分子质量。
1.2.4.1 最适pH和最适温度
测定溶菌酶在不同pH (4.0~9.0)及不同温度(25~85 ℃)条件下的酶活力。酶活力单位定义:在一定条件下(25 ℃,pH 6.2),450 nm处每分钟吸光度下降0.001为一个酶活力单位(IU)。以溶壁微球菌粉为底物,通过分光度计进行测量[10]。
1.2.4.2 pH稳定性和温度的稳定性
分别用pH 4.0~9.0磷酸盐缓冲液配制1 mg/mL 溶菌酶液,处理10 min,再将pH调至7,以pH为7时作为对照,溶壁微球菌粉为底物,用比浊法测定溶菌酶液的相对酶活。用磷酸盐(pH 6.2)缓冲液配制1 mg/mL溶菌酶液,分别置于65、70、75、80、85 ℃条件下水浴0~60 min,冷却至室温,以溶壁微球菌粉为底物,用比浊法测定溶菌酶液的相对酶活,实验重复3次。
1.2.4.3 温度对溶菌酶抑菌性的影响
用磷酸盐缓冲液(pH 6.2)配制1 mg/mL溶菌酶液,分别置于65、70、75、80、85 ℃条件下水浴10 min,冷却至室温,以溶壁微球菌为指示菌,用牛津杯法测定各个溶菌酶液的抑菌圈直径,实验重复3次。
1.2.5 分子动力学模拟
采用分子动力学模拟检测不同温度下酶的分子构象变化。在分子动力学模拟过程中,通过SWISS-MODEL数据库在线预测溶菌酶的初始结构并生成相应的pdb文件[11]。使用程序生成具有平衡SPC水分子的立方体盒子,设定盒子边长为6.598 0 nm,将溶菌酶放入盒子中,使用低温退火程序在温度为25、40、60、80 ℃下进行,步长为2 fs,总时间为10 ns。分子动力学模拟及结果分析均使用Gromacs 5.1.4软件包完成[12-13]。
2 结果与讨论
2.1 海参i-型溶菌酶发酵结果
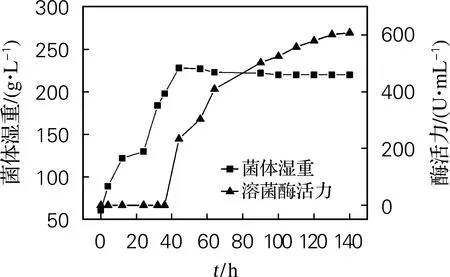
在5 L发酵罐中进行毕赤酵母基因工程菌HS3-1的发酵培养,每4 h取样测定菌体湿重和酶活力,结果如图1所示。由图1可看出,当发酵进行40 h左右,菌体湿重达到220 g/L,开始进行甲醇诱导,即溶菌酶开始产生,最后溶菌酶的最高酶活力达到600 U/mL。从图2可以看出,目的条带大约在14.3 ku附近,随着甲醇诱导时间的延长,目的条带越来越明显,诱导至96 h的目的条带最明显。
M,Marker; 1~9,分别为诱导0、12、24、36、48、60、72、84、96 h的目的条带

图2 溶菌酶的SDS-PAGE结果
2.2 纯化后溶菌酶性质分析
经过对发酵液离心、浓缩、过镍离子亲和层析柱和透析等蛋白纯化过程,得到溶菌酶纯化液,SDS-PAGE电泳和抑菌结果如图3所示。由图3(a)可以看出,纯化后产物的杂蛋白基本除掉,得到电泳纯的单带,即产物的纯度较高,可用于抑菌实验。经冷冻干燥后得到溶菌酶干粉,测定其对溶壁微球菌和铜绿假单胞菌的抑菌性,如图3(b)所示,结果表明溶菌酶对溶壁微球菌有更好的抑菌活性。利用MALDI-TOF进行分析测定,如图4所示,可以确定海参i-型溶菌酶的相对分子质量为14 709。

(a) SDS-PAGE电泳图

(b) 抑菌实验

图4 溶菌酶的质谱图
2.3 海参i-型溶菌酶特性
2.3.1 最适pH及稳定性
海参i-型溶菌酶最适pH及稳定性的测定如图5所示。由图5(a)可以看出,随着pH的升高,酶活力也逐渐上升,pH达到6.5时,酶活力达到1 238 U/mL,可以得出溶菌酶的最适pH为6.5。由图5(b)可看出,溶菌酶在pH 5.0~8.0有良好的稳定性,相对酶活在80%以上。
2.3.2 溶菌酶最适温度及其热稳定性测定
海参i-型溶菌酶最适温度及热稳定性的测定如图6所示。由图6(a)可看出,当溶菌酶产品在温度为35 ℃时,酶活力达到1 224 U/mL,可以得出溶菌酶的最适温度为35 ℃。由图6(b)看出,溶菌酶在温度25~80 ℃有较好的热稳定性,仍保持80%的相对酶活力,超过85 ℃后相对酶活力迅速下降。这说明所制备的溶菌酶耐受较高的温度范围比较大,具有良好的热稳定性。
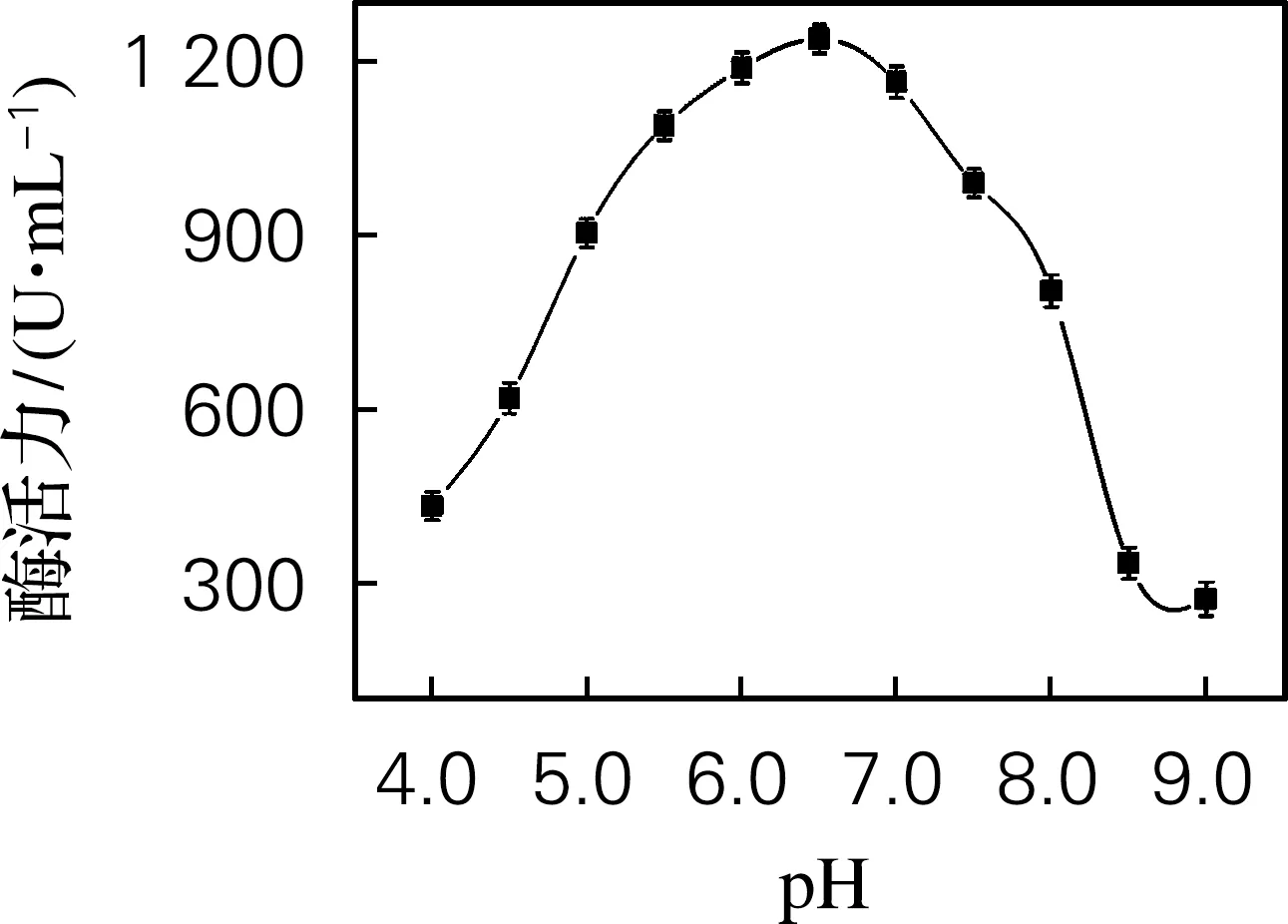
(a) 最适pH

(b) pH稳定性
图5 溶菌酶最适pH及pH稳定性
Fig.5 Optimum and stability of pH of i-type lysozyme
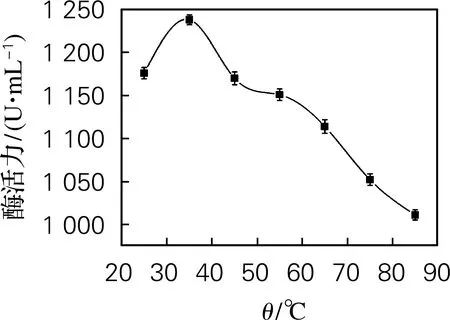
(a) 最适温度
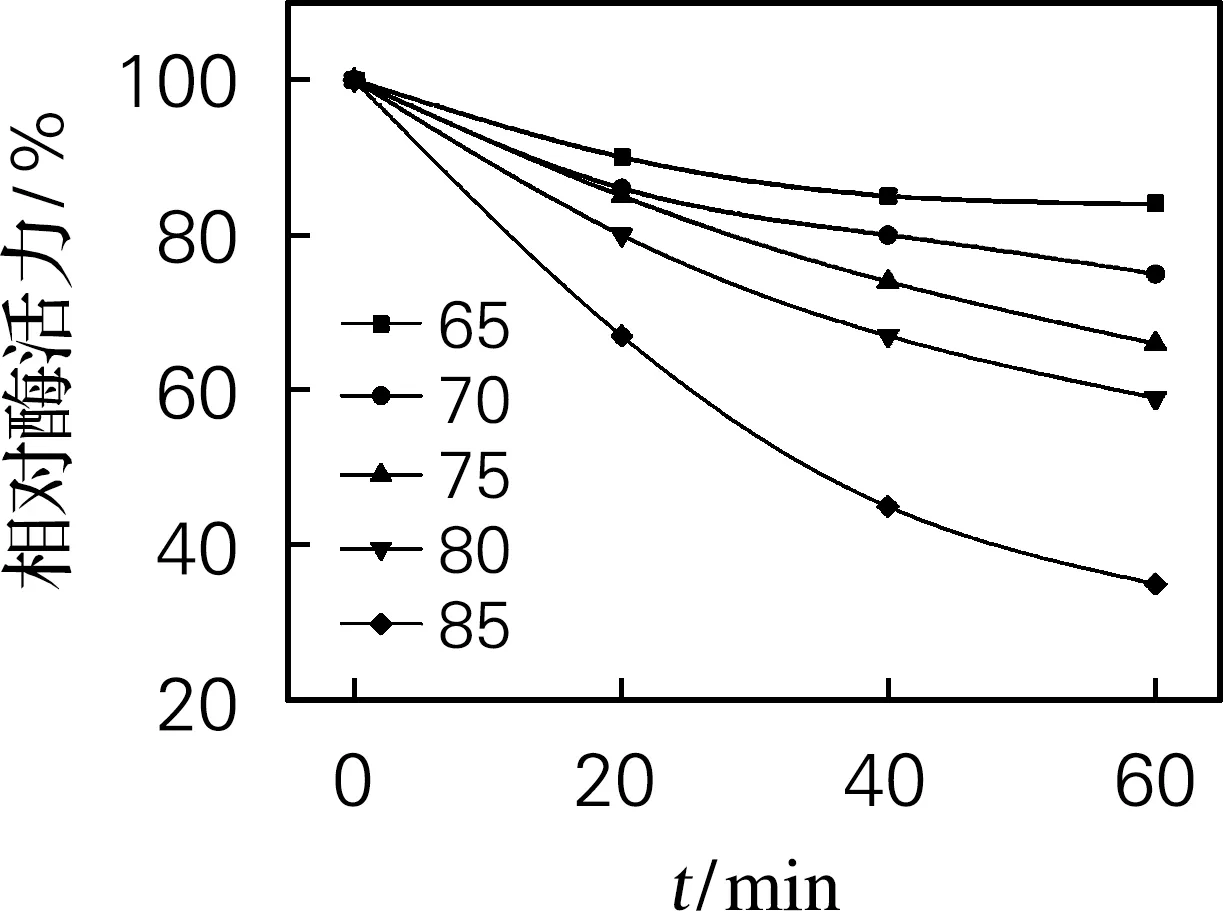
(b) 热稳定性
2.3.3 分子动力学模拟温度对溶菌酶蛋白质构象影响
为进一步探究溶菌酶的热稳定性,实验设定在较高温度条件下处理海参i-型溶菌酶,并检测其抑菌活性(以抑菌圈直径为指标),结果如表1所示。由表1可知,溶菌酶在65~85 ℃抑菌活性下降了27.8%,而作为对照的蛋清溶菌酶在相应温度范围内抑菌活性下降了50%,这表明海参i-型溶菌酶具有更好的热稳定性。
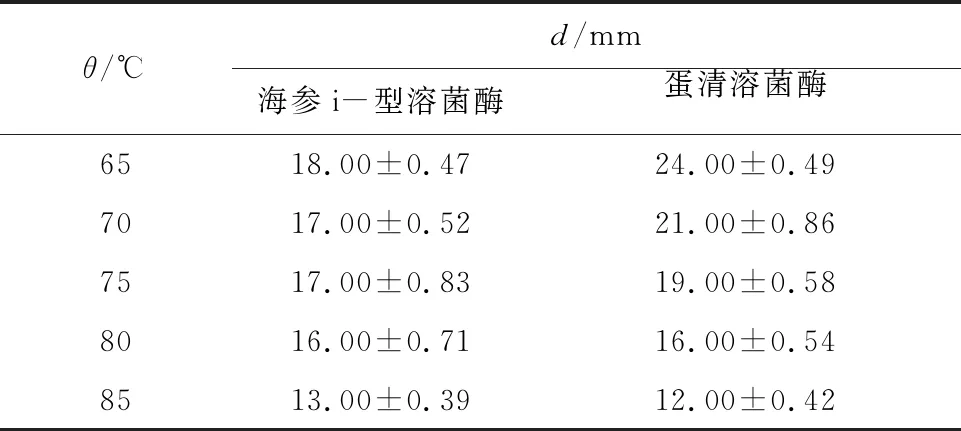
表1 不同温度处理后不同溶菌酶的抑菌性比较
为了深入研究海参i-型溶菌酶热稳定性变化的分子机理,利用分子动力学模拟来探究温度对溶菌酶蛋白构象的影响,分析该酶蛋白在不同温度下的三级结构构象变化,如图7所示。结果发现,随着模拟温度的变化,溶菌酶蛋白的结构域中出现一段“H1-L2-H2”(螺旋-环-螺旋)的构象,而且从低温(25 ℃)到高温(80 ℃)处理过程中,中间的L2环发生了翻转。但是在整个过程中,H1和H2两个螺旋区域结构基本没有发生变化,并且通过分析比较确定了该酶的2个活性位点(Ser 18和His 48)分别位于“H1-L2-H2”构象的2个螺旋区域。说明该溶菌酶三级结构的“H1-L2-H2”构象使其具有很强的抗菌活性,并且该酶又具有良好的热稳定性。模拟结果与实验获得的溶菌酶抗菌活性相吻合。Ibrahim等[14]对水蛭溶菌酶结构的研究表明,其主要是单个螺旋肽形成的HLH起作用,与本实验结果一致。
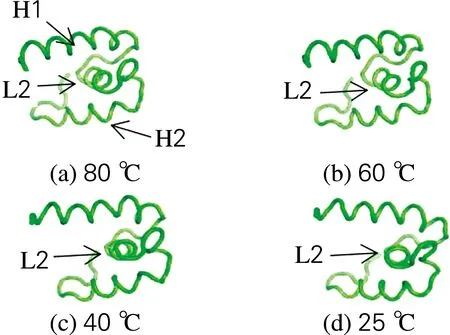
图7 不同温度处理后酶的构象
3 结 论
利用毕赤酵母基因工程菌HS 3-1进行发酵罐扩大培养生产海参i-型溶菌酶,经分离纯化、冷冻干燥得到溶菌酶产品。通过MALDI-TOF质谱分析确定了该溶菌酶的相对分子质量为14 709。海参i-型溶菌酶最适温度为35 ℃,最适pH为6.5,该酶在25~80 ℃有良好的稳定性。分子动力学模拟也同时证明了该溶菌酶具有良好的热稳定性。分子动力学模拟蛋白构象结果表明,该溶菌酶三级结构的“H1-L2-H2”构象是该溶菌酶分子能够保持强抗菌活性和高度热稳定性的主要原因。

