人造血干细胞在不同氧浓度下生长、凋亡状况观察研究*
叶 果,杨 鑫
(重庆大学附属肿瘤医院头颈肿瘤中心,重庆 400030)
人造血干细胞(HSCs)在不同因素直接影响下增殖、分化成各种细胞,如骨髓组织细胞、淋巴组织细胞、白细胞、红细胞、上皮组织细胞等。HSCs具备不停自我更新和变异的潜力。1988年THOMSON等[1]在实验室成功建立了胚胎干细胞系。从此以后,HSCs在实验室被进一步培养为多种细胞,包括骨细胞、软骨细胞[2]、血细胞、神经细胞、肌肉细胞、胰岛细胞等[3-4]。基于HSCs优良的不断增殖和多向分化能力,在组织损伤重建的研究中HSCs表现出突出的作用[5]。与此同时,在临床修复治疗中HSCs的多向分化性也获得了广泛应用。在干细胞的培养条件中环境因素至关重要,不同的环境因素包括氧浓度、pH值、温度、渗透压等,均能影响干细胞的增殖与分化。氧浓度对干细胞的生长和凋亡有至关重要的影响,JOBIN等[6]的研究发现,在体外培养的低氧环境下,干细胞的生长受到明显干预。本研究主要观察HSCs在人体外培养的状况下,在不同氧浓度中的生长和凋亡情况,为将来的基础性试验与临床应用提供一定依据。
1 材料与方法
1.1材料 HSCs由上海拜沃生物科技有限公司提供。RPMI1640培养液(上海钰森生物技术有限公司)、Metho CultTMHCC4230培养基(加拿大Stem cell Technologies Inc公司)、IMDM培养基(上海北诺生物科技有限公司)、二氧化碳培养箱(长沙长锦科技有限公司)、Annextin V(美国Becton,Dickinson and Company)、微氧手套箱(COY Laboratory Products公司)、6孔培养板(广州洁特生物过滤股份有限公司)、Annexin V-FITC细胞凋亡检验试剂盒(杭州昊鑫生物科技股份有限公司)、CKC-TR-2W型倒置显微镜(Olympus,Japan)、YJ-875型超净化工作台(苏州安泰净化设备厂)、BD-CAN7型流式细胞仪(美国Becton,Dickinson and Company)。
1.2方法
1.2.1细胞培养 HSCs用10%胎牛血清的RPMI1640培养液培养。
1.2.2不同氧浓度的细胞培养处置方式 将HSCs分为实验组和对照组。实验组细胞在微氧手套箱中培养的氧浓度分别设定为:3%、5%、15%;对照组细胞在微氧手套箱中培养的氧浓度设定为20%。
1.2.3红系集落形成单位(CFU-E)集落培养 采用Metho CultTMHCC4230培养基,0.9 mL培养基加入0.1 mL的细胞悬液(细胞密度2×109个/升),用IMDM培养基补足为1 mL,充分混匀后转移至35 mm的6孔培养板,每份标本重复5孔,置不同氧浓度,37 ℃饱和湿度的培养箱内,培养4、7、10 d时分别计数CFU-E集落数。
1.2.4流式细胞仪检测HSCs凋亡率 采用10%胎牛血清的RPMI1640培养基,0.9 mL培养基加入0.1 mL的细胞悬液(细胞密度2×109个/升),用IMDM培养基补足为1 mL,将HSCs在不同氧浓度下分别培养6、12、24 h,使用Annexin V-FITC细胞凋亡检验试剂盒,通过BD-CAN7型流式细胞仪检测HSCs凋亡率。
1.2.5相关性分析 氧浓度为3%、5%、15%、20%分别记作3%氧浓度组、5%氧浓度组、15%氧浓度组、对照组。培养4、7、10 d时研究不同氧浓度和CFU-E集落数的相关性;培养6、12、24 h时研究不同氧浓度和HSCs凋亡率的相关性。

2 结 果
2.1人造血干细胞 倒置显微镜下观察分离培养的人血干细胞,见图1。

图1 人造血干细胞(HE×400)
2.2CFU-E集落数结果 培养4、7、10 d,5%氧浓度组CFU-E集落数最高,3%和5%氧浓度组与对照组CFU-E集落数比较,差异均有统计学意义(P<0.05)。见表1。

表1 各组CFU-E集落数比较
2.3不同氧浓度组HSCs凋亡率比较 培养6 h,5%氧浓度组HSCs凋亡率最低,3%和5%氧浓度组与对照组HSCs凋亡率比较,差异均有统计学意义(P<0.05);培养12 h,5%氧浓度组HSCs凋亡率最低,5%和15%氧浓度组与对照组HSCs凋亡率比较,差异均有统计学意义(P<0.05);培养24 h,5%氧浓度组HSCs凋亡率最低,3%和5%氧浓度组与对照组HSCs凋亡率比较,差异均有统计学意义(P<0.05)。见图2。
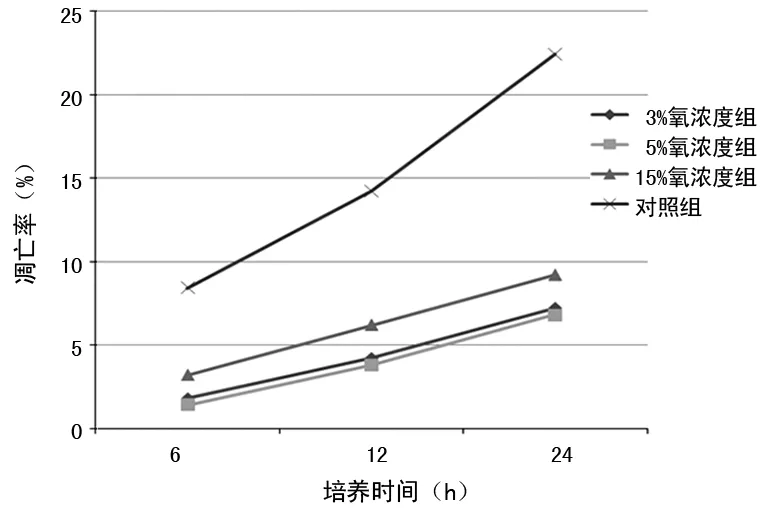
图2 流式细胞仪测定HSCs凋亡率
2.4不同氧浓度和CFU-E集落数、HSCs凋亡率相关性分析
2.4.1分别培养4、7、10 d,不同氧浓度和CFU-E集落数相关性分析 培养4、7、10 d氧浓度变化与CFU-E集落数均呈正相关(r=0.486、0.848、0.813,P<0.05)。
2.4.2分别培养6、12、24 h,不同氧浓度和HSCs凋亡率相关性分析 培养6、12、24 h后氧浓度变动与HSCs凋亡率均呈正相关(r=0.743、0.785、0.773,P<0.01)。
3 讨 论
HSCs在增殖、分化、凋亡过程中受不同环境因素的影响,包括温度、氧浓度、渗透压、pH值等,其中至关重要的一项因素就是氧浓度,而最容易忽视的一项因素也是氧浓度。在不同氧浓度下,HSCs的生物学行为显现出多种多样。有科学研究推测出HSCs在人体内最适宜生存的微环境不是常氧状态,而是低氧状态[7-8]。低氧状态是人体内普遍存在的一种生理环境,因此,也促进了人体内细胞的发育及多种病变的转变[9]。目前,国际和国内对于HSCs的体外培养,普遍采用常氧状态,而体内低氧状态与实验室中的常氧状态有巨大差异,却较少有研究关注低氧状态下HSCs的增殖、分化、凋亡情况。因此,本研究选用不同氧浓度培养HSCs,可更为真实地模拟人体内不同的真实生存环境状态。
HSCs在自我修复、更新及分化方面有明显优势。同时,HSCs的增殖、复制、归巢后重建造血、多向分化、凋亡等生物学方面的功能也受周围各种环境因素的广泛制约[10-11]。在人体内骨髓环境中为低氧状态,而这正是HSCs主要的生存区域[12-13]。人体内的这种低氧状态,对于HSCs生物学方面的基本功能的持续保持起关键作用[14-16]。有研究发现,低氧状态会促进神经干细胞的增殖,与此同时神经干细胞的凋亡却出现明显抑制效果[17]。人体内部的低氧诱导因子(HIF)-1是细胞在低氧状态下适应与应答调节中的主要转录因子,HIF-1在细胞的生长、增殖、分化、凋亡等生物学活动中起举足轻重的作用。HIF-1有α和β 2个亚基,常氧状态下,因为被蛋白酶系统降解的原因,HIF-1α在细胞质内处于失活状态。而在低氧状态下,HIF-1α大量聚集活化,同时转移到细胞核内,与细胞核内的HIF-1β相结合构成HIF-1分子,进而辨识、结合其中包含有低氧化学反应元件的DNA序列,从而介导、调节和管控与低氧反应所涉及基因的表达[18]。在人体内骨髓中平均氧浓度为5%,静脉血平均氧浓度为12%~15%,动脉血平均氧浓度为20%。本研究将体外培养环境中各组氧浓度分别设定为3%、5%、15%、20%,正是要模拟HSCs在人体内不同氧浓度下的生长、凋亡状况。而这方面的研究工作国际和国内的报道相对较少。
4 结 论
本研究发现,HSCs分别培养4、7、10 d,其中5%氧浓度组CFU-E集落数最高;分别培养6、12、24 h,其中5%氧浓度组HSCs凋亡率最低。由此推测,不同氧浓度对HSCs的生长和凋亡有直接影响,而其中5%氧浓度能促进HSCs的生长,同时也能抑制HSCs的凋亡,可为今后的临床应用和实验室研究提供一定理论依据。

