酶底物法与过滤培养法检测非饮用水中嗜肺军团菌的比较
高 艳,李 啸,段 杉,刘 丹,顾 琳,赵剑虹,孙灵利
(北京市朝阳区疾病预防控制中心,北京 100021)
现代社会人们生活在密闭空间的时间不断增加,受到室内环境病原微生物感染的风险也随之增高。近几年,由嗜肺军团菌引起的军团菌病(Legionnaires′ disease,LD)的数量急速上升,引起世界各国的高度重视[1-2]。军团菌病是一种严重的潜在致命性肺炎,主要由吸入的嗜肺军团菌污染的雾化水引起[3]。军团菌主要在温水中繁殖并存活,与人造水系统有关,包括冷却塔、建筑用水、漩涡水疗和装饰性喷泉等。许多国家出台了水环境中的嗜肺军团菌监测方案,作为防止军团菌病暴发流行的重要控制环节[4-7]。
我国原卫生部于2006年颁布了《公共场所集中空调通风系统卫生规范》的行业标准,依据该标准,各级疾控部门和监督部门相继开展了公共场所集中空调嗜肺军团菌的监测、评价和调查工作。2013年,中华人民共和国国家标准《公共场所卫生检验方法》(GB/T 18204.5—2013)[8]出台,其中,第5部分介绍了集中空调冷凝水、冷却水中嗜肺军团菌的检测方法。上述行业标准与国家标准对集中空调冷凝水、冷却水中嗜肺军团菌的检测方法基本相同,且与欧美等国家监测方法相似[9-10],即通过对集中空调冷凝水、冷却水进行过滤、洗脱、酸处理、热处理后进行细菌培养。该方法需要多种仪器,且耗材种类繁多,流程复杂,须由多名试验人员共同完成,具有较高的试验成本。
近年来出现了几种新的嗜肺军团菌定量检测方法,其中,酶底物法是嗜肺军团菌利用酶底物试剂中氨基酸、维生素和其他营养物质迅速生长和增殖,其代谢产物与试剂发生反应使溶液显褐色,基于最可能数(most probable number,MPN)方法对样本中嗜肺军团菌进行定量分析。2018年,北美、欧洲开始相继应用该方法在饮用水和非饮用水中检测嗜肺军团菌[11-14]。目前,我国还未对该方法进行评价。
本研究应用我国GB/T 18204.5—2013[8]推荐的过滤培养法与酶底物法同时对本地区公共场所非饮用水中嗜肺军团菌进行检测。对检测结果进行统计分析,比较两种方法的优点和不足,探讨酶底物法应用于非饮用水中嗜肺军团菌检测的可行性。
1 材料和方法
1.1 样本来源
84件非饮用水样本采集于2019年8月—10月朝阳区24家公共场所。样本包括集中空调冷凝水9件,冷却水55件,淋浴水20件。样品采集方法依据GB/T 18204.5—2013[8]。
1.2 仪器与试剂
1.2.1 仪器
Quanti-tray plus程控定量封口机(IDEXX),六联不锈钢微生物过滤系统(Sartorius),罗氏LightCycler 480实时荧光定量PCR仪(罗氏公司)。
1.2.2 试剂
GVPC琼脂平板、BCYE琼脂平板、L-半胱氨酸缺失的BCYE琼脂平板,购于OXOID公司。嗜肺军团菌乳胶凝集试剂 Lp-1型、Lp2-14型,购于OXOID公司。嗜肺军团菌生化鉴定试剂盒,购于环凯微生物。嗜肺军团菌核酸检测试剂盒,购于江苏硕世。Legiolert试剂、预处理试剂、Legiolert定量盘,购于IDEXX公司。
1.3 方法
1.3.1 酶底物法
(1)样本处理与培养
根据Legiolert说明书进行。在无菌微管中加入1 mL Legiolert预处理液及1 mL样品,涡旋混匀后室温下温育1 min,转移至100 mL溶解的Legiolert试剂中,充分混合并倒入Legiolert定量盘,用SealerPlus程控定量封口机密封。
将密封好的Legiolert定量盘纸侧向下置于(37±0.5)℃培养箱中,培养7 d。7 d后,定量盘中棕色孔或浑浊孔即为阳性孔。
(2)阳性孔确证试验
为了检验酶底物法的特异性,对Legiolert定量盘中阳性孔进行确证试验。Legiolert定量盘共有6个大孔,90个小孔。如果阳性孔数小于10个,全部进行确证;如果阳性孔数大于10个,先选取10个(包括全部大孔及随机选取的小孔),再加上随机选取剩余阳性孔数的25%进行确证。确证方法为使用无菌注射器抽取10 μL悬浮液,涂布BCYE和L-半胱氨酸缺失的BCYE,35~37 ℃培养48~72 h,在BCYE上生长、L-半胱氨酸缺失的BCYE上无生长的菌落进行生化鉴定、血清型别鉴定及real-time PCR鉴定。
(3)酶底物法的计量结果
酶底物法采用MPN法确定样本中嗜肺军团菌含量,计算阳性大孔和小孔的数目,并从Legiolert MPN表获得所得的MPN值。MPN是应用概率理论来估算细菌浓度,实际菌落数有可能落在置信区间内的任何一点,MPN值是落在这个置信区间内概率最大的一点。
1.3.2 过滤培养法
(1)过滤、洗脱、前处理
依据GB/T 18204.5—2013[8],使用六联不锈钢微生物过滤系统对非饮用水样本进行过滤处理。抽滤完成后,取下滤膜置于15 mL灭菌水中充分洗脱,洗脱液在培养前进行酸处理与热处理。
(2)接种与培养
取酸处理样品、热处理样品各0.1 mL接种GVPC。于35~37 ℃、2.5% CO2环境中培养10 d。24 h内长出的为非嗜肺军团菌,24 h后长出的为可疑嗜肺军团菌,继续鉴定。
(3)菌落验证
选取可疑菌落,如果数量小于10个则全部选取;如多于10个,则选取10个及超过10个数量的25%。将选取菌落接种BCYE和L-半胱氨酸缺失的BCYE,35~37 ℃培养48 h,在BCYE上生长、L-半胱氨酸缺失的BCYE上无生长的菌落继续进行生化鉴定、血清型别鉴定及real-time PCR鉴定。
(4)结果判定
定性结果:酸处理与热处理后的培养结果,只要有一种方法培养出嗜肺军团菌,即判断该样本含有嗜肺军团菌。
定量结果:酸处理与热处理后的培养结果,选取菌落数量较大值为该样本定量结果。
1.4 质量控制
ATCC33152为本次研究质控菌株。
1.5 统计分析
数据采用SPSS 25.0软件进行统计分析。采用origin 绘图软件进行绘图。嗜肺军团菌阳性率组间比较采用卡方检验,嗜肺军团菌定量结果组间比较采用皮尔逊相关性分析。检验水准α=0.05(双侧)。
2 结果和讨论
2.1 结果
2.1.1 两种方法对嗜肺军团菌检测的定性结果
两种方法对84件非饮用水样本进行检测。结果显示,两种方法均阳性样本15件,均阴性样本56件;两种方法相结合,共有28件样本分离出嗜肺军团菌,其中,3件样本只在过滤培养法中有检出,10件样本只在酶底物法中有检出(表1)。
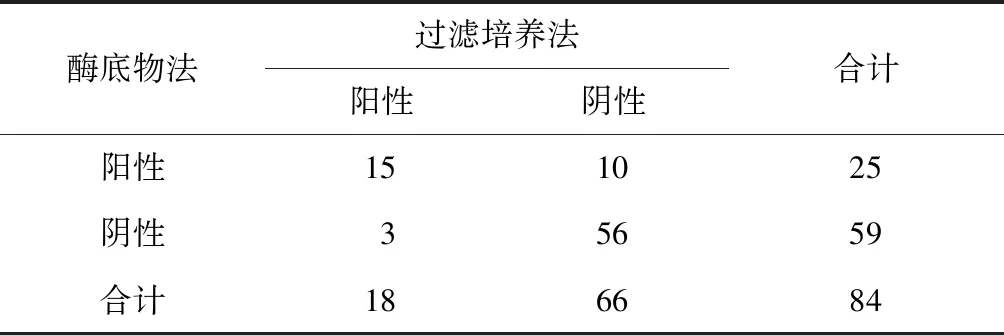
表1 酶底物法与过滤培养法检测嗜肺军团菌的结果Tab.1 Determination Results of Positive Samples Containing Legionella pneumophila by Enzyme Substrate and Filter Culture Methods
酶底物法与过滤培养法对非饮用水样本中嗜肺军团菌检出结果采用McNemar检验,两种方法检测的差异性无统计学意义(P=0.092)。
2.1.2 两种方法的特异度与灵敏度
本研究对酶底物法和过滤培养法的阳性样本均进行了确证,无假阳性。因此,两种方法特异度均为100%。将检出的嗜肺军团菌的全部样本定义为真阳性样本(28件),酶底物法和过滤培养法的灵敏度分别为89.29%(25/28)和64.29%(18/28)。结果显示,酶底物法灵敏度高于过滤培养法。
2.1.3 过滤培养法中酸处理与热处理检测结果
由表2可知,过滤培养法中酸处理和/或热处理后培养出嗜肺军团菌的样本数量为18件,其中,7件只在酸处理后检出,5件只在热处理后检出,6件在两种方法处理后均有检出。
2.1.4 两种方法对不同样本的检测结果
本研究共检测3种样本(表2)。除了冷凝水,冷却水与淋浴水中均有检出嗜肺军团菌。酶底物法与过滤培养法对冷却水和淋浴水中嗜肺军团菌的检出率经卡方费希尔精确检验,差异无统计学意义(P=0.480)。
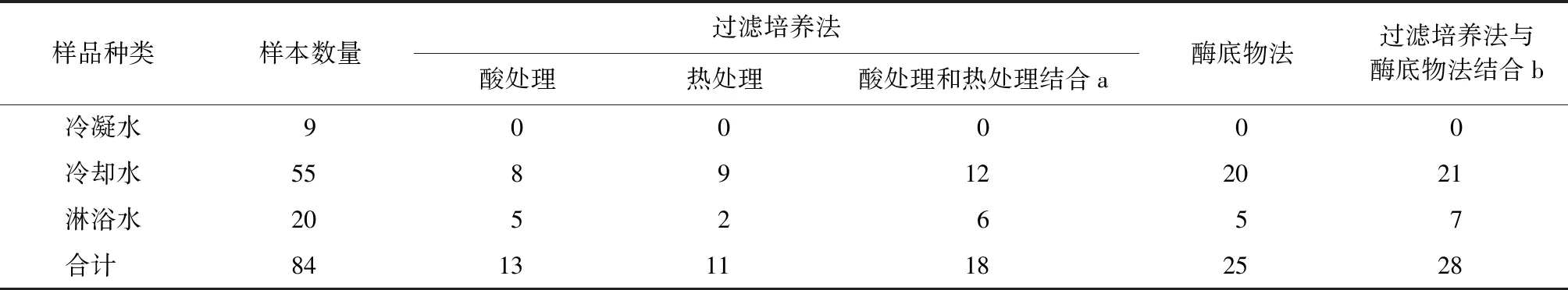
表2 两种方法在不同种类样本中检出嗜肺军团菌的样本数量Tab.2 Positive Samples Containing Legionella pneumophila by Two Methods in Different Kinds of Samples
2.1.5 两种方法对不同血清型别嗜肺军团菌的检出结果
28个样本中嗜肺军团菌的血清型别分布为Lp-1型13个,Lp2-14型10个,另有5个样本Lp-1型与Lp2-14型均有检出(表3)。这5个样本中,有4个样本在过滤培养法中血清型别是单一的。在酶底物法的阳性孔验证过程发现有混合血清型别菌落存在。

表3 两种方法检测嗜肺军团菌的血清型别分布Tab.3 Serotype Distribution of Legionella pneumophila Detected by Two Methods
两种方法分离出的嗜肺军团菌的血清型别分布采用卡方费希尔精确检验,差异无统计学意义(P=0.690)。
2.1.6 两种方法对嗜肺军团菌检测的定量结果
28个样本经过滤培养法和/或酶底物法检出嗜肺军团菌,其定量结果计算原理并不相同。过滤培养法根据GVPC上生长菌落数量计算样本中的CFU含量。酶底物法根据定量盘中变为棕色或出现浊度的大孔和小孔的数目,从Legiolert MPN表获得所得的MPN值,MPN值则是应用概率理论来估算细菌浓度,但并不能表示实际菌落数。本研究采用皮尔逊相关分析法对28对定量结果进行统计分析(图1)。结果显示,两种方法获得的嗜肺军团菌的定量结果具有相关性(皮尔逊相关系数为0.718,P=0.000)。

注:(a)为28个非饮用水样本中嗜肺军团菌定量结果散点图; (b)为(a)图方框部分放大图图1 过滤培养法与酶底物法检测非饮用水中 嗜肺军团菌定量结果相关性分析Fig.1 Correlation Analysis of Quantitative Results of Legionella pneumophila in Nonpotable Water by Filter Culture and Enzyme Substrate Methods
2.2 讨论
近年来,许多地区将荧光定量PCR、恒温等温扩增等定量方法[15-17]引入到对环境样本中嗜肺军团菌的监测,但培养方法仍然是金标准。非饮用水中嗜肺军团菌的含量较少,且存在其他微生物干扰,这是培养方法面临的两个挑战。为了提高培养方法的灵敏性和特异性,GB/T 18204.5—2013[8]在培养前增加了膜过滤、酸处理及热处理环节,但这些操作大大增加了操作环节和时间。酶底物法也是基于细菌培养进行微生物检测的方法,目前已广泛应用于检测水样中总大肠菌群和大肠埃希氏菌。本研究所采用的酶底物法通过选择性培养基和预处理环节,保证了该方法检测水样中嗜肺军团菌的灵敏性和特异性。在对检测结果进行分析时发现,3个样本酶底物法出现假阴性,过滤培养法计量结果为0.8 CFU/mL,有10个样本过滤培养法出现假阴性,酶底物法计量结果为1.1~36.1 MPN/mL。可见,在样本中细菌含量较低时,两种方法均可能出现漏检,但酶底物法假阴性率低于过滤培养法,呈现较高的灵敏度。该结果与Barrette等[14]的研究结果相同。
不同血清型别的嗜肺军团菌引发的疾病不同。嗜肺军团菌Lp-1、Lp-4 和Lp-6 是引起人类肺炎最常见的血清型[18-19]。其中,Lp-1 型是引起社区获得性肺炎和医院感染性肺炎的重要病原体[20]。因此,确定嗜肺军团菌的血清型别可为病因溯源和临床诊断提供依据。虽然本次研究发现两种方法分离出的嗜肺军团菌血清型别差异无统计学意义,但有4个样本在过滤培养法中培养出来的菌落为1~3个,血清型别是单一的。在酶底物法的阳性孔验证过程发现多种血清型别。可见,在样本中细菌含量较少时,酶底物法更便于发现混合的血清型别。
3 结论
嗜肺军团菌是导致军团病的病原体,本地区集中空调冷却水及公共场所淋浴水中存在嗜肺军团菌污染。因此,加强这种病原体的检测与控制对公众健康至关重要。本研究表明,酶底物法与过滤培养法对非饮用水中嗜肺军团菌的检出结果具有一致性,但酶底物法呈现更高的灵敏度,结合其结果易于判读、试验流程简化等特点,可考虑将酶底物法作为过滤培养法的替代方法。

