孕中、晚期母体血清甲胎蛋白测定联合影像学对前置胎盘合并胎盘植入诊断价值探讨
朱晓童 陈 晓 钱天烨 王新新 孔 祥*
前置胎盘位于前次剖宫产子宫切口瘢痕处被称为“凶险型前置胎盘”,常伴胎盘植入及难治性产后出血,导致子宫切除率明显增高。前置胎盘及合并胎盘植入成为产科医师面临的棘手问题[1-2]。目前,前置胎盘合并胎盘植入的产前诊断仍存在难点,除影像学检查外,许多学者致力于研究母体血清学指标的预测[3],主要包括甲胎蛋白(AFP)、肌酸激酶(CK)、妊娠相关血清蛋白A、胎儿游离DNA、胎盘游离m RNA、DNA微阵列、血管内皮生长相关标志物等[4]。在上述生化指标中AFP和CK的临床检测技术成熟,具有筛查推广的临床意义。本文探讨孕中、晚期母体血清AFP、CK测定及联合影像学检查,对前置胎盘合并胎盘植入的诊断价值。
1 对象与方法
1.1 研究对象
选取2016年10月-2018年3月在扬州大学临床医学院产科定期产检,孕中期B超提示胎盘附着位置异常,且存在前置胎盘合并胎盘植入高危因素的孕妇为研究组,共80例。依据术中所见及术后病理组织学结果确诊,前置胎盘合并胎盘植为植入组,前置胎盘未合并胎盘植入为非植入组。选取同期产检孕妇,剖宫产≥1次或孕次(包括此次)≥3次,且此次分娩方式为剖宫产的单胎妊娠孕妇为对照组,共54例。前置胎盘合并胎盘植入高危因素包括有剖宫产史、人工流产史、清宫史、其他宫腔操作史、产褥期感染史、高龄等。排除标准:多胎妊娠;妊娠期并发症;严重肝肾功能异常;胎儿先天异常;胎盘异常。本研究获得苏北人民医院伦理委员会批准,孕妇及家属均知情同意并签署知情同意书。
1.2 研究方法
1.2.1标本采集 孕16~18周及孕晚期空腹抽取母体静脉血3ml,离心留取血清,放置于-4℃保存。
1.2.2血清AFP及CK测定 血清AFP测定:采用时间分辨荧光法(试剂盒由PerkinElmer公司提供),采用PerkinElmer公司6000-0010全自动时间分辨荧光免疫分析仪。严格按照试剂盒使用说明书操作。血清CK测定:采用比色法(试剂盒由德国罗氏诊断公司提供)使用Roche Modular P,D全自动生化仪检测。严格按照试剂盒使用说明书操作。
1.2.3影像学诊断 超声诊断:①胎盘后间隙部分或全部消失;②胎盘增厚,胎盘内血池异常丰富,表现为大小不等、形态不规则的液性暗区,内见云雾状回声,呈翻滚的“沸水征”,即为“胎盘漩涡”,可探及动脉血流,表现为血流紊乱、湍急,甚至累及子宫肌层和(或)膀胱壁连续性的中断;③子宫肌层变薄(厚度<1 mm),胎盘或子宫膀胱交界面血流信号丰富,子宫膀胱交界面中断或破坏,分界不清[1,5-6]。MRI诊断:由2位具有多年临床经验的医师进行,孕妇仰卧位,扫描范围为从耻骨至胎盘上缘,孕妇可平稳自由呼吸,未使用镇静剂,扫描时间15~20 min。检测仪器为1.5T/MRI,矢状位为T2加权像(T2W1)。胎盘植入的判断依据[7]:信号在子宫结合带附近消失、中断或具有不规则性,该处子宫壁变薄,或发现胎盘边缘在子宫外端。胎盘植入的6个特征性MRI征象为[8-9]:①胎盘信号侵入肌层;②直接侵犯盆腔内组织器官;③T2WI上胎盘内低信号带;④胎盘内信号不均匀;⑤膀胱呈“帐篷”样改变;⑥子宫下段膨出。
1.3 研究指标
①年龄、孕次(包含此次妊娠)、产次(不包含此次妊娠)、既往剖宫产次数、宫腔操作次数;②孕中、晚期AFP值、孕晚期CK值;③超声、MRI诊断结果。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。正态分布的计量资料采用()表示,多组比较采用单因素方差分析,用LSD进行两两比较,计数资料中分类变量采用χ2检验或Fisher精确概率法。以P<0.05为差异有统计学意义。对检测结果作图绘制ROC曲线,计算曲线下面积(AUC)及标准误。确定诊断的最佳临界值。临床诊断评价采用敏感度、特异度、阳性预测值、阴性预测值及诊断符合率。联合诊断评价采用平行试验(只有一项阳性即可认为阳性)及系列试验(均为阳性为阳性)。
2 结果
2.1 一般资料比较
各组孕妇的一般资料比较无差异(P>0.05),见表1。
表1 3组对象一般资料比较()

表1 3组对象一般资料比较()
项 目 植入组(n=36)非植入组(n=44)对照组(n=54) F P年 龄(岁) 30.8±3.1 29.9±2.8 29.9±2.2 1.546 0.213孕 次 3.1±1.3 2.8±1.2 2.7±0.6 1.552 0.216产 次 0.9±0.6 0.8±0.4 0.9±0.3 1.004 0.369既往剖宫产次数 0.9±0.6 0.7±0.5 0.7±0.5 2.314 0.103宫 腔 操 作 次 数 1.3±1.1 1.0±0.9 0.8±0.6 2.833 0.062
2.2 血清AFP、CK及影像学的联合诊断价值评价
2.2.1血清AFP 孕中期、孕晚期植入组AFP高于非植入组及对照组;孕中期非植入组AFP也高于对照组(P<0.05);孕晚期非植入组AFP与对照组无差异(P=0.264),见表2。经ROC曲线分析,孕中期AFP诊断临界值为55.1μg/L,AUC为0.75,灵敏度为77.8%;孕晚期AFP诊断临界值为276.5μg/L,AUC为0.81,灵敏度为75.0%。见表2及图1。
2.2.2血清CK 孕晚期植入组、非植入组、对照组均无差异(P>0.05),见表2。

图1 孕中期及孕晚期血清AFP检测结果ROC曲线图
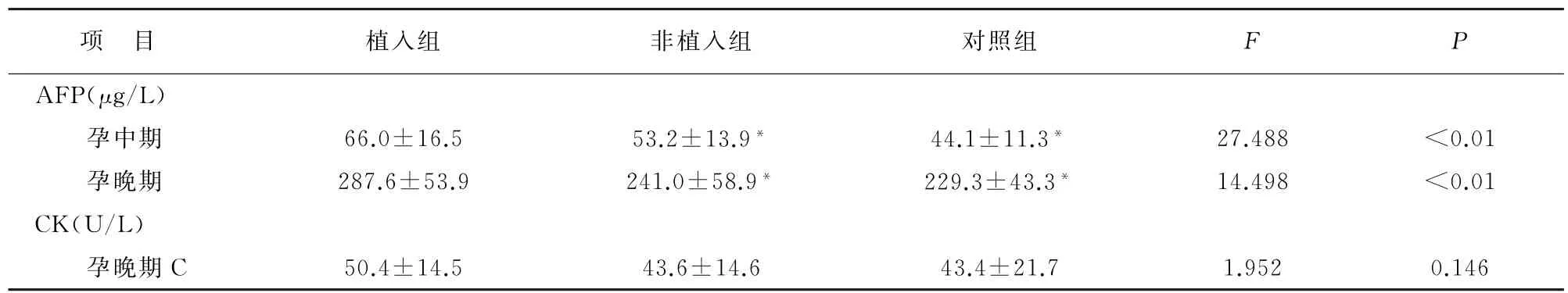
表2 血清AFP及血清CK水平比较
2.2.3影像学 依据剖宫产术中所见及术后病理组织学结果,超声检查及MRI检查前置胎盘合并胎盘植入的诊断灵敏度分别为72.2%及83.3%。见表3。
2.2.4联合诊断 血清AFP联合影像学平行联合诊断灵敏度94.4%。见表3。

表3 血清AFP、影像学及其联合的诊断价值比较[%(例)]
3 讨论
前置胎盘合并胎盘植入的临床表现缺乏特异性,产前诊断困难,目前主要方法包括超声、MRI及血清学指标检查。超声结果为阴性或胎盘附着于子宫后壁时,胎儿MRI检查有着重要诊断价值。但MRI检查也受扫描层厚薄、扫描体位及个体目测差异等影响,且价格昂贵、孕妇难以承受长时间的仰卧位,限制了其临床推广[10-11]。母体血清生化指标简单无创,为前置胎盘合并胎盘植入的产前诊断提供了新思路。
AFP是胎儿血清中最常见的球蛋白,由妊娠早期的卵黄囊和妊娠晚期的胎儿肝脏产生,妊娠28~32周逐渐稳定,产后1~2周降至正常水平,因其为胚胎性相关蛋白,在临床上主要用于预测胎儿质量。正常孕妇体内的AFP水平较非妊娠期稍高,在发生胎盘植入时,母胎屏障被破坏,胎儿血循环中的AFP通过胎盘屏障进入母体内,进而导致母体内的AFP明显升高,可达到正常的5~10倍[12]。因此,许多学者认为,当孕妇血清AFP明显升高时,在排除胎儿畸形的情况下,应考虑胎盘植入可能[12-14]。雷晓真等[12]认为,AFP值>299.6ng/ml时,应高度怀疑凶险型前置胎盘伴胎盘植入。金日男等[15]的研究发现产前诊断胎盘植入的AFP界值为247.90 ng/ml。本研究发现,孕中、晚期AFP值在前置胎盘植入组明显升高,与其余两组之间有差异,且孕晚期AFP对于前置胎盘合并胎盘植入的预测价值略高于孕中期AFP。
CK广泛分布于人体各种器官和组织中,子宫肌层也含有CK,当滋养层侵入子宫肌层导致肌肉损伤后,CK将被释放到母体血清中[16]。Ophir等[17]研究认为,对于有胎盘植入高危因素的患者,CK血清水平无法解释的升高应提醒临床医生胎盘植入的可能,母体血清CK浓度可作为超声检查诊断胎盘植入很好的补充。但本研究中,孕晚期CK的值在3组间均无差异,与许多学者的结论不符,笔者认为CK在前置胎盘合并胎盘植入中诊断价值仍值得探讨。
本研究还发现单独的影像学诊断的灵敏度及特异度并不是很高,在联合孕中期及孕晚期母体血清AFP后,其灵敏度、特异度及诊断符合率等均有所提高,优于单项指标检测,对临床诊断具有价值。本研究中系列试验诊断符合率稍高,但仍需大样本量继续分析探究。MRI矢状位T2WI序列是观察前置胎盘最佳序列,尤其是对于超声诊断困难的位于后壁的胎盘[18]。华建军等[19]对36例最终确诊为前置胎盘伴胎盘植入患者分析,MRI诊断前置胎盘伴胎盘植入的敏感度为53.3%,特异度为95.2%,阳性预测值为88.9%,阴性预测值为74.1%,其认为利用磁共振脂肪抑制T2WI可提高前置胎盘的诊断准确率,是超声检查有效的补充手段。金日男等[12]研究认为,AFP及彩色多普勒超声联合可显著提高胎盘植入产前诊断的灵敏度,优于单项检测。另刘彬等[7]选取90例凶险型前置胎盘患者于孕晚期行母体AFP、CK血清学检查及MRI检查,植入组及非植入组MRI及血清学检查联合诊断的灵敏度(90.6%)、阴性预测值(86.8%)和符合率(90.00%)均显著高于单独检查,漏诊率(9.43%)显著降低。
综上所述,前置胎盘合并胎盘植入的母体血清学预测指标很多,但是无论哪项因子都不能作为单独的诊断指标,建议结合高危因素及影像学结果等作为筛查手段,以提高胎盘植入的产前诊断率,有益于术前充分评估以及基层医院对高危孕妇及时转诊治疗,对减少子宫切除率、降低孕产妇死亡率有重要意义。

