CRISPR/Cas9技术的研究进展及其在肺癌研究中的应用
朱奕骋
真核细胞基因组包含数十亿个DNA 碱基,其编辑十分困难。对基因组进行操作的技术突破之一,是通过同源重组(HR)进行基因靶向的开发。HR 介导的靶向技术通过操纵生殖系感受态干细胞,促进了敲入和敲除动物模型的产生,从而极大地推动了生物学研究的许多领域的发展。
基于核酸酶的基因编辑技术十分有潜力。其中的CRISPR/Cas9 技术,几乎可以靶向任何基因,且操作较为简便,敲除效率较高。本文简介了CRISPR/Cas9 技术的原理及其研究进展,并讨论了其在肺癌研究中的应用。
1 CRISPR/Cas9 技术概述
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/Cas9)是一种较为新颖的基因编辑技术,在科研领域及医疗领域有着十分广泛的应用。
1.1 CRISPR/Cas9 技术的产生背景
CRISPR/Cas9 技术可能是基因编辑领域近10 年来最伟大的成果之一。1987 年,日本的科学家发现了微生物中的串联间隔重复序列,但他们的报道并没有引起科学界的重视。
2002 年,Jansen 等这种序列其命名为CRISPR。此外,研究表明,局部DNA 双链断裂(DSB)可以触发易出错的非同源末端连接(NHEJ)修复途径。这些早期的基因组编辑研究,让DSB 诱导的HR 和NHEJ 成为真核生物基因组修饰的重要方法[1]。
2005 年,在科学家对分隔单个直接重复序列的间隔子序列进行分析的时候,他们发现,这些序列可能与噬菌体相关。他们推测,CRISPR 可能与微生物的免疫记忆和防御机制相关,不过,科学家仍未弄清,间隔子是如何发挥作用的。他们提出了一些假设,认为CRISPR 间隔子可能充当小RNA 向导,以降解的病毒转录物[2]。
2008 年,科学家又发现细菌CRISPR 系统能阻止外源DNA 的入侵,并验证了其功能[3]。
可以说,CRISPR 的发展主要经历了以下阶段(图1):

图1 CRISPR-Cas9 基因编辑技术的发展阶段
1.2 CRISPR 系统
CRISPR 系统包括一系列Cas 蛋白,这些蛋白可以协助CRISPR 系统,使其更好地发挥免疫作用。在噬菌体入侵细菌时,Cas 蛋白将其识别,并整合到宿主的基因组上。在噬菌体第二次入侵时,CRISPR系统可以准确地识别外源噬菌体,并利用Cas 蛋白的内切酶活性切断其DNA,使外源噬菌体失去毒力(图2)。
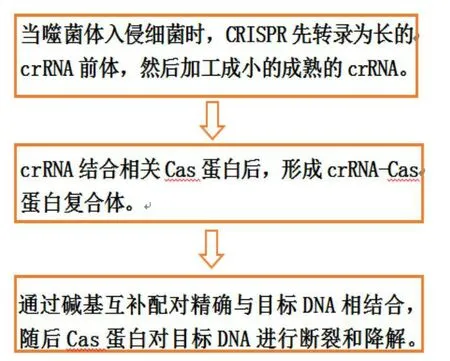
图2 CRISPR-Cas9技术的操作示意图
1.3 CRISPR/Cas9 技术的应用
利用基因工程技术,我们可以改变细胞的遗传和表观遗传特征,从而开展基础生物学研究和医学研究。利用基因编辑技术,我们可以在动物或细胞模型中快速有效地诱导变异,从而改变其动物或细胞的功能。基因编辑也会促进有用的合成材料的生产,例如,硅基硅藻可以用于递送口服药物。此外,对农作物进行精确的基因编辑,可以提高其或病原体感染的抗性,提高食品的安全性。在医药领域,基因编辑可以弥补体细胞中的遗传或表观遗传缺陷,根治遗传病,这就是基因手术。最后,运用基因编辑技术改造细胞,可以让细菌高效地生产药物前体,显著降低治疗的成本[4]。
CRISPR/Cas9 技术在肿瘤的治疗中扮演着重要的角色。与其他肿瘤相比,肺癌的发病率和死亡率十分惊人。利用CRISPR/Cas9 技术,我们可以研究某些基因在肺癌的发生中的作用(图3),助力肺癌的诊断与治疗。
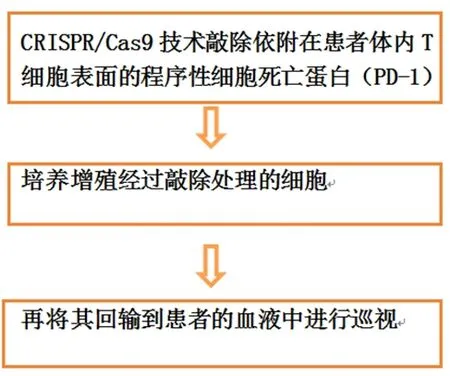
图3 CRISPR/Cas9技术治疗肺癌的流程图
2 CRISPR/Cas9 技术的原理
CRISPR/Cas9 技术的基本原理是,改造天然的Cas 蛋白,从而构建一个更稳定的核酸内切酶,让它在特定位置切断双链DNA,在DNA的修复的过程中,基因会发生突变,利用这个过程,科学家可以对基因进行定点改造。
在运用CRISPR/Cas9 技术对基因进行编辑时,必须首先将Cas9 核酸酶蛋白和gRNA 输送到靶细胞中。这通常是通过向受体细胞中转染表达DNA 的质粒来实现的,但我们也可以通过递送RNA 达到这一目的。gRNA 会将Cas9 引导至与gRNA 中的“间隔”序列匹配的靶DNA“原间隔子”序列处[5]。在原间隔子的旁边,通常存在一段原间隔物相邻基序(PAM),对于最常用的Cas9 蛋白,这段序列为NGG。如果间隔子和原间隔子相同,或在间隔子的5'末端仅有几个错配,Cas9 将切割两条DNA 链,造成双链断裂(图4)。
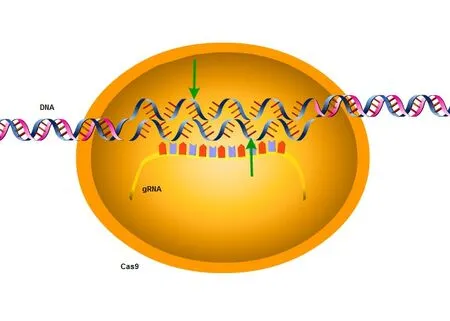
图4 CRISPR/Cas9技术的原理
3 CRISPR/Cas9 技术的研究进展
CRISPR 系统由sgRNA 和Cas 蛋白组成。在sgRNA 的指导下,Cas 蛋白定位到基因组的目标位置,从而实现精确的遗传修饰。修复DSB 的DNA 修复机制有两种高度保守的途径:NHEJ 和HR。NHEJ 是易于出错的修复机制,因为修复后的DNA 通常在靶位点周围有一个小的插入缺失,从而导致基因破坏。因此,我们通常利用NHEJ 使致病基因失活,改变其表达水平。相反,HR 是一种特定的DNA 修复机制,在存在修复模板的情况下,HR 将纠正基因突变或帮助我们插入合成序列。目前,CRISPR/Cas 系统已用于基因敲除、基因突变、转录激活和基因筛选等[6]。
许多科学家致力于对脱靶效应的研究,他们尝试改进Cas9,从而减少脱靶事件的发生。一些研究人员发现,产生单链断裂(SSB)可能是一种有效的方式。由于DNA 单链断裂是通过高保真碱基切除修复(BER)途径修复的,Cas9 切口酶可用于更特异性的NHEJ 和HR。
为了提高靶标DSB 的特异性,可以使用类似于二聚ZFN 或TALEN 的双切口法,来增加在靶DNA 中特异性识别的碱基总数。除双切口策略外,被人为截短的sgRNA,也会显著提高SpCas9 的靶向特异性,这可能是因为它们对错配更加敏感。我们可以在使用多重切口策略的同时应用这些截短的sgRNA,以进一步降低脱靶的概率。
4 CRISPR/Cas9 技术在肺癌研究中的应用
在过去的几十年中,基因疗法是癌症研究中最热门的领域之一。这是因为,癌症的发生与进展,与遗传有着密切的关系。与传统的治疗方法相比,基因疗法可以更彻底地治疗癌症,而且其副作用很小。使用CRISPR/Cas9 系统对内源基因座进行靶向修饰,可以克服传统方法的局限性。这一技术的不断成熟,使研究人员能够进一步探索癌症研究中的未知领域,为无数肿瘤患者带来了福音。
4.1 CRISPR/Cas9 技术在构建肺癌动物模型中的应用
构建肺癌动物模型一直是一项艰巨的任务,与CRISPR 相关的新技术浪潮,使研究人员能够构建更多满足研究需要的动物模型。将一些抑癌基因敲除,可能有助于构建在功能和结构上类似于天然肿瘤的肺癌动物模型。利用CRISPR/Cas9 技术,可以高效地敲除感兴趣的基因,从而构建相关的动物模型。一些科学家应用CRISPR/Cas9 技术敲除了3 种主要的肿瘤抑制基因TRP53、PTEN 和VHL,成功地构建了肺癌模型。在对某些肺癌相关基因的研究过程中,我们也可以将CRISPR/Cas9 技术与其他基因编辑技术结合使用[7]。
4.2 CRISPR/Cas9 技术在肺癌治疗中的应用
迄今为止,全世界有13 项将CRISPR 作为癌症治疗的干预手段的临床试验(来源:clinicaltrials.gov)。在离体基因编辑研究中,可以通过敲除T 淋巴细胞中某些降低其靶向效率的基因,来提高T 细胞的有效性;也可以将癌细胞抗原特异的嵌合抗原受体连接到T 淋巴细胞表面,以增加其靶向特异性,从而提高其靶向效率。
到目前为止,CRISPR/Cas9 技术作为肺癌的干预手段,仅在一项临床试验中得以实施。该试验目前正在四川大学进行。在这项试验中,研究人员评估PD-1 基因敲除的T 细胞治疗转移性非小细胞肺癌的安全性(试验编号:NCT02793856)。这项研究的基础是PD-1 基因的功能,PD-1 基因是一种促进程序性细胞死亡的基因,已被证明仅在活化的T 细胞中表达,并作为免疫检查点。因此,敲除PD-1基因将延长T 细胞的寿命,并通过破坏T 细胞周期检查点抑制剂来防止活化的T 细胞死亡。这将增加血液中活化的T 细胞计数,从而抑制肿瘤的进展。在上述研究中,研究人员从外周血中收集自体来源的T 细胞,并使用CRISPR/Cas9 系统特异性地敲除PD-1 基因。实现这一目标后,研究人员将进一步扩增并选择自体来源的PD-1 基因敲除的T 淋巴细胞。将这些T 细胞分批回输体内后,研究人员将评估治疗效果[8]。
5 结语
基于基因疗法的技术有可能在癌症研究中带来突破,而CRISPR 是一种非常有针对性和有效的工具,有潜力将其转化为可用的疗法。事实证明,与ZFN 和TALENs 等其他著名的基因治疗技术相比,CRISPR 具有许多优势。虽然现在可用的其他治疗方法只是暂时的,随着时间的流逝会逐渐消失,但是基因治疗是遗传的,可以永久使用,就像将治疗方法硬编码到体内一样。这具有创造疫苗和永久治愈的潜力。除治疗方面的应用外,CRISPR 也是了解我们细胞中代谢反应及信号通路的一种重要工具。我们应当充分利用CRISPR/Cas9 技术,更深入地研究与肺癌相关基因的功能,助力肿瘤治疗学的发展。

