乙烯信号传导途径因子OsEIL6调控水稻抗稻瘟病反应
赵玉丹 朱晓颖 徐国娟 王旭丽
摘要 稻瘟病(rice blast)是水稻生产上最严重的病害之一。抗病相关基因的挖掘对稻瘟病的防治具有重要意义。研究表明植物EIN3/EIL家族基因在抗病过程中发挥着重要作用。本研究采用RNAi技术探究OsEIL6参与的水稻抗稻瘟病反应。稻瘟菌侵染时基因表达谱检测结果表明,OsEIL6在水稻和稻瘟菌非亲和组合中受到诱导表达。稻瘟菌接种结果显示,水稻OsEIL6沉默株系和野生型植株‘TG394相比抗性下降;实时荧光定量RT-PCR结果分析表明,OsEIL6的表达量下降导致乙烯合成途径中OsACO1和乙烯信号传导途径的OsERF063和OsERF073的转录水平下降。亚细胞定位研究发现该基因定位于水稻细胞质。OsEIL6沉默株系中ROS合成途径标记基因OsrbohA和OsrbohB的表达量均明显下调,表明该基因可能通过影响ROS的合成调控水稻抗稻瘟病反应。本研究结果将有助于进一步揭示OsEIL6参与的乙烯信号传导途径介导的水稻抗稻瘟病反应机制。
关键词 水稻; 稻瘟病; 抗病性; 乙烯; OsEIL6
中图分类号: S 432.1
S 435.121.45
文献标识码: A
DOI: 10.16688/j.zwbh.2020153
OsEIL6 is involved in regulating rice resistance to Magnaporthe oryzae
ZHAO Yudan#, ZHU Xiaoying#, XU Guojuan, WANG Xuli*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Rice blast is one of the most destructive rice diseases. Understanding the function of rice immune responsive genes to the blast fungus Magnaporthe oryzae is essential for effective disease management. Previous research revealed that ethylene-insensitive 3 (EIN3) /ethylene-insensitive 3-like (EIL) gene plays essential roles in plant defense responses. In this study, we investigated the role of OsEIL6 in rice resistance to M.oryzae. Expression of OsEIL6 was significantly induced in rice after infection with an incompatible blast isolate C9240. Silencing of OsEIL6 in transgenic rice enhanced plant susceptibility to M.oryzae. Quantitative RT-PCR assays showed that the transcript levels of OsACO1 in ethylene biosynthesis, and two key downstream genes, OsERF063 and OsERF073, in ethylene signaling pathways, ware down-regulated in the OsEIL6-RNAi plants. Subcellular localization analyses showed that the OsEIL6 protein was localized in the cytoplasm of rice cells. In addition, the expression levels of OsrbohA and OsrbohB, two key genes for ROS biosynthesis, were down-regulated in the OsEIL6-RNAi plants, suggesting that OsEIL6 may mediate rice resistance by affecting the ROS production. Our findings will contribute to further understanding of the mechanism of OsEIL6-mediated resistance to M.oryzae.
Key words
Oryza sativa; rice blast; disease resistance; ethylene; OsEIL6
水稻是最重要的粮食作物之一,世界上有超过一半的人口以其为主粮[1]。因此,水稻的丰产、稳产对粮食安全具有极其重要的战略意义。水稻稻瘟病危害重、防治難,已成为影响水稻丰产稳产的关键因素。据统计,全球由于稻瘟病危害造成的产量损失高达水稻年总产的10%~30%[2-3]。目前,防治稻瘟病最为经济有效和环保的措施是种植抗病品种,而抗病品种的培育则依赖于全面深入认识水稻抗病机理。
为了抵御病原物的入侵,植物进化出两个层次的免疫反应PTI(PAMP-triggered immunity)和ETI(effector-triggered immunity)[4]。而在PTI和ETI所激活的下游免疫反应中,激素信号途径发挥着重要作用,其中乙烯(ethylene, ET)信号扮演重要角色[1, 4]。乙烯是一种小分子气体植物激素,参与调控植物生命活动的许多过程,如促进叶片和果实成熟,以及植物对生物和逆境胁迫的反应等。在模式植物拟南芥中,结合遗传学、生物化学和分子生物学等技术,科学家们发现了一条近乎线性的乙烯信号传导途径[5]。近年来,在水稻中也相继鉴定了乙烯信号传导的關键因子,解析了水稻乙烯信号传导途径[6]。研究表明组氨酸激酶(histidine kinase)家族类受体蛋白识别乙烯后可失去对OsCTR1的抑制,随后触发转录因子EIN2(ethylene insensitive 2)及其下游EIN3/EIL(ethylene insensitive 3/EIN3-like)介导的级联反应[7]。最近,Zhao等在水稻中鉴定了一个乙烯信号传导的新组分—MHZ1/OsHK1,其介导一条平行于OsEIN2-OsEIL1通路的乙烯信号传导新途径,但乙烯对MHZ1转录的促进仍然依赖于OsEIL1[8]。综上,EIN3/EIL家族基因处于乙烯信号传导的中枢位置,决定着乙烯下游响应基因的表达。
EIN3/EIL家族基因在调控植物的抗病反应中发挥着重要作用[9-11]。在拟南芥中EIN3和EIL1可抑制SA合成基因ICS/SID2的表达,导致SA合成量减少,负调控拟南芥对丁香假单胞菌Pseudomonas syringae的抗性[9]。其次,EIN3和EIL1可通过与JA信号通路的MYC2蛋白相互作用,整合ET和JA信号,正调控拟南芥对灰葡萄孢Botrytis cinerea的抗性[10]。水稻该家族基因OsEIL1表达量的下降可引起乙烯含量的下降和对稻瘟病抗性的减弱,OsEIL1通过靶标ROS和茉莉酸(jasmonate, JA)合成的关键酶基因来介导其正向调控水稻抗稻瘟病反应[11]。由此可见,EIN3/EIL家族基因既可正调控又可负调控植物抗病反应,其作用结果与病菌和寄主间相互作用的具体特点有关。水稻基因组EIN3/EIL家族共有6个基因OsEIL1-6[12-13],本实验室报道了OsEIL2参与调控水稻抗纹枯病反应[14],进一步检测发现OsEIL6的表达受稻瘟菌诱导。本研究将探究OsEIL6参与调控的水稻抗稻瘟病反应,研究结果将有助于阐明水稻中乙烯信号途径所参与的抗病反应过程,并可为水稻稻瘟病防控提供新思路。
1 材料与方法
1.1 材料与试剂
水稻品种‘日本晴以及稻瘟菌亲和小种RO1-1和非亲和小种C9240为本实验室保存,转化用水稻品种‘泰粳394(‘TG394)为扬州大学左示敏老师惠赠。试验所用亚细胞定位载体pYBA-1132和蛋白表达载体pRTV-nHA均为本实验室保存。引物合成和测序由北京擎科生物公司完成。
1.2 试验方法
1.2.1 载体构建
根据MSU(http:∥rice.plantbiology.msu.edu/)数据库中的OsEIL6基因序列,设计特异性引物OsEIL6-F和OsEIL6-R(表1)扩增获得OsEIL6基因全长。
为了确定OsEIL6的亚细胞定位,设计特异性引物pYBA1132-OsEIL6-F和pYBA1132-OsEIL6-R(表1)扩增获得带有酶切位点的片段,采用同源重组的方法将扩增得到的片段连接到融合GFP标签的表达载体pYBA1132上,获得亚细胞定位表达载体pYBA1132-OsEIL6。
为了表达和纯化OsEIL6蛋白,用特异性引物pRTV-nHA-OsEIL6-F和pRTV-nHA-OsEIL6-R(表1)扩增获得带有酶切位点的片段,同源重组连接到载体pRTV-nHA上,获得蛋白表达载体pRTV-nHA-OsEIL6。
1.2.2 水稻转基因材料的单拷贝纯合株系的获得
按照Park等[15]的试验方法,将供试的水稻材料种子经表面消毒后放置于1/2 MS培养基上进行催芽。在T2代培养时,选取阳性株和阴性株比例为3∶1的转基因株系,铺种于含有潮霉素的1/2 MS培养基上生长,筛选出阳性率为100%的转基因株系即为单拷贝纯合株系,用于后续的接种试验。
1.2.3 稻瘟菌接种与病情调查
参照Yang等[11]的方法,并略作改动。选用培养3周的水稻苗用于接种。将配制好的浓度为1.2×105个/mL的供试菌株孢子悬浮液均匀地喷洒在叶片表面,26~28℃条件下黑暗保湿培养24 h后,转入光照条件下继续培养,7 d左右调查病情。采用Photoshop软件对所有拍照病叶进行病斑面积计算,并通过GraphPad Prism软件对数据进行分析作图,进行多重比较和单因素方差分析。
1.2.4 RNA提取、反转录及qRT-PCR分析
采用Trizol法提取水稻叶片总RNA,用DNase I去除DNA后用反转录试剂盒(Promega)反转录为cDNA。选用ABI-7500型荧光定量PCR仪进行定量检测。qRT-PCR的体系为:2×SYBR Premix ExTaq 10 μL,稀释后的cDNA 5 μL,正反向引物各1 μL,最后用ddH2O补齐至20 μL。qRT-PCR的程序为:95℃ 30 s;95℃ 15 s,55℃ 30 s,72℃ 30 s,反应共进行48个循环;继续进行熔解曲线反应(55℃,81个循环),检测产物的单一性。以Ubiquitin作为内参基因,根据相对阈值法(2-ΔCT)计算基因的表达量,每个样品做3次重复,数据选取3次重复的平均值,通过GraphPad Prism软件进行多重比较和单因素方差分析。
1.2.5 水稻原生质体的制备与转化
‘日本晴水稻种子经75%乙醇浸泡1 min,40%次氯酸钠 浸泡30 min,无菌水清洗3遍后,播种在1/2 MS培养基上,放置在26~28℃培养箱黑暗培养10 d左右。按照Zhang等[16]原生质体提取和亚细胞定位的方法,将获得的水稻黄化苗茎秆切成长度为0.5 mm左右的茎段,随后转移至酶解液(1.0%纤维素酶RS,0.5%离析酶R10,0.6 mol/L甘露醇,10 mmol/L MES,pH调至5.7,10 mmol/L CaCl2和0.1% BSA)中28℃酶解5~7 h,40 μm尼龙筛过滤收集原生质体,利用PEG介导转化法将目的质粒转化到原生质体中,26~28℃培养箱中培养18~24 h后,激光共聚焦显微镜下观察拍照。
1.2.6 液相色谱-质谱联用 (liquid chromatography-mass spectrometry, LC-MS)方法
利用PEG介导转化法将目的质粒pRTV-nHA-OsEIL6转化到水稻原生质体中,在原生质体中表达带有HA标签的OsEIL6蛋白,26~28℃培养箱中培养16~24 h后,利用非变性蛋白提取液提取水稻原生质体蛋白,利用免疫沉淀(IP)技术富集带有HA标签的OsEIL6蛋白,蛋白凝胶电泳5 min后回收胶条,送至中科新生命科技有限公司进行液相色谱-质谱联用(LC-MS)分析,鉴定混合物中的蛋白。
2 结果与分析
2.1 水稻OsEIL6在稻瘟病菌非亲和小种侵染时诱导表达
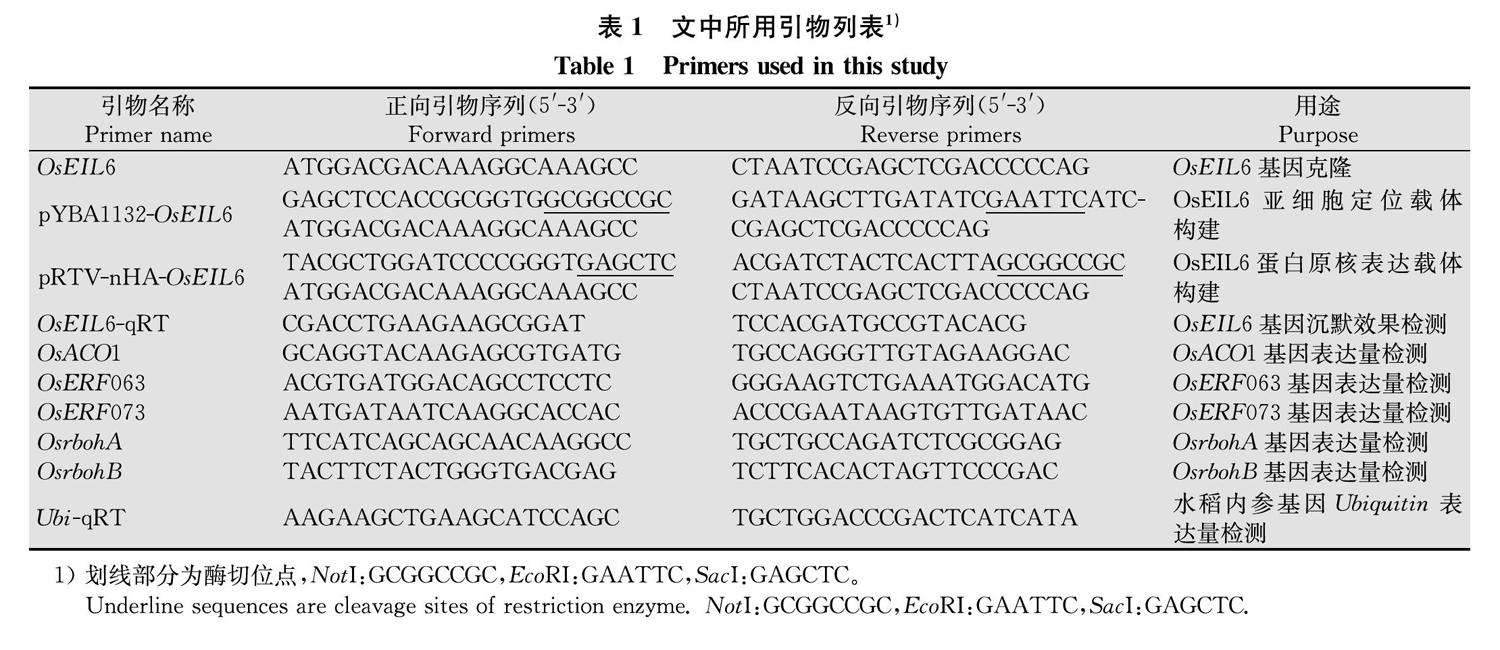
以‘日本晴为材料,采用喷雾法分别接种稻瘟病菌亲和小种RO1-1和非亲和小种C9240,并以清水处理为对照,检测OsEIL6在接种0、12、24、48、72、96 h和120 h的表达情况。如图1a所示,在非亲和小种C9240接种12 h时,OsEIL6表达量显著升高,上调约6倍;而在亲和小种RO1-1接种时,OsEIL6的表达量无明显变化。由此可见,水稻基因OsEIL6在稻瘟病菌侵染时被诱导表达。
2.2 OsEIL6-RNAi转基因材料基因沉默效果鉴定
通过实时荧光定量RT-PCR的方法对获得的OsEIL6-RNAi材料的基因沉默效果进行鉴定。如图1b所示。与野生型‘TG394水稻相比,OsEIL6在RNAi转基因材料3、5、6号株系中的表达极显著下降,表明OsEIL6在其RNAi植株中的表达受到抑制。在继代培养的T2代获得了OsEIL6-RNAi转基因纯合株系,为后续的抗病性表型检测提供了可靠材料。
2.3 OsEIL6在水稻抗稻瘟病反应中的作用
OsEIL6-RNAi转基因材料对稻瘟菌抗性的鉴定结果如图1c,d所示。接种稻瘟菌7 d后,与野生型‘TG394水稻相比,OsEIL6-RNAi纯合株系的叶片在病斑数量和病斑面积上都有明显的差异。OsEIL6-RNAi转基因材料的病斑面积明显大于‘TG394,其中发病最严重的株系OsEIL6-RNAi-3的叶片病斑面积可达‘TG394病斑面积的2.5倍(图1d)。以上结果表明OsEIL6在水稻抗稻瘟病侵染过程中起着重要作用。
2.4 OsEIL6定位于水稻细胞质
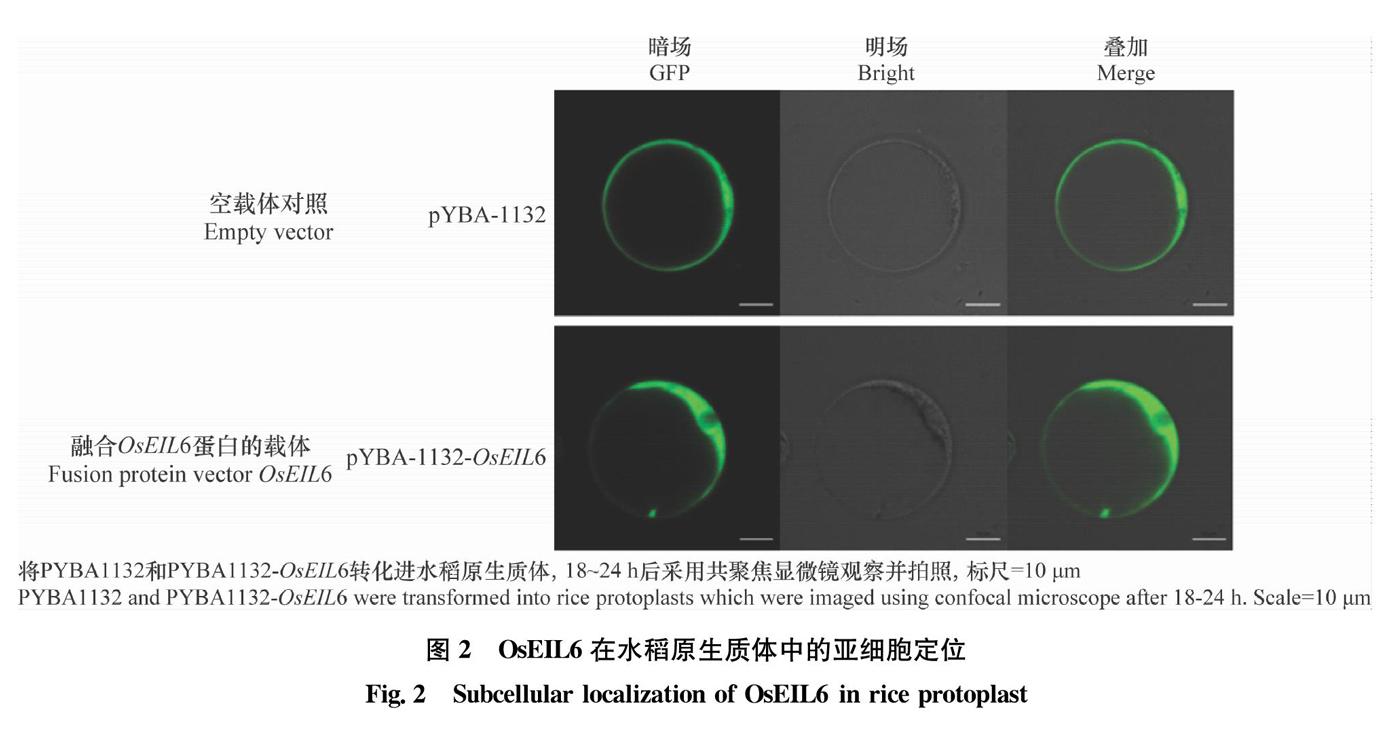
为了明确OsEIL6的功能,构建OsEIL6融合GFP标签的表达载体pYBA1132-OsEIL6,转化水稻原生质体后进行激光共聚焦显微观察。结果显示空白载体pYBA1132的绿色荧光正常表达,并分布于全细胞(图2)。经pYBA1132-OsEIL6侵染后的水稻原生质体,荧光特异性地出现在细胞质部位,而细胞核处未观察到荧光信号(图2)。该结果表明OsEIL6定位于水稻原生质体的细胞质。
2.5 OsEIL6正向调控乙烯信号途径基因的表达
为了揭示水稻中OsEIL6可能参与的抗病信号途径,本研究检测了乙烯合成途径标记基因OsACO1(1-氨基环丙烷-1-羧酸氧化酶)和乙烯信号传导途径标记基因OsERF063、OsERF073在OsEIL6沉默材料中的转录水平。结果如图3所示,与‘TG394相比,OsEIL6基因沉默能不同程度的降低以上3个基因的表达量。其中OsACO1的表达量下降了50%~80%(图3a),OsERF063和OsERF073的表达量也均显著下调(图3b,c),其中OsERF063的表达量降低了75%~80%。以上结果表明,OsEIL6正向调控乙烯信号途径标记基因的表達。
2.6 OsEIL6正向调控水稻活性氧(ROS)合成途径基因的表达
进一步检测OsEIL6沉默材料中ROS合成途径NADPH氧化酶基因OsrbohA和OsrbohB的转录水平,结果发现在OsEIL6-RNAi材料中,OsrbohA和OsrbohB的表达量均有不同程度的下降,虽然OsrbohB表达量的下降程度低于OsrbohA,但也达到了显著差异水平(图4)。上述结果表明,OsEIL6的沉默抑制活性氧合成途径关键酶基因表达,进而降低水稻对稻瘟病的抗性。
2.7 OsEIL6的互作蛋白研究
本研究采用LC-MS的方法筛选OsEIL6在水稻原生质体中的互作蛋白。质谱分析结果见表2,共获得10个可能与OsEIL6互作的候选蛋白。通过基因序列信息和功能分析,发现14-3-3蛋白和OsWRKY29都是和植物抗病性直接相关的蛋白。另外,两个受体类蛋白质激酶(LOC_Os05g07740.1和LOC_Os05g44930.1)以及一个丝氨酸苏氨酸蛋白质激酶(LOC_Os01g66860.4)很可能会通过磷酸化修饰调控OsEIL6的功能。而F-box类泛素连接酶(LOC_Os12g27750.1)则可通过26S蛋白酶体降解途径调节OsEIL6的蛋白水平。后续将会进一步验证候选蛋白与OsEIL6之间的相互作用关系,以及研究它们参与水稻抗稻瘟病反应的功能。
3 讨论
在水稻6个EIN3/EIL家族基因中[12-13],OsEIL1和OsEIL2 与拟南芥EIN3的EIL1和EIL2亚族相似性最高,OsEIL3和OsEIL4与SLIM1/EIL3关系密切,可能有相同的功能,而OsEIL5和OsEIL6与报道的EIL亲缘关系最远[12]。本研究发现,OsEIL6沉默材料中乙烯合成途径基因OsACO1以及乙烯信号传导途径基因OsERF063和OsERF073的表达量均显著下降,且对稻瘟病抗性减弱,表明OsEIL6参与了乙烯信号途径并正调控水稻抗稻瘟病。这一研究结果和已报道的OsEIL1介导的水稻抗稻瘟病的功能相一致[11, 17]。Yang等报道OsEIL1超表达植株对稻瘟病抗性增强,Helliwell等发现OsEIL1-RNAi植株对稻瘟病的抗性减弱,表明OsEIL1正调控水稻抗稻瘟病。此外,Yang等还发现OsEIL1作为转录因子可直接靶标NADPH氧化酶基因OsrbohA和OsrbohB的启动子区域并激活其转录,从而调控ROS产生所参与的水稻对稻瘟病的抗性[18]。本研究进一步检测了OsEIL6沉默材料中ROS合成途径标记基因OsrbohA和OsrbohB的表达情況,发现其表达均有不同程度的下降。因此OsEIL6可能通过影响ROS的合成,进而参与水稻的抗病反应过程。
一般来说,SA信号传导途径能够帮助植株有效抵抗活体营养型病菌,而植物抵抗死体营养型病菌则主要依赖于ET和JA信号途径[19]。激素之间协同或拮抗的作用,使植物体内的信号传导途径更加丰富,所以当植物受到病原物侵染时可以快速精准地调控体内的防卫反应。在拟南芥中,研究发现EIN3和EIL1可直接作用于SA合成基因SID2(salicylic acid induction deficient2)的启动子区,负调控SID2的表达和SA的合成,从而抑制植物对活体营养型病原菌的免疫反应[9]。而JA信号途径的转录激活子MYC2和EIN3可相互结合,从而影响了各自的转录活性,导致JA和ET信号途径间的相互拮抗作用[20]。因此,拟南芥中EIN3/EIL是控制ET和其他两种激素JA和SA信号传导途径交叉的节点,并能够调节不同激素信号途径对不同类型病原菌的侵染做出反应。因此,研究水稻中OsEILs成员是否同样处于调节3种激素信号传导途径的关键节点位置,以及其突变体材料对不同类型病原菌如死体营养型纹枯菌和活体营养型白叶枯菌的抗感反应,将对制定水稻的抗病育种策略具有重要意义。
水稻原生质体亚细胞定位分析发现,OsEIL6并未定位于水稻细胞核,而是定位于细胞质。这一研究结果不同于EIN3家族OsEIL1和OsEIL2的细胞核定位结果[14-15],因此,OsEIL6是否作为转录因子执行功能还需要后续进一步研究。蛋白质之间的相互作用是细胞生化反应网络的重要组成部分,对调控细胞及其信号具有重要意义。本研究利用LC-MS的方法寻找OsEIL6的互作蛋白,筛选到10个可能与水稻抗病相关的互作蛋白。后续将进一步研究这些互作蛋白在水稻抗病过程中的作用,进一步解析OsEIL6所介导水稻抗病分子机制。
综上,本研究发现OsEIL6定位于水稻细胞质,且正调控水稻对稻瘟菌的抗性反应。该结果对于进一步研究OsEIL6的生物学特性和功能,明确其在激素信号途径中的地位以及OsEIL6所调控的水稻抗病信号分子网络具有重要作用,并为水稻稻瘟病防控提供新思路。
参考文献
[1] LIU Wende, LIU Jinling, TRIPLETT L, et al. Novel insights into rice innate immunity against bacterial and fungal pathogens [J]. Annual Review of Phytopathology, 2014, 52(1):213-241.
[2] TALBOT N J. On the trail of a cereal killer: Exploring the biology of Magnaporthe grisea [J]. Annual Review of Microbiology, 2003, 57(1):177-202.
[3] DEAN R A, TALBOT N J, EBBOLE D J, et al. A P-type ATPase required for rice blast disease and induction of host resistance [J]. Nature, 2006, 440 (7083): 535-539.
[4] GRANT M R, JONES J D G. Hormone (dis)harmony moulds plant health and disease [J]. Science, 2009, 324(5928): 750-752.
[5] JU Chuanli, CHANG Caren. Mechanistic insights in ethylene perception and signal transduction [J]. Plant Physiology, 2015, 169(1): 85-95.
[6] KLEE H J. Ethylene signal transduction moving beyond Arabidopsis [J]. Plant Physiology, 2004, 135(2):660-667.
[7] YANG Chao, LU Xiang, MA Biao, et al. Ethylene signaling in rice and Arabidopsis: conserved and diverged aspects [J]. Molecular Plant, 2015, 8 (4): 495-505.
[8] ZHAO He, DUAN Kaixuan, MA Biao, et al. Histidine kinase MHZ1/OsHK1 interacts with ethylene receptors to regulate root growth in rice [J/OL]. Nature Communications, 2020, 11(1):518. DOI: 10.1038/s41467-020-14313-0.
[9] CHEN Huamin, LI Xue, CHINTAMANANI S, et al. ETHYLENE INSENSITIVE3 and ETHYLENE INSENSITIVE3-LIKE1 repress SALICYLIC ACID INDUCTION DEFICIENT2 expression to negatively regulate plant innate immunity in Arabidopsis [J]. The Plant Cell, 2009, 21(8): 2527-2540.
[10]ZHU Ziqiang, AN Fengying, FENG Ying, et al. Derepression of ethylene-stabilized transcription factors (EIN3/EIL1) mediates jasmonate and ethylene signaling synergy in Arabidopsis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(30):12539-12544.
[11]YANG Chao, LI Wen, CAO Jidong, et al. Activation of ethylene signaling pathways enhances disease resistance by regulating ROS and phytoalexin production in rice [J]. The Plant Journal, 2017, 89(2):338-353.
[12]MAO Chuanzao, WANG Shaomin, JIA Qiaojun, et al. OsEIL1, a rice homolog of the Arabidopsis EIN3 regulates the ethylene response as a positive component [J]. Plant Molecular Biology, 2006, 61(1/2): 141-152.
[13]HIRAGA S, SASAKI K, HIBI T, et al. Involvement of two rice ETHYLENE INSENSITIVE3-LIKE genes in wound signaling [J]. Molecular Genetics & Genomics, 2009, 282(5): 517-529.
[14]石彦龙,徐国娟, 王旭丽,等. 转录因子OsEIL2正调控水稻对纹枯病的抗性[J].植物保护, 2017, 43(1):46-53.
[15]PARK C H, CHEN Songbiao, SHIRSEKAR G, et al. The Magnaporthe oryzae effector AvrPiz-t targets the RING E3 ubiquitin ligase APIP6 to suppress pathogen-associated molecular pattern-triggered immunity in rice [J]. The Plant Cell, 2012, 24(11):4748-4762.
[16]ZHANG Yang, SU Jianbin, DUAN Shan, et al. A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes [J/OL]. Plant Methods, 2011, 7(1):30. DOI: 10.1186/1746-4811-7-30.
[17]HELLIWELL E E, WANG Qin, YANG Yinong. Ethylene biosynthesis and signaling is required for rice immune response and basal resistance against Magnaporthe oryzae infection [J]. Molecular Plant-Microbe Interactions, 2016, 29(11): 831-843.
[18]YANG Chao, MA Biao, HE Sijie, et al. MAOHUZI6/ETHYLENE INSENSITIVE3-LIKE1 and ETHYLENE INSENSITIVE3-LIKE2 regulate ethylene response of roots and coleoptiles and negatively affect salt tolerance in rice [J]. Plant Physiology, 2015, 169(1):148-165.
[19]BARI R, JONES J D. Role of plant hormones in plant defence responses [J]. Plant Molecular Biology, 2009, 69(4): 473-488.
[20]SONG Susheng, HUANG Huang, GAO Hua, et al. Interaction between MYC2 and ETHYLENE INSENSITIVE3 modulates antagonism between jasmonate and ethylene signaling in Arabidopsis [J]. The Plant Cell, 2014, 26(1): 263-279.
(責任编辑:张文蔚)

