白星花金龟幼虫血腔注射干扰体系构建
王李勃 束长龙 朱延明 耿丽丽

摘要 本研究针对重要的农业害虫白星花金龟Protaetia brevitarsis幼虫,建立RNA干扰体系,以期为免疫相关基因功能研究奠定基础。通过血腔注射dsRNA,成功干扰了肽聚糖识别蛋白(peptidoglycan-recognition protein LB,PGRP-LB)基因的表达,发现dsRNA注射量为9 μg,注射后48 h取样,pgrp-lb基因沉默效率最高。通过血腔注射对白星花金龟无杀虫活性的Bt菌株G03,发现pgrp-lb基因沉默破坏了白星花金龟幼虫的免疫防御系统,显著提高了白星花金龟对G03菌株的敏感性。表达免疫识别基因dsRNA菌株的构建,将为白星花金龟的生物防治提供新思路。
关键词 白星花金龟; 生物信息学; RNA干扰; 肽聚糖识别蛋白
中图分类号: S 433.5
文献标识码: A
DOI: 10.16688/j.zwbh.2019256
Construction of a hemocoel injection interference system for Protaetia brevitarsis larvae
WANG Libo1,2, SHU Changlong2, ZHU Yanming1*, GENG Lili2*
(1. Northeast Agricultural University, Harbin 150030, China; 2. State Key Laboratory for Biology of Plant Diseases and
Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
In this study, RNA interference system was established for the larvae of Protaetia brevitarsis, an important agricultural pest in order to lay a foundation for the study of immune-related gene functions. The expression of peptidoglycan-recognition protein LB (PGRP-LB) gene was successfully interfered by intravenous injection of dsRNA. It was found that the highest silencing efficiency of pgrp-lb gene was achieved when the quantity of dsRNA was 9 μg and the samples were taken 48 hours after injection. When Bt strain G03 (no insecticidal activity against P.brevitarsis) was injected into the blood cavity, the silencing of pgrp-lb gene destroyed the immune defense system of P.brevitarsis larvae and significantly increased the sensitivity of P.brevitarsis to the strain G03. The construction of the strain expressing the dsRNA of immune recognition gene may provide a new method for biological control of P.brevitarsis.
Key words
Protaetia brevitarsis; bioinformatics; RNAi; peptidoglycan-recognition protein
白星花金龟Protaetia brevitarsis属鞘翅目Coleoptera多食亚目Polyphaga金龟科Scarabaeoidea,广泛分布于我国东北、华北、黄淮海、甘肃、新疆等地区,成虫取食14科26属29种植物[1],造成作物严重减产。在其2001年入侵新疆地区后大量增殖,暴发成灾[2],是一种危害严重、防治困难的农业害虫。白星花金龟一年发生1代,其幼虫多以腐败物为食,常见于堆肥和腐烂秸秆中,对环境适应性较强[3],具有强大的免疫能力、消化能力[4]。一般生物防治方法如苏云金芽胞杆菌Bacillus thuringiensis(简称Bt),对白星花金龟幼虫的生物防控效果不尽如人意[5],急需开辟新的生防途径。
昆虫RNA干扰的方法包括浸泡、注射、饲喂、转染、病毒侵染等手段。其中注射法应用较多,即通过注射的方式将dsRNA、siRNA导入昆虫的卵、血腔、蛹、特定组织等[6-9],引发系统性干扰效应。自RNAi在果蝇中实现以来,在鞘翅目、鳞翅目Lepidoptera、膜翅目Hymenoptera、双翅目Diptera昆虫中均有实现RNAi的报道。在鞘翅目中已经有17种昆虫实现RNAi,研究对象主要集中在赤拟谷盗Tribolium castaneum、红棕象甲Rhynchophorus ferrugineus、非洲甘薯象Cylas puncticollis、马铃薯甲虫Leptinotarsa decemlineata、玉米根萤叶甲Diabrotica virgifera virgifera等一类体型较小的甲虫中[7,10-14]。研究发现,dsRNA或siRNA注射浓度、采样时间、昆虫形态的大小、对RNA干擾的敏感程度、目的基因的区域选择等因素对于干扰效率均具有较大的影响。长红锥蝽Rhodnius prolixus幼虫、印度柞蚕Antheraea mylitta的研究中还发现发育阶段较早、体型较小的昆虫对干扰较为敏感[15-17]。
PGRP-LB蛋白是一种能够特异性结合肽聚糖的酰胺酶类肽聚糖识别蛋白(peptidoglycan-recognition protein,PGRP)L型家族蛋白[18],只有一个保守的PGRP结构域[19-20]。对黑腹果蝇Drosophila melanogaster、埃及伊蚊Aedes aegypti、赤拟谷盗等昆虫的研究表明[21-23],其表达受到免疫缺陷(immune deficiency pathways,IMD)途径的调控。对小菜蛾Plutella xylostella的研究发现,PGRP-LB蛋白能够积极地响应革兰氏阳性菌Bt菌株的入侵并大量表达,酶解肽聚糖,负反馈调节免疫缺陷途径[24]。抑制免疫反应在维持肠道微生物群落结构方面起到了重要作用[25-27]。另一方面,在对斯氏按蚊Anopheles stephensi的研究中发现,免疫识别蛋白影响围食膜蛋白,进而影响免疫耐受能力,在抵抗疟原虫入侵中发挥功能[28]。以PGRP-LB蛋白为研究对象对昆虫免疫机制、昆虫的生物防治具有重要意义。因此,本研究以白星花金龟pgrp-lb为目的基因,预测蛋白性质及功能,并建立其幼虫血腔注射的RNAi体系,研究目的基因干扰对昆虫免疫及肠道微生物群落结构的影响。
1 材料与方法
1.1 供试昆虫及培养方法
供试昆虫:白星花金龟3龄幼虫由河北省沧州市农林科学院植物保护研究所惠赠;饲养条件为:培养温度(25±2)℃,湿度(50±2)%,光周期L∥D=14 h∥10 h;生存环境为腐殖土∶木屑∶白星花金龟幼虫粪便为10∶5∶1的人工土壤环境。
1.2 总RNA提取及cDNA合成
对白星花金龟幼虫进行体表消毒,沿腹中线解剖,取出中肠组织,去除中肠内容物后于液氮中冻存。采用液氮研磨的方法破碎组织,以Triquick Reagent(Solarbiolife science)说明书提取中肠组织总RNA,0.7%琼脂糖凝胶电泳检测总RNA质量。用DNase I消化总RNA,消化后使用RNA抽提试剂(pH 5.2)进行抽提,异丙醇沉淀总RNA后使用75%乙醇洗涤,沉淀用DEPC水溶解,0.7%琼脂糖凝胶电泳检测RNA抽提质量,并使用微量分光光度计(NanoDropTM,Thermo FisherTM,美国)检测浓度,对总RNA进行稀释处理,使样品浓度均为1 μg/μL,使用SuperScript IV First-Strand Synthesis System kit反转录为cDNA。
1.3 白星花金龟幼虫免疫识别蛋白PGRP-LB的生物信息学分析及核酸序列克隆
根据本实验室前期获得的白星花金龟幼虫中肠转录组测序结果设计其上下游引物(表1),以cDNA为模板获得白星花金龟幼虫pgrp-lb基因片段,测序后进行生物信息学分析:使用 DNAMAN 7.0软件分析PGRP-LB氨基酸序列、使用ProtParam工具分析蛋白理化性质,使用SMART软件及SOPMA软件分析蛋白结构及关键结构域,使用Phyre2及SWISS MODEL预测其三级结构;使用MEGA 7.0软件将白星花金龟幼虫与其他50种昆虫的PGRP-LB氨基酸序列进行比对分析,邻接法(neighbor-joining,NJ)构建系统发育进化树,使用戴霍夫法(Dayhoff)计算距离矩阵,检验计算100次。
1.4 白星花金龟幼虫免疫识别蛋白pgrp-lb基因干扰载体的构建
根据获得的白星花金龟幼虫免疫识别蛋白PGRP-LB中关键结构域序列,利用在线RNAi序列预测网站(http:∥rnaidesigner.thermofisher.com/rnaiexpress/)及Primer Premier 5.0软件设计扩增pgrp-lb基因的RNA干扰片段引物,上下游分别引入Bgl II及Sal I酶切位点,同时设计了干扰GFP蛋白的RNA干扰片段扩增引物,分别引入了Pst I及Sal I酶切位点(表1)。使用PrimeSTAR Max DNA Polymerase进行PCR扩增,回收PCR扩增产物。分别对目的片段及L4440干扰载体进行酶切后连接,获得L4440-pgrp-lb及L4440-gfp重组质粒,转化DH5α感受态细胞(氨苄青霉素抗性),PCR鉴定、双酶切鉴定并测序。将L4440-pgrp-lb及L4440-gfp重组质粒转化用超级感受态制备法制备的HT115感受态细胞中,PCR及双酶切鉴定筛选阳性克隆。
1.5 白星花金龟免疫识别蛋白PGRP-LB干扰dsRNA的表达优化
采用Kamath等[29]的方法对dsRNA表达体系进行优化,将带有L4440-pgrp-lb重组质粒的HT115菌株接种于双抗(氨苄青霉素:终浓度100 μg/mL及四环素:浓度12.5 μg/mL)LB培养基中进行第一次活化,在37℃下220 r/min培养12~16 h,菌液按1∶50接种到双抗2×YT培养基中,分别培养至OD600为0.5、1、1.5、2后分别加入IPTG至终浓度为1 mmol/L。另外在菌液培养至OD600为0.5后,加入IPTG至终浓度分别为0.2、1、5、25 mmol/L,在30℃下250 r/min继续培养4 h,在4℃下4 500 r/min离心5 min,菌体用DEPC处理水悬洗1次。采用苯酚法提取总RNA,并使用DNase I及RNase A消化处理后抽提获得dsRNA。使用0.7%琼脂糖凝胶电泳检测。使用NanoDrop测定消化后总RNA浓度,并使用Image J分析dsRNA所占比例。
1.6 白星花金龟幼虫免疫识别蛋白基因RNA干扰dsRNA注射剂量筛选
选取3龄白星花金龟幼虫40头分组,每组8头,体表消毒后注射dsRNA,对照组分为注射gfp-dsRNA和DEPC水,处理组每头注射pgrp-lb-dsRNA 10 μL,每组浓度分别为:0.2、0.4、0.9 μg/μL,注射后隔离在6孔生测板中,并放置在人工培养箱中培养。在注射后36 h取样,取样方法、总RNA提取,cDNA合成方法同上,以β-actin蛋白基因作为内参基因进行荧光定量分析,每个试验处理取3个样本。实时荧光定量PCR反应检測目的基因表达量,体系参照SuperReal PreMix Plus使用说明,使用ABI 7500 Real Time PCR扩增仪进行荧光定量PCR反应。反应条件为:95℃ 15 min; 95℃ 10 s,62℃ 32 s,40个循环。
1.7 白星花金龟幼虫免疫识别蛋白基因RNA干扰时效筛选
选取3龄白星花金龟幼虫40头,分别作为对照组及处理组,每组20头,体表消毒每头注射浓度为0.4 μg/μL dsRNA 10 μL(对照组注射gfp-dsRNA,試验组注射pgrp-lb-dsRNA),注射后隔离在6孔生测板中,并放置在人工培养箱中培养。在注射后24、48、72 h取样,每个时间点取样6头,取样方法、总RNA提取及cDNA合成方法同上。荧光定量PCR检测目的基因的表达量,每个时间点取3个样本。荧光定量PCR反应条件及体系同上。
1.8 pgrp-lb基因干扰的白星花金龟幼虫对Bt菌株敏感性的检测
选取本实验室保存的对鞘翅目无杀虫活性的Bt菌株G03进行血腔注射试验,浓度为:1.57×107、3.14×106、6.28×105、1.26×105、2.51×104、5.02×103 cfu/mL。注射dsRNA后48 h进行G03菌株注射,每个浓度10头幼虫,3次重复,以注射gfp-dsRNA的幼虫作为对照,3 d后统计死亡率,分析白星花金龟幼虫免疫基因干扰对Bt菌株敏感性影响。
1.9 数据分析
基因相对表达量的计算采用2-ΔΔCT法[31],pgrp-lb基因表达量是与内参基因相比的相对表达量,并以未处理的对照组进行归一化处理。
幼虫死亡率计算方法如下:
死亡率=死虫数/(死虫数+活虫数)×100%;
校正死亡率=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100%。
参照贾春生的方法进行致死中浓度(LC50)计算[32]。数据差异显著性分析采用生物统计学软件SPSS中的单因素方差分析(ANOVA)方法。
2 结果
2.1 白星花金龟幼虫中肠免疫相关蛋白pgrp-lb基因的生物信息学分析
2.1.1 PGRP-LB蛋白序列克隆及关键结构域分析
以cDNA为模板,克隆得到pgrp-lb基因序列1 499 bp,测序结果与转录组测序结果一致,GenBank登录号MK691594。白星花金龟PGRP-LB蛋白的第25~168位氨基酸残基上存在PGRP的结构域,蛋白二级结构主要为无规则卷曲。由预测的三级结构可知,该蛋白由3个主要的α螺旋部分及无规则卷曲部分缠绕中央的β片层构成,这与已报道的PGRP-LB蛋白结构相同。
2.1.2 白星花金龟PGRP-LB蛋白氨基酸序列与其他昆虫的PGRP-LB序列进化分析
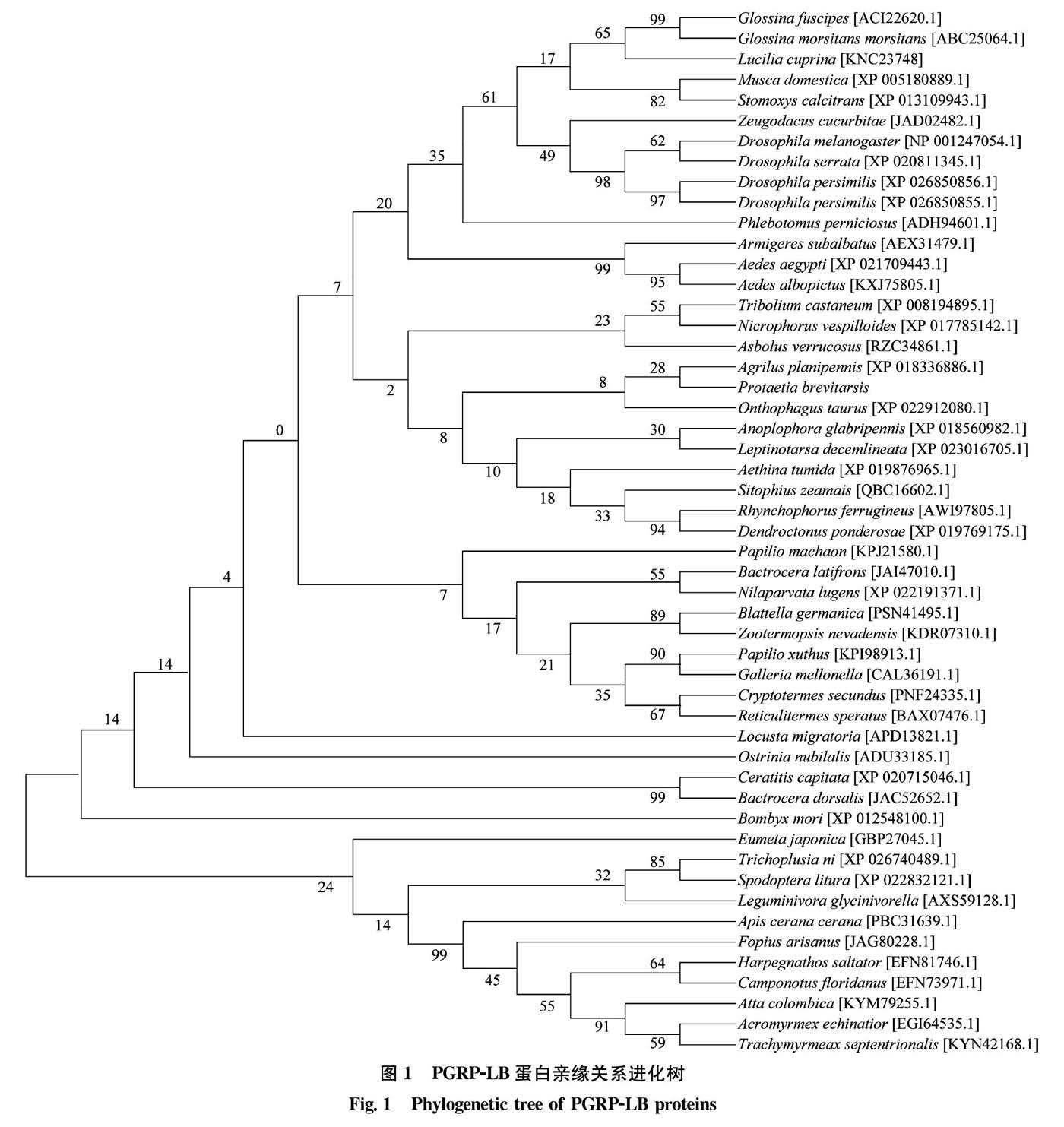
为了进一步分析免疫相关蛋白PGRP-LB在鞘翅目及其他昆虫中的亲缘关系并预测其生物学功能,构建了PGRP-LB蛋白亲缘关系树。其中,白星花金龟与鞘翅目多食亚目的食粪金龟Onthophagus taurus序列相似程度较高,说明两者遗传关系较为接近,PGRP-LB蛋白序列具有较高的相似性,这与物种亲缘关系分布一致。说明了其PGRP-LB蛋白在功能和结构上与已报道的其他鞘翅目昆虫相似(图1)。
2.2 pgrp-lb基因RNA干扰载体构建
2.2.1 pgrp-lb基因克隆及功能预测
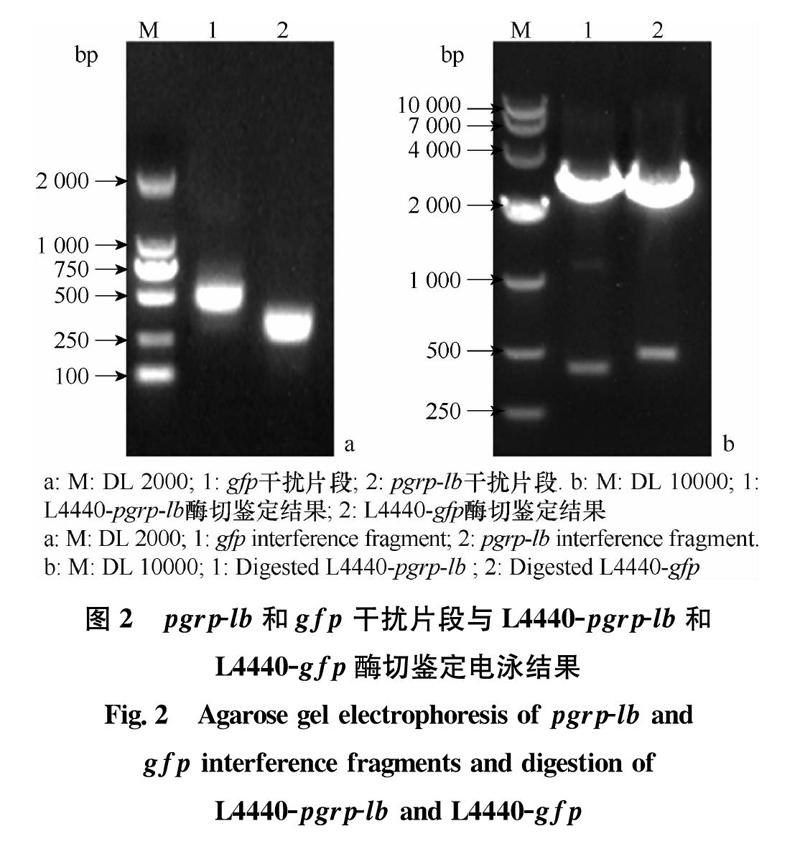
通过在线预测(http:∥rnaidesigner.thermofisher.com/rnaiexpress/)蛋白表达的ORF区541 bp位点到1 207 bp位点中潜在的RNAi靶位点,在734~1 059 bp位点处得到10个可能的RNAi位点,所以选择了该325 bp序列作为干扰片段进行克隆。同时以实验室已有的GFP蛋白核酸序列为模板,对其中173~677 bp片段进行克隆。将目的片段和L4440载体进行双酶切并连接,成功构建了L4440-pgrp-lb及L4440-gfp重组质粒(图2)。
2.2.2 pgrp-lb-dsRNA及gfp-dsRNA的诱导表达
分别对含有L4440-pgrp-lb和L4440-gfp重组质粒的HT115菌株dsRNA诱导表达,并用DNase I和RNase A对诱导表达后的总RNA进行消化,电泳结果显示菌体DNA及RNA被降解,目的条带为500 bp和300 bp,与pgrp-lb-dsRNA 和 gfp-dsRNA预期大小一致,干扰载体构建成功(图3)。为了大量表达dsRNA,对其表达条件进行了优化,发现不同接菌浓度影响较小,而IPTG终浓度影响较大,在终浓度为5 mmol/L时表达效果最好(图4)。
2.3 pgrp-lb-dsRNA剂量对目的基因干扰效率的影响
检测不同剂量dsRNA注射白星花金龟幼虫体腔所能获得的最大干扰效率,对3组不同浓度dsRNA注射的对照组和处理组白星花金龟幼虫中肠cDNA样品进行实时荧光定量PCR检测。结果显示,在dsRNA浓度为0.9、0.4、0.2 μg/μL时目的基因表达量分别为对照组的17.2%、63.4%、85.1%,注射浓度为0.9 μg/μL时干扰效率最大,目的基因的相对表达量显著低于其他两组(图5,P<0.05)。
2.4 不同处理时长下pgrp-lb-dsRNA干扰效率变化
为了检测dsRNA注射后不同间隔时间采样下目的基因表达量变化,对对照组和处理组白星花金龟幼虫中肠cDNA样品进行实时荧光定量PCR检测,结果显示,在dsRNA注射后24、48、72 h时干扰效率分别为68.3%、25.5%、63.7%,48 h时采样干扰效率最大,目的基因的相对表达量显著低于其他两组(图6,P<0.05)。
2.5 pgrp-lb基因干扰的白星花金龟幼虫对Bt菌株的敏感性分析
为了进一步分析免疫基因干扰是否破坏了白星花金龟幼虫的免疫防御系统,影响了幼虫对Bt菌株敏感性,选择对白星花金龟无杀虫活性的Bt菌株G03对免疫识别基因pgrp-lb干扰的幼虫进行血腔注射,72 h后对幼虫死亡率进行统计(表2)。结果表明,pgrp-lb处理组中G03菌株的LC50极显著低于对照组(P <0.01),干扰pgrp-lb基因增加了幼虫对G03菌株的敏感性。
3 讨论
华北大黑鳃金龟Holotrichia oblita、食粪金龟等金龟科中的多种甲虫已经实现了通过注射dsRNA对目的基因的干扰,但白星花金龟中尚无相关的研究报道。大黑鳃金龟的气味识别蛋白(OBP)研究中,通过将dsRNA显微注射进入雌性成虫的头部实现对OBP的干扰[33];在食粪金龟科的复眼发育研究中,通过将不同稀释浓度的dsRNA注射进入食粪金龟科不同属昆虫3龄幼虫的血腔,均实现了对Orthodenticle基因的干扰,这一结果说明了注射浓度及昆虫的敏感性对干扰效率的影响[34]。本研究发现0.9 μg/μL浓度干扰效率最高,这与烟粉虱Bemisia tabaci的CYP6CM1基因研究中,高浓度dsRNA所引发的基因干扰效率更好的结果相符[36]。
白星花金龟幼虫肠道菌落环境复杂,田小燕等[4]和Shan等[35]从白星花金龟幼虫肠道内分离的共生菌株可以有效抑制苏云金芽胞杆菌的生长。这种复杂的共生关系得益于昆虫在漫长的进化过程中形成的一套包括免疫防御、免疫稳定、免疫监视功能在内的快速准确的免疫防御系统。PGRP-LB蛋白在这一过程中起到了重要作用,通过降解游离和进入细胞间的肽聚糖(peptidoglycan,PGN),抑制了免疫反应,稳定了肠道细菌群落结构,保證了对生存有利菌株的存在,对PGRP-LB蛋白的研究有助于理解昆虫与其肠道菌落间的互作关系。
研究首次建立了血腔注射dsRNA介导的白星花金龟RNA干扰体系,为进一步使用RNAi方法研究白星花金龟基因功能奠定了基础。并通过使用HT115菌株构建dsRNA表达体系,压缩了干扰成本。利用该体系成功干扰了免疫识别蛋白pgrp-lb基因的表达,并发现pgrp-lb基因沉默的白星花金龟幼虫对Bt菌株敏感性显著提高,为进一步研究白星花金龟中肠免疫与Bt菌株侵染间的关系提供了基础。
参考文献
[1] 杨诚. 白星花金龟生物学及其对玉米秸秆取食习性的研究[D].泰安:山东农业大学,2014.
[2] 郭文超, 许建军, 何江, 等. 新疆农作物和果树新害虫——白星花金龟[J]. 新疆农业科学, 2004, 41(5): 322-323.
[3] 索中毅, 白明, 李莎, 等. 中国白星花金龟地理变异的几何形态学分析及其新疆种群的入侵来源推断[J]. 昆虫学报, 2015, 58(4): 408-418.
[4] 田小燕, 宋福平, 张杰, 等. 饲喂玉米秸秆的白星花金龟幼虫肠道细菌多样性[J]. 昆虫学报, 2017, 60(6): 632-641.
[5] 赵仁贵, 陈日曌. 白星花金龟生活习性观察[J]. 中国植保导刊, 2008, 28(6): 19-20.
[6] KENNERDELL J R, YAMAGUCHI S, CARTHEW R W. RNAi is activated during Drosophila oocyte maturation in a manner dependent on aubergine and spindle-E [J]. Genes & Development, 2002, 16(15): 1884-1889.
[7] TOMOYASU Y, DENELL R E. Larval RNAi in Tribolium (Coleoptera) for analyzing adult development [J]. Development, Genes and Evolution, 2004, 214(11): 575-578.
[8] DONG Ying, FRIEDRICH A M. Nymphal RNAi: systemic RNAi mediated gene knockdown in juvenile grasshopper [J/OL]. BMC Biotechnology, 2005, 5(1): 25. DOI: 10.1186/1472-6750-5-25.
[9] NISHIKAWA T, NATORI S. Targeted disruption of a pupal hemocyte protein of Sarcophaga, by RNA interference [J]. European Journal of Biochemistry, 2010, 268(20): 5295-5299.
[10]AL-AYEDH H, RIZWAN-UL-HAQ M, HUSAAIN A, et al. Insecticidal potency of RNAi-based catalase knockdown in Rhynchophorus ferrugineus (Olivier) (Coleoptera: Curculionidae) [J]. Pest Management Science, 2016, 72(11): 2118-2127.
[11]CROUAU Y, CROUAU-ROY B. Antennal sensory organs of a troglobitic coleoptera, Speonomus hydrophilus Jeannel (Catopidae): An ultrastructural study by chemical fixation and cryofixation [J]. International Journal of Insect Morphology and Embryology, 1991, 20(3): 169-184.
[12]KATTERINNE P, INE P, OLIVIER C, et al. Transcriptome analysis and systemic RNAi response in the African sweetpotato weevil (Cylas puncticollis, Coleoptera, Brentidae) [J/OL]. PLoS ONE, 2015, 10(1): e0115336. DOI: 10.1371/journal. pone. 0115336.
[13]RANGASAMY M, SIEGFRIED B D. Validation of RNA interference in western corn rootworm Diabrotica virgifera virgifera LeConte (Coleoptera: Chrysomelidae)adults [J]. Pest Management Science, 2012, 68(4): 587-591.
[14]SWEVERS L, HUVENNE H, MENSCHAERT G, et al. Colorado potato beetle (Coleoptera) gut transcriptome analysis:expression of RNA interference-related genes [J]. Insect Molecular Biology, 2013, 22(6): 668-684.
[15]TERENIUS O, PAPANICOLAOU A, GARBUTT J S, et al. RNA interference in Lepidoptera: An overview of successful and unsuccessful studies and implications for experimental design [J]. Journal of Insect Physiology, 2011, 57(2): 231-245.
[16]ARAUJO R N, SANTOS A, PINTO F S, et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera:Reduviidae)by dsRNA ingestion or injection [J]. Insect Biochemistry and Molecular Biology, 2006, 36(9): 683-693.
[17]GANDHE A S, JOHN S H, NAGARAJU J. Noduler, a novel immune upregulated protein mediates nodulation response in insects [J]. Journal of Immunology, 2007, 179(10): 6943-6951.
[18]DZIARSKI R. Peptidoglycan recognition proteins (PGRPS) [J]. Molecular Immunology, 2004, 40(12): 877-886.
[19]KANG Daiwu, LIU Gang, LUNDSTROM A, et al. A peptidoglycan recognition protein in innate immunity conserved from insects to humans [J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(17): 10078-10082.
[20]SWAMINATHAN C P, BROWN P H, ROYCHOWDHURY A, et al. Dual strategies for peptidoglycan discrimination by peptidoglycan recognition proteins (PGRPs) [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 684-689.
[21]HOFFMANN J A. The immune response of Drosophila [J]. Nature, 2003, 426(6962): 33-38.
[22]GOTTAR M, GOBERT V, MICHEL T, et al. The Drosophila immune response against Gram-negative bacteria is mediated by a peptidoglycan recognition protein [J]. Nature, 2002, 416(6881): 640-644.
[23]DAWADI B, WANG Xinghong, RONG Xiao, et al. PGRP-LB homolog acts as a negative modulator of immunity in maintaining the gut-microbe symbiosis of red palm weevil, Rhynchophorus ferrugineus Olivier [J]. Developmental and Comparative Immunology, 2018, 86(9): 65-77.
[24]張玉清. 小菜蛾免疫Bt动力学的DGE分析及其PGRP-LB基因的克隆[D]. 广州:华南农业大学, 2016.
[25]王爱琳. PGRP-LB和PGRP-SB基因在橘小实蝇免疫及肠道微生物调控中的作用研究[D]. 武汉:华中农业大学, 2015.
[26]DOUGLAS A. Lessons from studying insect symbioses [J]. Cell Host and Microbe, 2011, 10(4): 359-367.
[27]ANSELME C, VALLIER A, BALMAND S, et al. Host PGRP gene expression and bacterial release in endosymbiosis of the weevil Sitophilus zeamais [J]. Applied and Environmental Microbiology, 2006, 72(10): 6766-6772.
[28]GENDRIN M, TURLURE F, RODGERS F H, et al. The peptidoglycan recognition proteins PGRP LA and PGRP-LB regulate Anopheles immunity to bacteria and affect infection by Plasmodium [J]. Journal of Innate Immunity, 2017, 9(4): 333-342.
[29]KAMATH R S, FRASER A G, DONG Y, et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi [J]. Nature, 2003, 421(6920): 231-237.
[30]黄颖. 蛴螬体内环境对Bt杀虫活性的影响[D]. 北京:中国农业科学院, 2017.
[31]WONG M L, MEDRANO J F. Real-time PCR for mRNA quantitation [J]. Biotechniques, 2005, 39(1): 75-85.
[32]贾春生. 利用SPSS软件计算杀虫剂的LC50 [J]. 昆虫知识, 2006, 43(3): 414-417.
[33]YIN Jiao, WANG Chaoqun, FANG Chiqin, et al. Functional characterization of odorant-binding proteins from the scarab beetle Holotrichia oblita based on semiochemical-induced expression alteration and gene silencing [J]. Insect Biochemistry and Molecular Biology, 2019, 104: 11-19.
[34]ZATTARA E E, MACAGNO S, SHIGENOBU S, et al. Development of functional ectopic compound eyes in scarabaeid beetles by knockdown of orthodenticle [J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(45): 12021-12026.
[35]SHAN Yueming, SHU Changlong, CRICKMORE N, et al. Cultivable gut bacteria of scarabs (Coleoptera:Scarabaeidae) inhibit Bacillus thuringiensis multiplication [J]. Environmental Entomology, 2014, 43(3): 612-616.
[36]李如美, 王少麗, 张友军. 显微注射构建烟粉虱的RNAi技术体系 [J]. 昆虫知识, 2015, 52(2): 504-509.
(责任编辑:田 喆)

