内皮抑素和血管抑素融合基因在杆状病毒中的表达及抗肝癌效果评价
王志昇 李梦婷 姬勇敢 杨萌萌
宁夏医科大学1实验动物中心,2药学院(银川750004)
原发性肝癌是我国常见的恶性肿瘤之一,全世界每年约有85.4 万例新发患者,其中约50%发生在我国,并呈逐年上升趋势,现有的治疗手段如手术、放疗、化疗等都有不同的弊端,无法彻底根除[1-2]。随着分子生物学的发展,基因治疗已成为治疗肿瘤最具潜力的方法之一。基因治疗要想成功实施,靶基因的选择至关重要。众所周知,原发肿瘤的发展以及转移关键依靠新生血管的生成来提供氧气和营养。因此,内皮抑素、血管抑素基因等抗血管生成基因治疗作为一种抗癌策略广受关注[3]。内皮抑素是胶原ⅩⅧ的C 末端水解片段,是研究最广泛的内源性血管生成抑制剂之一。血管抑素是纤溶酶原内部蛋白水解片段的四个Kringle结构域中的第一个,被认为是一种有效的内源性血管生成抑制剂。目前血管抑素和内皮抑素已在不同的表达系统如慢病毒[4]、腺相关病毒[5]以及减毒鼠伤寒沙门氏菌[6]等获得了表达,并在不同的肿瘤模型中表现出了一定的抗肿瘤潜力。然而,这些病毒或细菌载体在人体内的生物安全性有待进一步验证。与这些病原体相比,杆状病毒是一种昆虫病毒,对哺乳动物和人类无致病性,但能有效进入多种哺乳动物细胞这一特点使其成为良好基因传递潜能的载体。因此,本研究为了提高抗血管生成基因治疗的效果和安全性,拟以杆状病毒为载体,表达由人内皮抑素和血管抑素组成的融合蛋白(human endostatin and angiostatin,hEA),以此来评价杆状病毒介导的hEA 的抗血管生成功能和抗肝癌效果。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和细胞pFastBac DUAL 质粒购自美国Thermo 公司;pUNO1-hEndo18Angio 质粒购自美国InvivoGen 公司;pEGFP-C1 质粒、大肠埃希菌DH10Bac 感受态细胞、昆虫Sf-9 细胞、人肝癌细胞HepG2 和人脐静脉内皮细胞HUVEC 由宁夏医科大学实验动物中心保存。Sf-9 细胞在含有10 %胎牛血清(FBS)的Grace 昆虫培养基(含3.3 g/L 水解乳蛋白和3.3 g/L 酵母提取物)于27 ℃生化培养箱中培养;HepG2 和HUVEC 细胞用含有10 % FBS的DMEM 培养基于37 ℃、5%CO2培养箱中培养。
1.1.2 实验动物4~6 周龄,体质量为18~22 g,SPF 级雄性BALB/c 裸小鼠由宁夏医科大学实验动物中心提供。实验动物饲养在宁夏医科大学实验动物中心标准化的SPF 级动物屏障环境中,动物实验方案经由宁夏医科大学实验动物福利伦理审查委员会审核并获得批准。
1.1.3 主要试剂各种内切酶、T4 DNA 连接酶、Taq DNA 聚合酶和dNTP 购自美国Thermo 公司;DNA Marker 购自南京诺唯赞生物公司;质粒回收试剂盒、DNA 凝胶回收试剂盒购自北京天根生化科技公司;MTT 试剂盒、BCA 试剂盒购自江苏凯基生物;丁酸钠购自Sigma 公司;FBS、Grace 昆虫细胞培养基、DMEM 培养基及Lipofectamine 2000 购自Gibco 公司;Angiostatin ELISA 试剂盒购自南京云克隆公司;Matrigel 基质胶购自美国康宁公司;其他试剂均为国产分析纯。
1.1.4 主要仪器PCR 仪(T100,美国BIORAD 公司);全波长酶标仪(Multiskan FC,美国Thermo 公司);倒置显微镜(Axio Vert.A1,德国蔡司公司);高速冷冻离心机(Centrifuge 5430R,美国Eppendorf 公司);CO2培养箱(Forma 311,美国Thermo 公司)。
1.2 方法
1.2.1 pBac-ChEA 质粒的构建以质粒pFastBac DUAL 为骨架,将pPh 启动子替换为CMV 启动子,CMV 启动子从pEGFP-C1 质粒通过引物CMV-F:5′-CGCGGTATACTAGTTATT AATAGTAATCAA-3′和CMV-R:5′-GCGGGATCCGGATCTGACGGTTCACTAAAC-3′扩增获得(下划线为分别引入的BST Z17I和Bam HI 酶切位点),获得的重组质粒命名为pBac-CMV。以质粒pUNO1-hEndo18Angio 为模板,设计引物hEA-F:5′-TCAGGATCCCGCCACCA-TGTAC AGGATGCAACTC-3′和hEA-R:5′-GCGAAGCTTTCATACAACACTCGCTTCTGT-3′(下划线为分别引入的Bam HI 和Hind III 酶切位点),用于扩增hEndo18Angio(hEA)基因,将hEA PCR 产物双酶切回收后插入同样位点酶切后的pBac-CMV 质粒中,获得的重组质粒命名为pBac-ChEA。
1.2.2 重组病毒粒子的获得重组病毒的获得按照Bac-to-Bac(Invitrogen)表达系统说明书操作。将pBac-ChEA 转化DH10Bac 感受态细胞,经三抗(卡那霉素、庆大霉素和四环素)筛选,提取杆状病毒DNA,经由Lipofectamine 2000 转染Sf-9 细胞,27 ℃培养,待细胞大部分从瓶底脱落时,收集细胞培养液,离心取上清液,作为原毒种P1 代毒,再以1 MOI 的重组病毒量继续感染Sf-9 细胞,完成重组病毒的增殖,直至P3 代毒,分装,-80 ℃冻存备用。对照质粒pBac-CMV 按照同样方法处理。经PCR 鉴定正确的重组病毒分别命名为Bac-ChEA和Bac-CMV,病毒的滴度通过噬斑实验测定。
1.2.3 在HUVEC 细胞中的表达将Bac-ChEA 和Bac-CMV 以MOI 400 转导HUVEC 细胞,所加入的病毒先用昆虫培养基稀释,然后与不含NaHCO3的DMEM 培养基配成1∶4 的比例,然后将混合培养液加入细胞中,使其完全覆盖细胞,于27 ℃,摇床上孵育5~6 h,吸出培养液,加入含有3 mmol/L 丁酸钠的DMEM 完全培养基,于37 ℃,5% CO2培养箱中培养24 h,第2 天更换为不含丁酸钠的DMEM完全培养基继续培养,直到第3 天收集细胞,按照Angiostatin ELISA 试剂盒说明书的方法进行操作,最后用酶标仪在450 nm 处检测各孔的吸光度值,然后根据标准曲线计算出各组hEA 蛋白的浓度。
1.2.4 对HUVEC 细胞增殖能力的影响将HUVEC 细胞接种于96 孔板中(4 × 103个/孔),待细胞贴壁后,将Bac-ChEA 和Bac-CMV 以MOI 400 转导HUVEC 细胞,对照组为不含病毒的空转导组。直到第3 天,每孔加入50 μL 1×MTT 试剂继续培养4 h,然后吸出上清液,加入150 μL DMSO,立即通过酶标仪在490 nm 波长下测定其吸光度值。细胞存活率(%)=OD实验组/OD对照组×100%
1.2.5 对HUVEC细胞迁移能力的影响将HUVEC细胞接种于6 孔板中(7 × 105个/孔),待细胞贴壁 后,将Bac-ChEA 和Bac-CMV 以MOI 400 转 导HUVEC 细胞,对照组为不含病毒的空转导组,过夜培养后弃去细胞培养液,用枪头在每孔中笔直划一条线,使其成为无细胞区域,用PBS 清洗后加入含有1 % FBS 的DMEM 培养基于37 ℃,5 % CO2培养箱中继续培养24 h,分别于培养开始时和培养24 h 时在倒置显微镜下拍照,最后用Image J 软件统计划痕缩小的面积。
1.2.6 对HUVEC 细胞血管形成能力的影响将Bac-ChEA 和Bac-CMV 以MOI 400 转 导HUVEC 细胞,对照组为不含病毒的空转导组,72 h 后消化并收集细胞。用Matrigel 基质胶包被96 孔培养板,37 ℃孵育30 min,然后将重组病毒转导的HUVEC细胞制成悬液(5×105cell/mL),每孔加入100 μL,置于37 ℃,5%CO2培养箱中继续培养6 h,然后用倒置显微镜观察血管网络形成并拍照,每孔任意选取5 个视野,实验重复3 次,通过Image J 软件统计分析血管网络总主段长度。
1.2.7 体内抗肿瘤效果评价取200 μL 生长状态良好的HepG2 细胞悬液(1 × 107cell/mL)接种在BALB/c 裸小鼠背部左侧皮下,当肿瘤体积长至100 mm3时,随机分为3组,每组5只,分别在瘤内注射200 μL Bac-ChEA 和Bac-CMV(1 × 108pfu/mL)以及等体积的PBS,每隔5 d 注射1 次,共注射3 次。每2 d 测量小鼠肿瘤体积,当肿瘤体积达到1 500 mm3时,认定小鼠死亡,记录小鼠的死亡情况。
1.2.8 统计学方法采用SPSS 26.0 软件进行统计分析,通过Kaplan-Meier 和Log-rank 检验分析小鼠的存活率;计量资料两组对比采用t检验,数据结果以()表示,P<0.05 为差异有统计学意义。
2 结果
2.1 重组杆状病毒Bac-ChEA 的PCR 鉴定将重组质粒pBac-ChEA 转化DH10Bac 细胞,提取重组病毒Bac-ChEA DNA,转染Sf-9 细胞3 d 后,细胞大量从瓶底脱落,倒置显微镜下观察可见细胞核膨大,胞内颗粒增多,部分细胞裂解、死亡。此时收集细胞培养上清液,经碱裂解法提取病毒DNA,经PCR 和核酸琼脂糖凝胶电泳鉴定,在预期位置处出现了特异性条带,结果见图1,证明hEA 基因已成功整合入病毒基因组中。

图1 重组杆状病毒Bac-ChEA PCR 鉴定Fig.1 PCR identification of recombinant baculovirus Bac-ChEA
2.2 在HUVEC细胞中的表达经Angiostatin ELISA试剂盒检测,Bac-ChEA 在HUVEC 细胞中能有效表达hEA 蛋白,其平均浓度达到了(223±20)pg/mL,而在转导Bac-CMV 的细胞中基本检测不到hEA 蛋白(图2)。结果表明杆状病毒介导的hEA 蛋白在哺乳动物细胞中获得了表达。
2.3 对HUVEC 细胞增殖能力的影响MTT 结果表明(图3),Bac-CMV 组和空白对照组对细胞的增殖基本无影响,而Bac-ChEA 组能有效抑制HUVEC细胞的增殖,细胞平均存活率下降到了65%左右,与Bac-CMV组相比,差异有统计学意义(P<0.001),证明重组杆状病毒介导的hEA 蛋白能有效抑制HUVEC 细胞的增殖,而杆状病毒本身对细胞的增殖无影响。
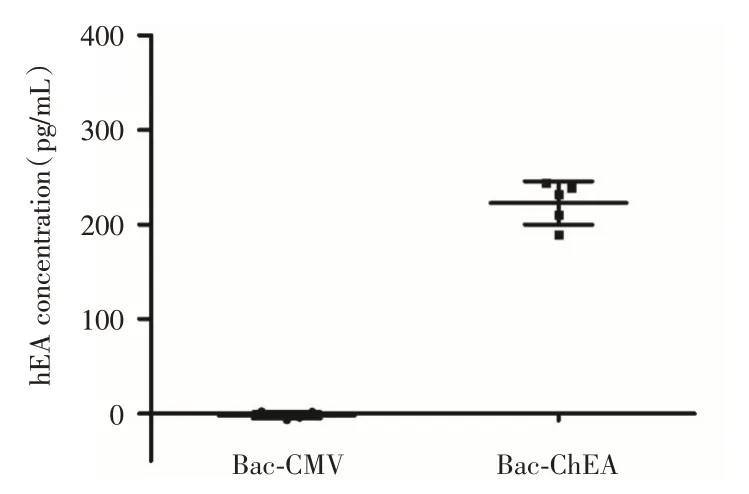
图2 杆状病毒介导的hEA 蛋白在HUVEC 细胞中的表达Fig.2 Baculovirus mediated hEA protein expression in HUVEC cells
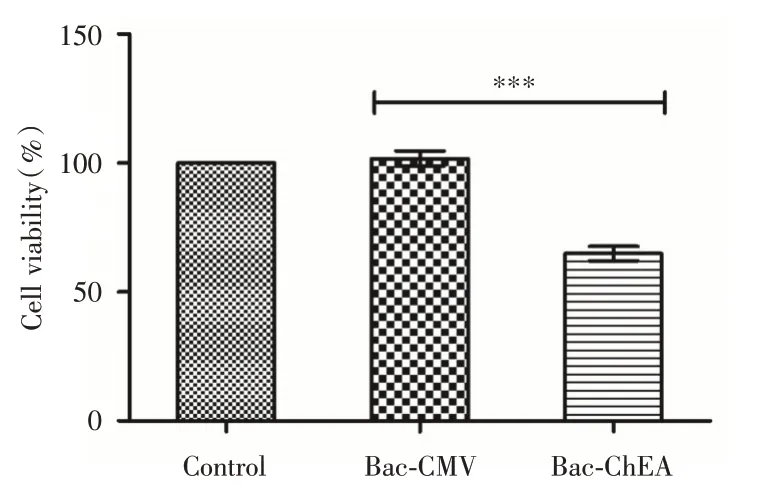
图3 杆状病毒介导的hEA 蛋白对HUVEC 细胞增殖能力的影响(n=3)Fig.3 Effects of baculovirus-mediated hEA protein on the proliferation of HUVEC cells(n=3)
2.4 对HUVEC 细胞迁移能力的影响通过划痕实验评估其对细胞迁移能力的影响。结果见图4,Bac-ChEA 组与Bac-CMV 和空白对照组相比,细胞迁移速度减慢,进一步通过计算划痕伤口面积,发现Bac-ChEA 组与Bac-CMV 组相比能显著抑制HUVEC细胞伤口愈合(P<0.05),而Bac-CMV组与空白组相比,差异无统计学意义(P>0.05)。说明杆状病毒介导的hEA 蛋白能够有效地抑制HUVEC 细胞的迁移。
2.5 对HUVEC 细胞血管形成能力的影响通过体外成管实验验证杆状病毒介导的hEA 蛋白是否具备抑制HUVEC 细胞血管形成的能力。结果如图5所示,空白对照组和Bac-CMV 组中HUVEC 细胞相互聚集,形成清晰可见的小管网络,而Bac-ChEA 组的细胞较分散,抑制了小管形成。进一步统计血管网络主段长度发现,与Bac-CMV 组相比,Bac-ChEA组的成管抑制能力更为显著(P<0.001)。说明重组杆状病毒介导的hEA 蛋白能有效抑制HUVEC 细胞血管的形成。
2.6 体内抗肿瘤效果评价为了进一步评价杆状病毒介导的hEA 蛋白体内抗肿瘤效果,建立裸鼠皮下HepG2 肿瘤模型。结果表明(图6a),PBS 组和Bac-CMV 组的平均肿瘤体积分别在给药后24 d迅速增长至1 500 mm3,而Bac-ChEA 组明显抑制了肿瘤体积的增长,直至第38 天才达到1 500 mm3。小鼠存活率结果(图6b)证实,小鼠的寿命(中位生存期)从Bac-CMV 组的24 d 显著延长(P<0.05)至Bac-ChEA 组的36 d。这些结果共同证实杆状病毒介导的hEA 蛋白能够在体内有效地抑制肿瘤的生长,延长了其生存期。

图4 杆状病毒介导的hEA 蛋白对HUVEC 细胞迁移能力的影响(n=3)Fig.4 Effect of baculovirus-mediated hEA protein on the migration of HUVEC cells(n=3)
3 讨论
杆状病毒-昆虫细胞表达系统较其他病毒载体如腺病毒、腺相关病毒、慢病毒等具有独特的优点:如对人类和哺乳动物不引起致病,能在I 级生物安全实验室进行操作;在哺乳动物细胞中复制缺陷,没有预先存在的抗体;能容纳大片段外源基因插入;重组病毒的构建及纯化操作简单等[7]。这些优点使得杆状病毒在疫苗生产[8]、表面展示真核蛋白[9]等方面得到了广泛的应用。进一步研究发现当杆状病毒携带含有目标细胞功能启动子时,能有效地将基因转移到目标细胞中,使得杆状病毒作为基因传递载体在基因治疗方面表现出了很大的潜力[10-11]。

图5 杆状病毒介导的hEA 蛋白对HUVEC 细胞血管形成能力的影响Fig.5 Effect of baculovirus-mediated hEA protein on the angiogenesis of HUVEC cells

图6 杆状病毒介导的hEA 蛋白体内抗肿瘤效果评价Fig.6 Evaluation of antitumor effect of baculovirus-mediated hEA protein in vivo
本研究以杆状病毒载体pFastBac DUAL 为骨架,将杆状病毒pPh 启动子替换为哺乳动物CMV启动子,然后在其作用下表达hEA 基因。通过PCR 和ELISA 检测hEA 基因成功插入杆状病毒基因组中,并成功在HUVEC 细胞中获得表达。尽管CMV 是广谱型哺乳动物启动子,但SINN 等[12]研究发现,CMV 在胚胎干细胞(ESCs)中的表达活性很低,因此应根据靶细胞的类型选择合适的启动子。由于血管生成涉及到内皮细胞的增殖、迁移以及随后血管的形成,因此为了证实hEA 蛋白的抗血管生成活性,本研究以HUVEC 细胞为模型,验证hEA 蛋白的功能活性。结果表明,Bac-ChEA能有效抑制HUVEC 细胞的增殖、迁移以及血管网络的形成,裸鼠肝癌肿瘤模型结果进一步表明,Bac-ChEA 能有效抑制肝癌肿瘤体积的增长,小鼠寿命(中位生存期)从Bac-CMV 组的24 d 显著延长至Bac-ChEA 组的36 d。尽管抗血管生成蛋白表现出了一定的抑制肿瘤生长的潜力,但其主要是通过抑制肿瘤血管生成而非直接针对肿瘤细胞达到抗肿瘤目的。有学者将内皮抑素与促凋亡蛋白TRAIL 或与化疗药吉西他滨或与放射疗法联合应用,都表现出了增强的协同作用[13-15]。因此,为了提高抗血管生成治疗效果,联合化疗或放疗以及在杆状病毒载体中插入多种抗血管生成基因、免疫刺激和肿瘤靶向自杀基因等的鸡尾酒疗法,成为肿瘤基因治疗今后的发展方向。尽管杆状病毒作为基因传递载体表现出了一定的潜力,但杆状病毒介导的外源蛋白在宿主细胞中瞬时表达以及在体内应用时载体易被补体系统灭活,极大地影响了蛋白的表达效率。为此,研究者们开发了一系列的杆状病毒嵌合系统,如AAV ITR[16],Sleeping Beauty[17]系统等,这些系统都可不同程度的延长外源基因的表达。为了抵抗血清补体系统灭活,通过在杆状病毒表面展示补体调节因子,如DAF[18]、CD46-DAF-CD59 融合蛋白[19]等手段可以有效地抑制补体系统的攻击。在笔者最近的研究中,借助SB 转座子系统和表面展示技术,成功构建了既能在哺乳动物细胞中长效稳定表达外源蛋白又能有效抵抗补体系统攻击的重组杆状病毒载体[20]。
总之,尽管杆状病毒作为基因传递载体仍有不足,但杆状病毒的安全性以及操作的简便性使得其作为基因传递载体拥有独特的优势,通过对杆状病毒改造,可以极大地改善其转导效率。
——一道江苏高考题的奥秘解读和拓展

