乳杆菌产X-脯氨酰-二肽酰基-氨肽酶活性对契达干酪抗氧化活性及品质的影响
赵铭琪,张秀秀,李晓东*,刘 璐*,张宏达,张宏伟,白 杰
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
干酪富含多种乳酸菌,除有些乳酸菌自身具有一定的功能外,其发酵代谢还会生成功能性脂类、γ-氨基酸和活性肽等生物活性物质[1],其中活性肽是干酪主要的活性物质,由2~20 个氨基酸组成,是通过乳酸菌分泌的蛋白酶对干酪酪蛋白水解生成的,使干酪兼具营养与功能价值[2-5]。研究表明,抗氧化肽具有清除体内自由基的功能,能减轻自由基对机体的损伤,是一种理想的天然抗氧化剂[6]。抗氧化肽对紫外线引起的线粒体损伤和自由基诱导的脂质过氧化具有明显的保护作用,此外,抗氧化肽的作用机理还包括给抗氧化酶提供氢、鳌合金属离子等[7-8]。
在干酪成熟中后期,发酵剂乳球菌由于自溶或干酪体系pH值降低,缺少碳水化合物而使其菌数快速减少,但非发酵剂乳酸菌,尤其是含有丰富蛋白酶的乳杆菌,可降解蛋白生成满足自身生长的氨基酸和肽类,逐渐成为优势菌株,促进干酪抗氧化肽的产生[9]。这些乳杆菌细胞内含有脯氨酰亚氨基氨肽酶(Pep I)、广谱性氨肽酶(Pep N、Pep C)、X-脯氨酰-二肽酰基-氨肽酶(X-prolyl-dipeptide acyl-aminopeptidase,Pep X)等肽酶。而只有Pep N、Pep C、Pep X与源自酪蛋白的抗氧化肽降解有关。其中Pep N、Pep C对包含碱基、疏水性/无电荷或N-末端含有芳香族氨基酸残基的多肽具有特异性,Pep X能够切割N-末端富含脯氨酸的多肽,具有脯氨酸忒性的水解活性,可释放酪蛋白中含有脯氨酸的氨基酸序列。其他氨肽酶不能水解N-末端或者倒数第2位含有脯氨酸的多肽,而富含脯氨酸的β-酪蛋白又是潜在的抗氧化肽的来源,目前已发现有超过80%的β-酪蛋白抗氧化肽与脯氨酸相关[10],因此,可推断Pep X是干酪成熟过程中的关键蛋白酶。
近年来,关于氨肽酶对干酪成熟过程中糖酵解、蛋白水解程度、质地以及风味形成方面影响的研究很多,但Pep X与干酪抗氧化活性间的关系尚不明确。经过前期研究发现市售的契达干酪具有一定的抗氧化活性,但活性普遍偏低,自由基清除率仅为18%左右,作用效果不明显[11-14]。因此,本研究以契达干酪为研究对象,选取干酪生产过程中常用的非发酵剂乳杆菌4 株(干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌、瑞士乳杆菌),利用紫外诱变的方法对菌株进行3 轮紫外诱变,诱变出Pep X活性不同的菌株,进行遗传稳定性研究后,利用其制备干酪。在干酪成熟时期监测Pep X活性 及干酪的抗氧化活性,以明确研究Pep X活性对干酪抗氧化能力的影响并建立二者间的相关性。而后对干酪进行感官及质构分析,明确成熟过程中Pep X对干酪品质的影响,以期为干酪的开发与应用提供理论基础。
1 材料与方法
1.1 菌株、材料与试剂
干酪乳杆菌(Lactobacillus casei)1.0319、鼠李糖乳杆菌(L. rhamnosus)1.0911、植物乳杆菌(L.plantarum)1.0202、瑞士乳杆菌(L. helveticus)1.0612均来自东北农业大学乳品科学重点实验室的菌种库;商业发酵剂Lactococcus lactissubsp.lactis和L. lactissubsp.cremoris混合菌种凝乳酶Stamix 1150 北京汉森公司。
生牛乳取自完达山牧场;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻菲罗啉、2,2’-联氮双(3-乙基苯并噻唑啉- 6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 天津市科密欧化学试剂开发中心;磷酸二氢钠、磷酸氢二钠北京奥博星生物技术有限公司;对硝基苯胺 阿拉丁试剂上海有限公司;柠檬酸钠、柠檬酸 天津市博迪化工有限公司。
1.2 仪器与设备
pH计 上海雷磁科技有限公司;数显恒温水浴锅常州朗越仪器制造有限公司;721可见分光光度计上海菁华仪器设备有限公司。
1.3 方法
1.3.1 菌株的活化与诱变
根据马春丽等[15]的方法稍作改动,对4 株菌进行紫外诱变。取菌悬液于平板中,置于15 W紫外灯下照射,时间分别为20、40、60、80、100、120 s,且照射过程中须不断搅拌。选取菌株进行菌落计数,并计算致死率。确定照射时间后,对菌株在此条件下诱变3 轮。
经过1、2、3 轮紫外诱变的L. plantarum、L. casei、L. helveticus、L. rhamnosus分别为:UV-P1、UV-P2、UVP3;UV-C1、UV-C2、UV-C3;UV-H1、UV-H2、UVH3;UV-R1、UV-R2、UV-R3。
1.3.2 Pep X活性的测定
1.3.2.1 乳杆菌Pep X的粗提
根据郭宇星等[16]的方法略作修改,将生长至活菌数为1.0×109CFU/mL的培养液取出后,4 500 r/min离心20 min,用pH 7.1的Tris-HCl缓冲液洗涤,重复此操作3 次,即可收集菌体。将收集到的菌体悬浮于Tris-HCl缓冲液中进行超声破碎。超声破碎后,4 ℃、4 500 r/min离心30 min,取上清液,即为所需酶液。
1.3.2.2 乳杆菌产PepX活性的测定
根据张爽[17]方法略作修改。取0.2 mL酶液,加入到0.05 mL 16.4 nmol/L底物甘氨酰-脯氨酰-对硝基苯胺对甲苯磺酸盐溶液中,37 ℃水浴60 min后,加入乙酸终止反应,并在410 nm波长处测定吸光度。空白组以Tris-HCl缓冲液代替酶液进行同样操作。Pep X活性定义为:在37 ℃时,每分钟生成1 μmol对硝基苯胺为1 个活力单位。
1.3.3 契达干酪的制备
工艺流程:原料乳→过滤、巴氏杀菌(63 ℃,30 min)→冷却(32 ℃)→添加发酵剂和非发酵剂乳杆菌→发酵(32 ℃,60 min)→调整酸度→加氯化钙→添加凝乳酶→凝乳(32 ℃,90 min)→切割(1 cm3)→搅拌升温至42 ℃(每3~5 min升高1 ℃)→保温搅拌(30 min)→静置→排乳清→凝乳堆砌(每15 min反转堆积一次,反转7 次)→加盐→成型压榨→包装→成熟。
发酵剂添加量根据Liu Lu等[18]方法略作修改,具体如下:空白组仅添加商业发酵剂,且发酵剂添加量(质量分数,下同)为0.01%。各实验组中发酵剂添加量均为0.005%,非发酵剂乳杆菌添加量均为12%(体积分数),分别记为:UV-C3组、L. casei组、UV-H3组、L. helveticus组、UV-R3组、L. rhamnosus组、UV-P3组、L. plantarum组。
1.3.4 干酪中PepX活性的测定
参照郭宇星等[16]的方法略作修改。取5 g样品和磷酸盐缓冲液(pH 6.6)5 mL于研钵中研磨2 min,5 000 r/min离心30 min。取0.2 mL上清液加入1.6 mL Tris-HCl(pH 7.1)和0.2 mL 16.4 nmol/L甘氨酰-脯氨酰-对硝基苯胺对甲苯磺酸盐溶液,37 ℃水浴60 min,加入乙酸终止反应,并在410 nm波长处测定吸光度。空白组以Tris-HCl缓冲液代替酶液进行同样操作。
1.3.5 干酪抗氧化活性的测定
1.3.5.1 契达干酪提取液的制备
水溶性蛋白的提取在Bottesini等[19]方法基础上略作修改。在干酪成熟过程中,每30 d进行一次蛋白质的提取。分别取干酪样品10 g溶于100 mL水中,用匀浆机匀浆2 min(过滤、离心),取上清液重复3 次。
1.3.5.2 DPPH自由基清除率的测定
参照Shen Yingbin等[20]方法并略作修改。将1 mL DPPH-甲醇溶液与5 mL 15 mg/mL样品溶液混合,避光反应30 min后,在515 nm波长处测其吸光度As,用甲醇溶液调零,并用甲醇代替样品进行同样操作作为空白Ac。DPPH自由基清除率计算如式(1)所示:

1.3.5.3 羟自由基清除能力的测定
参考Liu Jun等[21]方法并略作修改,将1 mL 0.75 mmol/L菲啰啉溶液、1.5 mL磷酸盐缓冲液(pH 7.4)、1 mL 2 mg/mL样品以及1 mL 0.75 mmol/L FeSO4溶液混合,并向混合液中加入1 mL 0.01% H2O2溶液。37 ℃条件下水浴30 min,在531 nm波长处测定吸光度As。将水解产物换成同体积的蒸馏水作为对照Ac,将加入的H2O2换成相同体积的蒸馏水作为对照Ar。羟自由基清除率计算如式(2)所示:

1.3.5.4 还原能力的测定
根据Duh等[22]方法略作调整。取1 mL 15 mg/mL样品,加入2.5 mL磷酸盐缓冲液(pH 6.6)和2.5 mL的10 mg/mL铁氰化钾溶液,50 ℃保温20 min,快速冷却,加入2.5 mL 10 g/100 mL三氯乙酸溶液,混匀后于3 000 r/min离心10 min。取1.5 mL上清液与0.2 mL 0.1 g/100 mL氯化铁溶液反应10 min。以蒸馏水调零,在700 nm波长处测定其吸光度。
1.3.6 契达干酪的质构分析
参照Liu Lu等[9]的方法略作修改。用TA.XT plus型质构仪进行测定,测试前探头下降速率为5 mm/s,测试时速率为1.0 mm/s,触发点值为5 g,两次下降间隔为5.0 s。
1.3.7 契达干酪的感官评价
根据Ahmed等[23]的方法进行感官评价。评价标准如表1所示。

表1 契达干酪感官评价Table 1 Criteria for of sensory evaluation of Cheddar cheese
1.4 数据统计分析
每组实验重复3 次,数据统计分析采用Statistix 8.1软件进行分析,利用Origin软件进行作图。
2 结果与分析
2.1 菌株的诱变
2.1.1 紫外诱变时间的确定

图1 紫外诱变时间对菌株致死率的影响Fig. 1 Effect of UV mutation time on lethality
如图1所示,当诱变菌株的致死率达到80%~90%时,可得到变异程度较大的变异菌株[15]。以此为依据,选择100 s为菌株的最佳诱变时间。
2.1.2 诱变前后菌株的Pep X活性

图2 诱变前后菌株的Pep X活性变化Fig. 2 Activity of Pep X in strains before and after mutagenesis
以对硝基苯胺为标准物的标准曲线为y=5.965 5x+0.070 5,相关系数为0.999 5。如图2所示,诱变可使菌株所产Pep X活性不同程度提升,经过3 轮诱变后,L. rhamnosus的Pep X活性最高,最大值为12.73 U/mL。
2.1.3 诱变菌株遗传稳定性分析

表2 诱变菌株的传代稳定性实验结果Table 2 Genetic stability of mutant strains
如表2所示,比较诱变菌株的第1、5、10代,三者之间Pep X活性差异均不显著(P>0.05)。因此,经过紫外诱变后,菌株的遗传性状相对稳定,可作为非发酵剂乳杆菌用于后续的干酪制备。
2.2 契达干酪中Pep X活性
如图3所示,随着成熟时间的延长,在0~90 d内,干酪中Pep X活性均呈上升趋势,且均在第90天时达到最大值,而后呈现下降趋势。添加了非发酵剂乳杆菌的各组干酪中Pep X活性均高于空白组,且经过诱变后菌株所产的Pep X活性显著高于未经诱变的菌株(P<0.05)。此外,L. rhamnosus组、UV-R3组中的Pep X活性均高于其他组,其最大值分别为4.87、10.16 U/g(P<0.05)。这是由于Pep X属于胞内酶,干酪成熟过程中的微生物繁殖和代谢反应诱导了乳杆菌的自溶现象,使得Pep X活性不断升高。到后期产生的酶减少,加上成熟过程中环境的变化,酶活性降低,导致酶活性整体趋势有所下降。可推断,在前90 d内,乳杆菌逐渐自溶,致使Pep X活性也达到最大值。这与宋雪梅[24]的研究结果相似。


图3 契达干酪成熟过程中Pep X活性变化Fig. 3 Change in Pep X activity in Cheddar cheese during ripening
2.3 契达干酪活菌数

表3 契达干酪成熟过程中活菌数变化Table 3 Changes in viable cell count during the ripening process of Cheddar cheeeessee
由表3可知,随着成熟时间的延长,干酪中非发酵剂乳杆菌活菌数显著下降(P<0.05)。而在成熟的第180天时,各非发酵剂乳杆菌组干酪活菌数仍在7.01(lg(CFU/g))以上,符合益生菌食品活菌数的要求。此外,不同非发酵剂乳杆菌制备的契达干酪活菌数无显著性差异(P>0.05)。得出非发酵剂乳杆菌活菌数对干酪抗氧化活性的影响可忽略不计。
2.4 契达干酪成熟过程中抗氧化性
2.4.1 契达干酪成熟过程中DPPH自由基清除率
如图4所示,随着成熟时间的延长,在前90 d,水溶性提取物的D P P H自由基清除率均显著增加(P<0.05),且均在第90天时达到最大值(除空白组外最大值均达到30%以上)而后缓慢下降,且在第150天开始趋于稳定。这是由于在成熟前期,酪蛋白在Pep X的作用下不断降解,生成具有抗氧化活性的肽段,使得干酪抗氧化活性显著提升。而在90 d后,由于Pep X活性有所下降,抗氧化肽生成速度减慢,且在发酵剂等作用下,又被分解成不具抗氧化活性的小肽甚至游离氨基酸,最终抗氧化肽的生成与分解会达到动态平衡的状态,使抗氧化活性接近稳定的状态[25]。

图4 契达干酪成熟过程中DPPH自由基清除率Fig. 4 Change in DPPH radical scavenging rate during the ripening process of Cheddar cheese
此外,在整个成熟过程中,非发酵剂乳杆菌组的DPPH自由基清除率均显著高于空白组(P<0.05),且UV-R3组中的DPPH自由基清除率均显著高于其他组(P<0.05),为68.43%。这是由于添加PepX活性越高菌株,水解干酪中的酪蛋白能力越强,从而使得契达干酪水溶性提取物的DPPH自由基清除率越高。
2.4.2 契达干酪成熟过程中的羟自由基清除率

图5 契达干酪羟自由基清除率Fig. 5 Change in hydroxyl radical scavenging rate during the ripening process of Cheddar cheese
如图5所示,在成熟期的前90 d,契达干酪的羟自由基清除率均随着时间的延长而显著增加(P<0.05),在第90天达到最大值,而后开始缓慢下降,在150 d开始趋于平稳。在成熟过程中,非发酵剂乳杆菌组的羟自由基清除率均显著高于空白组(P<0.05),诱变后非发酵剂乳杆菌组羟自由基其清除率显著高于诱变前及空白组(P<0.05)。此外,L. rhamnosus组、UV-R3组的羟自由基清除率均显著高于其他组(P<0.05),分别为33.73%、67.56%。这是因为添加了产Pep X活性高的菌株,其Pep X可水解更多的酪蛋白,生成具有抗氧化活性的肽段,可与羟自由基结合,抑制其与其他物质发生反应,从而反映出较高的抗氧化活性[26]。
2.4.3 契达干酪成熟过程中还原能力

图6 契达干酪成熟过程中还原能力Fig. 6 Change in reducing power during the ripening process of Cheddar cheese
由图6可知,随着成熟时间的延长,契达干酪水溶性提取物的还原能力均呈现显著上升趋势,在第90天达到最大值,而后平缓下降至第150天时,达到稳定状态。此外,非发酵剂乳杆菌组还原能力均显著高于空白组,且添加了Pep X活性不同的非发酵剂乳杆菌后,其还原能力也存在着显著差异(P<0.05)。这是由于同一株非发酵剂乳杆菌,经过紫外诱变后,其Pep X活性显著高于未经诱变的菌株,进而导致水解能力有所不同,最终还原能力之间也存在着显著性差异。此外,L. rhamnosus组、UV-R3组还原能力显著高于其他相应组分,其还原能力(OD值)的最大值分别为0.367 3、0.684 3。这是由于干酪水溶性提取物的还原能力与分子质量大小有关,相同情况下,分子质量越小其还原能力越强[27],产Pep X活性较强的UV-P3组,其还原能力也随之提高。
2.5 相关性分析
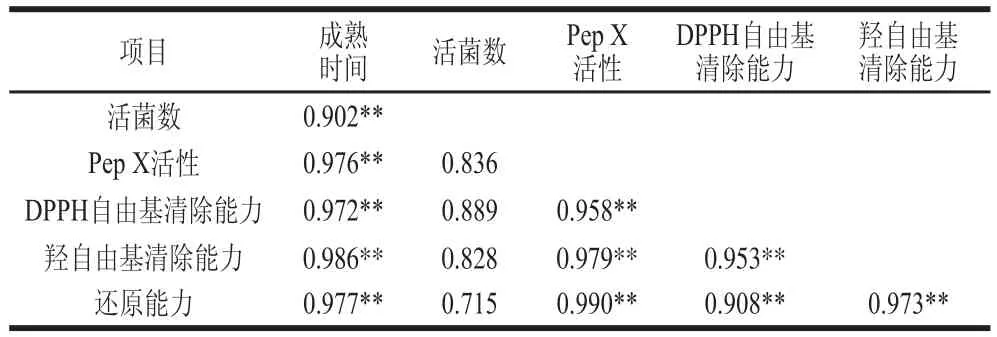
表4 添加UV-R3干酪中活菌数、Pep X活性和抗氧化性间的相关性分析Table 4 Correlation analysis between viable cell count, Pep X activity and antioxidant activity in cheese
为建立契达干酪的抗氧化活性与乳杆菌产的Pep X活性间的联系,选取抗氧化活性最高的UV-R3组,对活菌数、Pep X活性和抗氧化性间的相关性进行分析。如表4所示,干酪的抗氧化活性(DPPH自由基清除率、羟自由基清除能力、还原能力)与干酪的成熟时间极显著相关(P<0.01),说明Pep X活性可直接影响酪蛋白水解成抗氧化活性的肽,并最终影响干酪的抗氧化活性。
2.6 质构分析
由于在第90天时,干酪的抗氧化活性达到最大值,因此对成熟90 d后的干酪进行质构分析(表5)。胶凝性、凝聚性和咀嚼性无显著性的变化。空白组干酪的硬度显著高于非发酵剂乳杆菌组(P<0.05),这是由于高活性Pep X菌株的加入加速了酪蛋白的水解度,使得酪蛋白原有的网状结构被破坏,导致干酪的结构变得松散,最终硬度下降[28]。而空白组与非发酵剂乳杆菌组的胶黏性和咀嚼性并无显著差异(P>0.05)。加入高活性Pep X菌株的非发酵剂乳杆菌组干酪弹性显著高于空白组(P<0.05),而加入低活性Pep X菌株的非发酵剂乳杆菌组干酪弹性与空白组无显著差异(P>0.05)。这是由于Pep X属于胞内蛋白酶,将大分子的肽段水解,产生更多的共价键,使得干酪的网络结构破坏,形成更小的网状结构,进而提升了干酪的弹性[28]。

表5 契达干酪成熟90 d后质构分析Table 5 Texture analysis of Cheddar cheese ripened for 3 to 6 months
2.7 感官分析
如表6所示,随着成熟时间的延长,契达干酪的外观变化不显著,且风味评分均在120 d达到最大值,而后呈缓慢下降趋势。此外,随着成熟时间的延长,各组干酪的苦味得分均呈显著下降趋势(P<0.05)。非发酵剂乳杆菌组干酪苦味显著高于空白组(P<0.05),这是由于高活性的Pep X加速了酪蛋白水解,产生了苦味肽。
综合成熟过程中契达干酪的感官质构分析及抗氧化活性情况,可推断高活性Pep X的非发酵剂乳杆菌组可在成熟120 d食用,此时干酪抗氧化活性相对较高,感官及质构效果最佳[29-30]。

表6 契达干酪成熟90 d后感官分析Table 6 Sensory analysis of Cheddar cheese ripened for 3 to 6 months
3 结 论
利用诱变产生的高Pep X活性乳杆菌制备契达干酪,可以显著增加干酪的抗氧化性。在成熟过程的前90 d,其抗氧化活性(DPPH自由基清除率、羟自由基清除率和还原能力)随着时间的延长而逐渐升高,在第90天达到最大值,而后略有下降,在150 d后趋于稳定,但120 d后干酪苦味感官评分显著降低。UV-R3组的Pep X活性和抗氧化活性显著高于其他组(P<0.05)。由此,非发酵剂乳杆菌产Pep X活性与干酪的抗氧化活性间存在极显著正相关(P<0.01),且在成熟第120天时,苦味感较小且质构情况较好。

