酶解大豆分离蛋白-磷脂复合乳液的制备及稳定性分析
郑建樟,管军军*,路新开,刘 雪,朱 浩,冀旭阳
(河南工业大学生物工程学院,河南 郑州 450000)
大豆分离蛋白(soy protein isolate,SPI)是一种可以代替动物蛋白的植物高蛋白产品,蛋白含量大于90%,可以直接作为人体蛋白质的主要来源[1],SPI的高蛋白含量和独特的结构表现出了一系列的功能特性,主要包括乳化性、溶解性、起泡性、黏性、结团性、组织性、水合性、吸油性、胶凝性、起泡性、结膜性和调色性等[2];其中,乳化性是较为重要的一种性质,是维持乳液稳定的主要特性,利用蛋白质分子结构中的亲水、亲油基吸附在油-水界面上,形成一层膜,从而阻止油滴的聚集,起到稳定乳化的效果,使乳液更加稳定[3]。SPI在胃环境中易被胃蛋白酶水解,直接用SPI制备乳液,在胃中不稳定。酶解SPI因为已经被胃蛋白酶降解完全,所以在胃中胃蛋白酶不会再降解酶解过的SPI,使蛋白在胃中相对稳定。
磷脂是一种天然的表面活性剂,具有优良的乳化性、扩散性和浸润性,添加或喷涂到乳粉或豆粉上可提高产品的分散性和水溶性,是一种天然食品添加剂,现已广泛用于烘焙食品、人造奶油、医药保健等行业中[4-8]。
在真实的食品体系中,不只含有一种表面活性物质,例如在豆奶中,蛋白质和磷脂都具有表面活性;牛奶中也含有多种不同的表面活性物质,包括各种蛋白和磷脂。传统豆制品在加工中易形成乳化体系,其中存在的SPI与磷脂的交联作用对乳化体系有一定影响。磷脂的复合对SPI的功能性,尤其是乳化活性产生重要影响,且磷脂与不同变性程度的蛋白结合的稳定性也不同,这表明磷脂的结合对SPI功能性的改善有重要作用[9-15]。本实验通过对SPI改性,使酶解SPI-磷脂复合乳液在胃环境中(pH 2.0)稳定,以期为工业生产中提供一种运油性物质的天然活性载体提供理论依据。
1 材料与方法
1.1 材料与试剂
黄豆 市购;大豆卵磷脂粉末 郑州四维生物科技有限公司;金龙鱼大豆油 益海嘉里食品营销有限公司;胃蛋白酶(1 000 NFU/mg) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
FA 25高剪切分散乳化机 德国Fluko公司;FD-1冷冻干燥机 北京博医康实验仪器有限公司;Zetasizer Nano纳米粒度、Zeta电位分析仪 英国马尔文仪器有限公司;BH200生物显微镜 舜宇光学科技集团有限公司;722N可见分光光度计 上海精科仪器有限公司。
1.3 方法
1.3.1 SPI及酶解SPI的制备
SPI制备:采用文献[16-17]的方法。将大豆粉碎后过80 目筛,用石油醚脱脂,所得脱脂豆粉加10 倍蒸馏水磁力搅拌1 h,搅拌时用2 mol/L NaOH溶液调节pH值至8.0加速溶解,然后50 ℃水浴加热1 h,5 000 r/min离心30 min。离心所得上清液用2 mol/L HCl溶液调节pH值至4.8后4 ℃过夜,次日5 000 r/min离心50 min,取沉淀复溶,调pH值至7.0,冷冻干燥即得SPI。
SPI水解:3% SPI分散于水中,调节pH值至2.0,温度37 ℃,搅拌10 min,加入胃蛋白酶(酶与底物比1∶100),进行酶反应,反应过程中保持pH值恒定。当反应时间分别为0、5、10、15、20、25、30、35、40、45、50、55、60、90、120、150、180、210、240 min时取1 mL反应液,高温灭酶。参考文献[18-20]的方法:取各个时间的蛋白水解液用蒸馏水稀释100 倍,取2.00 mL稀释液于试管中并加入1.00 mL显色剂,混匀后置沸水浴中加热15 min,同时做空白实验,然后冷水冷却,加入5.00 mL 40%乙醇溶液混匀,放置15 min后用1 cm比色杯,以空白管调零于波长570 nm处测定吸光度。然后以时间为横坐标、吸光度为纵坐标作图,找到酶解完成时间120 min。
酶解SPI的制备:配制3% SPI溶液,调节pH值至2.0,温度37 ℃,搅拌时间10 min,加入胃蛋白酶(酶与底物比1∶100),进行酶反应,反应过程中保持pH值恒定。反应120 min后停止反应,调节pH值至7.0灭酶,冷冻干燥即得酶解SPI。
1.3.2 酶解SPI-磷脂复合乳液的制备
按照一定比例配制酶解SPI-磷脂复合乳液:取适量的酶解SPI用水溶解后20 000 r/min均质2 min,取一定量均质后的酶解SPI溶液和磷脂溶液混合,再加入适量的大豆油,20 000 r/min均质2 min,调pH值至2.0或7.0。
1.3.3 单因素试验
酶解SPI质量浓度:固定磷脂添加量0.001 0 g/mL、油相体积分数20%,酶解SPI质量浓度分别为0.001 0、0.002 5、0.010 0、0.015 0 g/mL和0.020 0 g/mL。
磷脂添加量:固定酶解SPI质量浓度0.010 0 g/mL、油相体积分数20%,磷脂添加量分别为0.000 5、0.001 0、0.002 0、0.005 0、0.010 0 g/mL和0.020 0 g/mL。
油相体积分数:固定酶解SPI质量浓度0.010 0 g/mL、磷脂添加量0.001 0 g/mL,油相体积分数分别为5%、10%、20%、25%、35%、45%。
1.3.4 正交试验设计
正交试验因素与水平设计见表1。

表1 正交试验因素与水平Table 1 Factors and levels used in orthogonal array design
1.3.5 显微镜观察
样品均质后,取50 μL乳液置于载玻片上,在物镜40 倍下观察乳液液滴形态。
1.3.6 乳液的粒径及Zeta电位测定
采用Zetasizer Nano测定乳状液滴的粒径大小及Zeta电位[21-23]。取50 μL乳液稀释到5.00 mL,然后取1 mL稀释液测定粒径及Zeta电位。
1.3.7 乳液的乳化活性指数(emulsification activity index,EAI)和乳化稳定指数(emulsion stability index,ESI)测定
参考文献[23-27]的方法。取50 μL乳液以0.001 0 g/mL十二烷基硫酸钠(pH 7.0)稀释500 倍,以十二烷基硫酸钠溶液为空白,测定波长500 nm处吸光度。测定0、30 min后溶液的吸光度A0、A30。按式(1)、(2)计算EAI及ESI:

式中:N为稀释倍数(500);C为蛋白质量浓度/(g/mL);Φ为油相体积分数/%;ΔA=A30-A0;ΔT为30 min。
1.3.8 乳层析指数测定
参考文献[27-30]的方法测定乳液层析指数,取10 mL的乳液于具塞比色管中,室温下观察乳液分层情况并拍照。按式(3)计算乳层析指数:

式中:H清、H分别为下清液体积、乳液总体积/mL。
1.4 数据处理
每个实验指标测定3 次,取用SAS 9.0统计学软件进行数据分析,P<0.05,差异显著。
2 结果与分析
2.1 酶解时间的确定

图1 SPI酶解时间对吸光度的影响Fig. 1 Effect of hydrolysis time of SPI on absorbance
从图1可以看出,随着酶解时间的延长,吸光度先变大再趋于稳定,在水解120 min后,吸光度稳定。这是由于在120 min时,SPI已经被胃蛋白酶基本完全降解。
2.2 酶解SPI质量浓度对复合乳液的影响
2.2.1 不同酶解SPI质量浓度复合乳液显微镜观察

图2 不同酶解SPI质量浓度复合乳液显微图Fig. 2 Micrographs of composite emulsions with different concentrations of SPI hydrolysate
如图2所示,在酸性(pH 2.0)条件下,随着酶解SPI质量浓度的增加,乳液液滴逐渐变小;在碱性(pH 7.0)条件下,随着酶解SPI质量浓度的增加,乳液液滴逐渐变小,其中0.010 0、0.015 0 g/mL和0.020 0 g/mL中乳液液滴较小,分布均匀,排列紧密。随着酶解SPI质量浓度的增加,可以观察到乳液的液滴越来越小,排列分布越来越均匀、紧密;这是由于蛋白分子中的亲油基团和亲水基团与油、水结合。说明酶解SPI在一定质量浓度范围内,会与磷脂结合,降低界面张力,阻止油滴的聚集,形成较小的液滴,起到维持乳液稳定的作用。在相同条件下,乳液在pH 2.0时的液滴相对pH 7.0时大,液滴均一差。这是由于酶解SPI在pH 7.0时在水中的溶解性比pH 2.0时稳定。
2.2.2 不同酶解SPI质量浓度复合乳液的粒径和电位

图3 不同酶解SPI质量浓度复合乳液的粒径、Zeettaa电位Fig. 3 Particle size and potential of composite emulsions with different concentrations of SPI hydrolysate
一般情况下,当乳液中的体积平均粒径越小,乳液的乳化性越好,越稳定。如图3所示,当pH 2.0时,乳液的Zeta电位均为正值,当酶解SPI质量浓度增加时电位先增大后稳定,当酶解SPI质量浓度在0.010 0 g/mL时,Zeta电位达到稳定,为15.7 mV;当酶解SPI质量浓度增加时粒径总体呈先减小再增大再减小再增大趋势,当酶解SPI质量浓度在0.001 0 g/mL时,由于蛋白含量太低,蛋白与磷脂结合不足,自由的磷脂较多,所以乳液整体粒径较小,当酶解SPI质量浓度为0.010 0 g/mL时,粒径为1 372 nm。所以在pH 2.0时,酶解SPI质量浓度在0.010 0 g/mL时,复合乳液最稳定,这是由于酶解SPI具有两性,适当的酶解SPI可以提高乳液的稳定性,过量的蛋白会导致在复合乳液中蛋白分布不均匀,乳液稳定性降低。
2.2.3 不同酶解SPI质量浓度复合乳液的ESI和EAI

图4 不同酶解SPI质量浓度复合乳液ESII、EEAAIIFig. 4 ESI and EAI of composite emulsions with different concentrations of SPI hydrolysate
如图4所示,当pH 7.0时,随着酶解SPI质量浓度的增加,EAI呈减小趋势,ESI总体先增大后趋于稳定。在同一酶解SPI质量浓度条件下,pH 2.0时的乳液EAI比pH 7.0大。
当pH 2.0时,随着酶解SPI质量浓度的增加,EAI呈减小趋势,ESI总体呈先增大后稳定趋势,当酶解SPI质量浓度为0.020 0 g/mL时,复合乳液ESI最大。
2.2.4 不同酶解SPI质量浓度复合乳液乳化层析

图5 不同酶解SPI质量浓度复合乳液乳化层析Fig. 5 CI of composite emulsions with different concentrations of SPI hydrolysate
乳层析指数越小,复合乳液越稳定。如图5所示,当酶解SPI质量浓度增加时乳层析指数呈减小趋势;当酶解SPI质量浓度为0.020 0 g/mL时,复合乳液最稳定(pH 2.0)。
2.3 磷脂添加量对乳液的影响和最适酶解SPI磷脂比例的确定
2.3.1 不同磷脂添加量复合乳液的显微镜观察

图6 不同磷脂添加量复合乳液的显微图Fig. 6 Micrographs of composite emulsions with different concentrations of phospholipids
如图6所示,当pH 2.0时,随着磷脂添加量的增加,乳液液滴逐渐变大,当磷脂添加量不小于0.005 0 g/mL,乳液的液滴明显增大;当pH 7.0时,随着磷脂添加量的变化,乳液液滴基本没有变化。这说明磷脂分子在中碱性条件下比酸性条件下更容易和蛋白分子结合,形成的乳液更加稳定,乳液的液滴较小。在相同条件下,乳液在pH 2.0时的液滴比pH 7.0时大,液滴均一性差。这是由于磷脂在pH 7.0时比pH 2.0时更容易和蛋白结合。
2.3.2 不同磷脂添加量复合乳液的粒径和电位

图7 不同磷脂添加量复合乳液的粒径、Zeettaa电位Fig. 7 Particle size and potential of composite emulsions with different concentrations of phospholipids
如图7所示,当pH 2.0时,乳液的Zeta电位随着磷脂添加量增加先不变再变小,由正值变为负值。当磷脂添加量小于0.002 0 g/mL,Zeta电位稳定,大于0.002 0 g/mL时,Zeta电位随磷脂添加量增大而变小,磷脂添加量为0.002 0 g/mL时,Zeta电位为14.57 mV;当磷脂添加量大于0.005 0 g/mL时,粒径相对稳定,在1 853.00 nm左右。所以在pH 2.0时,磷脂添加量在0.002 0 g/mL时,复合乳液最稳定。当pH 7.0时,乳液的Zeta电位均为负值,当磷脂添加量增加时Zeta电位先增大再减小后趋于稳定,当磷脂添加量为0.005 0 g/mL时,Zeta电位达到最大值,为-43.067 mV;当磷脂添加量增加时粒径总体呈先减小再增大趋势,当磷脂添加量为0.005 0 g/mL时,粒径达到最小值,为673.60 nm。所以在pH 7.0时,磷脂添加量在0.005 0 g/mL时,复合乳液最稳定。
2.3.3 不同磷脂添加量复合乳液的ESI和EAI

图8 不同磷脂添加量复合乳液的EAII和EESSIIFig. 8 EAI and ESI of composite emulsions with different concentrations of phospholipids added
如图8所示,当pH 2.0时,随着磷脂添加量的增加,EAI先增大再减小,ESI总体呈先增大再减小趋势,当磷脂添加量为0.001 0 g/mL时,复合乳液的EAI最高,乳液的ESI最大。当pH 7.0时,随着磷脂添加量的增加,EAI呈增大趋势,ESI总体先增大再稳定,当磷脂添加量在0.001 0 g/mL时,复合乳液的ESI最大。在同一磷脂添加量下,pH 2.0时的乳液EAI和ESI比pH 7.0时小。
2.3.4 不同磷脂添加量复合乳液的乳化层析

图9 不同磷脂添加量复合乳液的乳化层析Fig. 9 CI of composite emulsions with different concentrations of phospholipids
如图9所示,当磷脂添加量增加时乳层析指数呈增大趋势;当磷脂添加量为0.001 0 g/mL时,复合乳液最稳定。
2.4 油相体积分数对乳液的影响和最适油相比例的确定
2.4.1 不同油相体积分数复合乳液的显微镜观察
如图10所示,当pH 2.0时,随着油相体积分数的增加,乳液液滴逐渐变大,当油相体积分数不小于35%时,乳液的液滴明显增大;pH 7.0条件下,随着油相体积分数的变化,乳液液滴基本没有变化,当油相体积分数在45%时,乳液的液滴明显变大。这说明在低油条件下,形成的乳液更加稳定,乳液的液滴较小。在相同条件下,乳液在pH 2.0时的液滴比pH 7.0大,液滴均一性差。这是由于蛋白在pH 7.0时亲油基团比pH 2.0时更容易大豆油结合,从而阻止油滴的聚集,达到稳定乳化的作用。

图10 不同油相体积分数复合乳液的显微图Fig. 10 Micrographs of composite emulsions with different oil phase volume fractions
2.4.2 不同油相体积分数复合乳液的粒径和电位

图11 不同油相体积分数复合乳液的粒径、Zeettaa电位Fig. 11 Particle size and potential of composite emulsions with different oil phase volume fractions
如图11所示,当pH 2.0时,乳液的Zeta电位均为正值,油相体积分数增大时乳液的Zet a电位先增大后稳定,当油相体积分数为20%时,Zeta电位达到最大值,为10.77 mV;当油相体积分数增加时粒径总体先增大再趋于稳定,当油相体积分数为20%时,粒径达到稳定。当pH 7.0时,乳液的Zeta电位均为负值,当油相体积分数增加时,Zeta电位先减小后稳定,当油相体积分数为25%时,Zeta电位达到稳定,为-51.57 mV;当油相体积分数增加时,粒径总体呈先增大再减小再增大趋势,当油相体积分数在20%时,粒径达到最大值,为2 377.33 nm。当pH 2.0时,乳液的粒径和Zeta电位比pH 7.0大,这是由于蛋白在pH 7.0时亲油基团比pH 2.0时更容易与大豆油结合,从而阻止油滴的聚集,达到稳定乳化的作用。
2.4.3 不同油相体积分数复合乳液的ESI和EAI
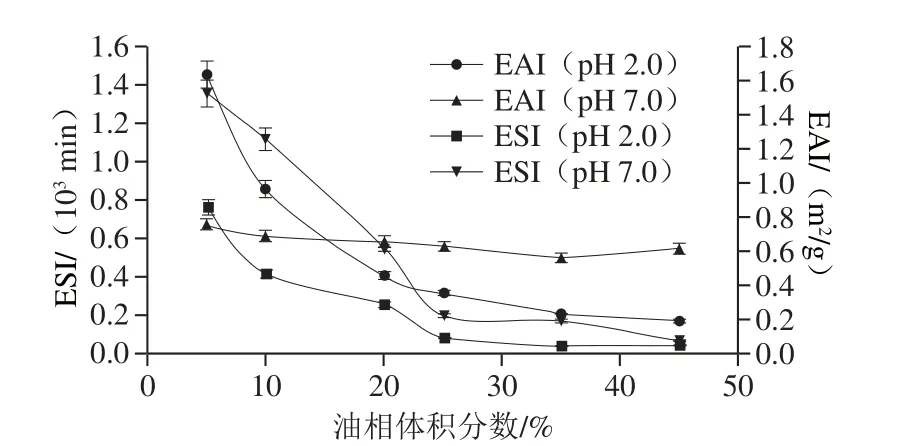
图12 不同油相体积分数复合乳液的EAII和EESSIIFig. 12 EAI and ESI of composite emulsions with different oil phase volume fractions
如图12所示,pH 2.0和pH 7.0条件下,随着油相体积分数的增加,EAI呈减小趋势,ESI总体呈减小趋势。
2.4.4 不同油相体积分数复合乳液的乳化层析

图13 不同油相复合乳液的乳层析Fig. 13 CI of composite emulsions with different oil phase volume fractions
如图13所示,当油相体积分数增加时,乳层析指数呈减小趋势。
2.5 正交试验结果
从表2可以看出,直观分析得到理论上pH 2.0时Zeta电位的最优组合为A3B1C1,粒径的最优组合为A3B1C1,EAI的最优组合为A3B1C1,ESI的最优组合为A3B1C1,乳层析指数的是最优组合为A3B1C3。
通过综合评分法,对各指标按照优劣转换为单指标评分,其中最优值为10.00,最劣值为1.00,其余按比例给分,因为各指标重要性大致相同,取5 个指标评分之和为综合评分。由表2、3可知,各因素主次顺序为C、B、A,得出最优组合A3B1C1:酶解SPI质量浓度为0.020 0 g/mL,磷脂添加量为0.000 5 g/mL,油相体积分数为10%。

表2 pH 2.0时正交试验设计与结果Table 2 Orthogonal array design with experimental results for composite emulsions at pH 2.0

表3 pH 2.0时综合评分Table 3 Comprehensive evaluation scores of composite emulsions at pH 2.0
按最优组合A3B1C1进行实验得出的指标:Zeta电位为17.09 mV,粒径为1 278.00 nm,EAI为1.803 m2/g,ESI为708.25 min,乳层析指数为0.79,综合评分为49.40;与其他9号试验相比最优组合。
从表4可以看出,直观分析得到理论上pH 7.0时Zeta电位的最优组合为A2B3C2,粒径的最优组合为A1B3C2,EAI的最优组合为A3B2C1,ESI的最优组合为A3B2C1,乳层析指数的最优组合为A2B1C3。
通过综合评分法,由表4、5可知,各因素主次顺序为C、B、A,得出最优的组合为8号试验A3B2C1:酶解SPI质量浓度0.020 0 g/mL,磷脂添加量0.001 0 g/mL,油相体积分数10%。经验证,最优条件为酶解SPI质量浓度0.020 g/mL,磷脂添加量0.001 0 g/mL,油相体积分数10%。

表4 pH 7.0时正交试验设计结果Table 4 Orthogonal array design with experimental results for composite emulsions at pH 7.0

表5 pH 7.0时综合评分Table 5 Comprehensive evaluation score of composite emulsions at pH 7.0
3 结 论
酶解120 min后SPI酶解完全。通过单因素试验得出:适当增加SPI质量浓度,可以提高酶解SPI-磷脂复合乳液的稳定性;低磷脂添加量时,酶解SPI-磷脂复合乳液的稳定性较好;酶解SPI-磷脂复合乳液的稳定性随着油相体积分数的增加而降低。通过正交试验设计,当pH 7.0时,酶解SPI-磷脂复合乳液最佳稳定性条件为酶解SPI质量浓度0.020 0 g/mL、磷脂添加量0.001 0 g/mL、油相体积分数10%。当pH 2.0时,酶解SPI-磷脂复合乳液最佳稳定性条件为酶解SPI质量浓度0.020 0 g/mL、磷脂添加量0.000 5 g/mL、油相体积分数10%。为了得到过胃保护的载体,胃环境(pH 2.0)酶解SPI-磷脂复合乳液最佳稳定性条件为酶解SPI质量浓度0.020 0 g/mL、磷脂添加量0.000 5 g/mL、油相体积分数10%。

