新生儿听力筛查结果及影响因素分析和临床指导意义
赵洪春车娟张肖林刘秀珍徐舒舒陈军王延飞*
1滨州医学院附属医院耳鼻咽喉头颈外科
2滨州医学院附属医院临床实验室
听力障碍是一种先天性缺陷性疾病,我国新生儿耳聋发病率为0.1-0.3%,高危新生儿为2-4%,现有听力障碍患者2004万,每年约有3万重度听障新生儿出生[1]。新生儿听力筛查,意在早期发现新生儿、婴幼儿听力损失情况,实现早期诊断早期干预和治疗的目的,并通过随访,发现一些迟发性耳聋患者,进行有效的干预。本研究对滨州医学院附属医院及滨州市妇幼保健院2013~2014年期间出生的且接受听力筛查4200例新生儿进行听力筛查,针对高危新生儿行基因检测,并针对性追踪随访,现将筛查结果,基因检测结果,随访出现的问题以及对临床治疗的指导意义做如下报告:
1 对象与方法
1.1 研究对象
2013.01~2014.01滨州医学院附属医院及滨州市妇幼保健院出生的4200例新生儿(男2200例,女2000例);正常生产儿3817例,监护病房(NICU)383例,家属均签署自愿行听力筛查项目的知情同意书。
1.2 研究方法
1.2.1 听力筛查方法及流程
使用仪器:(丹麦Madsen)耳声发射听力筛查仪及自动听性脑干反应筛查仪。
检测流程:出生后2~5天即可采用OAE初筛,NICU中新生儿待病情稳定后(平均日龄7天)OAE初筛,通过者,3岁以内电话随访。未通过者于生后30~42天均采用OAE+AABR复筛,复筛未通过者在出生后3个月去指定上级听力筛查诊断中心淄博市妇幼保健院行耳声发射、声导抗等诊断性听力检查,必要时行CT及MRI检查。
检测要求:房间环境的噪声<45dB SPL,测试时新生儿处于自然睡眠安静状态,必要时用10%的水合氯醛镇静,测试的时间一般为5~10分钟,反复测量直至确诊。
以 ABR波Ⅴ反应阈[2]>30 dB nHL作为 2-4kHz范围听力损失指标,同时根据本院纯音测听及测听室环境进行校正定级如下:轻度31-50 dB nHL,中度 51-70 dB nHL,重度 71-90 dB nHL,极重度≥91 dB nHL。同一人两耳存在不同程度的听力损失时,以听力损失较轻一侧为准计算。
1.2.2 危险因素调查方法
参照2007年美国儿科学会婴儿听力联合委员会(JCIH)有关高危因素[3]设计调查表格,由新生儿家长填写调查表。内容包括:(1)新生儿:性别、胎重、胎龄、分娩方式、产次、出生后Apgar评分、有无先天性头面部畸形,有无高胆红血症。(2)产妇:年龄、是否辅助生殖、有无妊娠期高血压、糖尿病、是否有耳聋家族史,围生期是否有TORCH感染及先兆流产,羊水过少或污染。
1.2.3 高危新生儿基因检测
入选对象:1)听力障碍家族史;2)孕妇>35岁;3)新生儿Apgar评分<7分;4)妊娠期间耳毒药物史;5)高胆红素血症(血清胆红素浓度>211μmol/L)。总共215例,所有新生儿出生时或出生后3d内采集新生儿脐带血或足跟血,筛查线粒体DNA 12SrRNA m.1555A>G点突变、GJB2基因编码区和SLC26A4基因c.919-2A>G突变位点。
1.2.4 统计方法
采用SPSS17.0统计软件对数据进行统计分析,两独立计数资料的单因素分析采用χ2检验(若某一资料频数1≤T<5,则采用矫正的χ2检验。若频数T<1采用Fisher确切概率法,检验水准为0.05,即当P<0.05时认为差异有统计学意义。
1.2.5 随访方法
对未进行复筛(107例)或未通过复筛(50例)共157例及9例基因检测异常新生儿进行随访登记并备份,于生后3个月、6个月、1年、2年定期行电话随访,随访内容依据婴幼儿听觉发育观察项目表[4]自行制定。
2 结果
2.1 4200例新生儿听力筛查情况
初筛结果:初筛率100%,未通过率为11.83%(497/4200);复筛结果:复筛率78.5%(390/497),未通过率为12.8%(50/390(正常新生儿12例,NICU 38例))详见表1。诊断结果:复筛未通过者,确诊感音神经性听力下降5例,其中正常生产儿1例(2%),NICU4例(8%)。单耳听损率为20%(1/5),双耳占80%(4/5),轻度听损40%(2/5),中重度听损60%(3/5)。详见表2。
2.2 听力筛查危险因素分析结果
产妇年龄(P=0.000)、胎龄(P=0.000)、胎重(P=0.000)、Apgar(1min)<7分(P=0.000)、耳毒性药物史(P=0.000)、听力障碍家族史(P=0.000)、羊水异常(P=0.011)等7个因素对听力初筛的影响具有统计学意义,本研究组发现听力损失公认的危险因素高胆红血症在初筛单因素分析中差异(P=0.065>0.05),无统计学意义(详见表3)。
2.3 基因筛查结果
高危新生儿基因检测,入选对象总共215例。9例基因检测异常(4.2%)。3例属于听力障碍家族史,2例初筛及复筛均未通过,确诊为感音神经性听力下降,均为GJB2基因c.235de1C患儿,1例正常,为线粒体DNA 12SrRNA m.1555A>G;2例孕妇>40岁,初筛复筛均通过,为线粒体DNA 12SrRNA m.1555A>G;3例为高胆红素血症患儿,1例复筛未通过,确诊为感音神经性听力下降,SLC26A4基因c.919-2A>G,2例正常为GJB2基因携带者;1例新生儿Apgar评分<7分,初筛复筛均通过,为线粒体DNA 12SrRNA m.1555A>G。
2.4 听力损失在双耳分布情况及后续治疗情况
1例单耳听力损失佩戴助听器,S-S言语发育评估表显示:言语发育正常[5,6];4例双耳听力损失中除1例极重度听力损失患者家属拒绝继续治疗外其余均给予及时恰当的后续治疗,其中1例轻度耳聋,给予佩戴助听器,言语发育正常,2例在2岁时行人工耳蜗植入,其中1例言语发育稍落后,给予康复治疗,余言语发育均基本正常。

表1 4200例正常新生儿与高危新生儿听力筛查结果展示Table 1 Hearing screening results of 4200 normal and high-risk newborns

表2 5例听力损失新生儿听力损失耳数及程度分布Table 2 Ear number and degree distribution of hearing loss in 5 newborn cases with hearing loss
2.5 随访结果
未进行复筛或未通过复筛157例,随访率63.7%;9例基因检测异常新生儿进行随访,随访率100%(表4)。

表3 影响听力初筛的危险因素(卡方检验)Table 3 Risk factors of hearing screening(chi-square test)
3 讨论
新生儿听力筛查(UNHS)是早期发现新生儿听力障碍的有效措施,诊断明确的听障婴幼儿进行科学的干预(佩戴助听器、人工耳蜗植入、人工耳蜗植入后康复训练等),以达到减少聋哑的发生。随着全国各地新生儿UNHS项目广泛而深入的实施,不同地区的听力损失检出率情况各不相同,初筛未通过的新生儿是听力筛查工作的重点人群,高危新生儿听力筛查通过率明显低于正常新生儿(表1)(复筛未通过率为12.8%(50/390,NICU 38例),说明NICU中的新生儿受各种高危因素影响,是听力障碍的来源人群和危险人群,严格把控高危因素是预防听力损失的重中之重。本研究组对于筛查加强人员及资金投入,使复筛率达78.5%。正常新生儿听力损失检出率为0.026%(1/3817),高危新生儿听力损失检出率为1.04%(4/383),低于2013-2016年泰安市[7]汇总数据,说明听力筛查存在地域差异性,要求我们逐层逐地域谈论,联合不同区域进行全面评估。另一方面考虑本研究组研究的样本量较小,还需要进一步的加大样本量以提高听力筛查的准确性。
新生儿听力损失有内因和外因等多种因素引起,本研究组发现听力损失公认的危险因素高胆红血症在初筛单因素分析中差异P=0.065>0.05,众所周知高胆红素血症与核黄疸对脑干听觉核、听神经及螺旋神经节细胞均具有一定得毒性,能引起外周神经髓鞘病变,且听力损伤程度与胆红素浓度相关[8]。本研究结论相反可能原因为:①临床新生儿病房高胆红血症的诊疗技术水平的进步;②家长对新生儿高度重视,及时进行治疗;③耳声发射(OAE)可以客观地检测耳蜗毛细胞的功能,而对高胆红血症所造成的神经性损伤不那么敏感[9]。本研究中将高胆红血症列为高危因素进行基因检测,发现3例为高胆红素血症患儿,1例复筛未通过,确诊为感音神经性听力下降,为SLC26A4基因c.919-2A>G患儿,2例正常为GJB2基因携带者;这说明高胆红素血症对新生儿听力具有一定的毒性其可能与基因相关,下一步找到相关基因并研究其之间的相关性。同时我们应用ABR检测,很好反映耳蜗、听神经和脑干听觉通路的活动,特异性高[10],提高了筛查的准确性。
孙鹏程、胡海利等[11,12]对影响初筛及复筛具有统计学意义的单因素进一步进行多元Logistic回归分析,结果显示独立危险因素为出生体重<1500g,多胎妊娠、孕期使用糖皮质激素及新生儿颌面部畸形等。本研究中体重<1500g及孕周<36周且>28周的新生儿为早产、低体重儿,其初筛及复筛筛查通过率低于正常新生儿,与上述结果一致,具备这些高危因素的婴幼儿即使通过了初筛或者复筛也应加强随访,避免漏诊或者迟发性耳聋的发生。此外,过期儿易出现羊水减少、浑浊,导致胎儿宫内缺氧窒息,亦造成不可逆的听力损伤[13,14]。我们的基因检测也提示1例新生儿Apgar评分<7分,初筛复筛均通过,为线粒体DNA 12SrRNA m.1555A>G基因突变阳性,所以对于这种高危新生儿有必要行基因检测,进行育后指导。
2007年以来,我国开始试点实施新生儿听力和基因联合筛查,在于通过出生后的听力与基因联合筛查以达到二级预防目的。有研究表明,听力联合基因筛查提高了随访率和耳聋及高危聋儿的检出率[15]。所以我们选择听力联合基因筛查,对高危因素人群进行基因筛查。发现9例基因检测异常(4.2%)新生儿,说明基因检测在听力损失检测中的重要性。通过基因筛查分析,线粒体基因阳性新生儿,告知系母系遗传,对于女性的耳毒性药物使用要谨慎;对于未致病的基因携带者,给予婚前教育,避免同样携带者作为配偶;对于检测出已知基因造成的听损患儿可行个体化基因治疗。
最后对于未进行复筛(107例)或未通过复筛(50例)及9例基因检测异常新生儿我们进行随访,结果发现未进行复筛或未通过复筛157例,随访率63.7%;9例基因检测异常新生儿进行随访,随访率100%。这说明基因筛查更能引起人们的关注,在后续为能发现假阴性中听神经病、迟发性进行性的听力损失、药物敏感性耳聋的问题提供保障,同时对药物敏感性聋和迟发性聋进行预警,有效地预防和减少耳聋的发生,实现真正意义上的早期预防和早期干预。
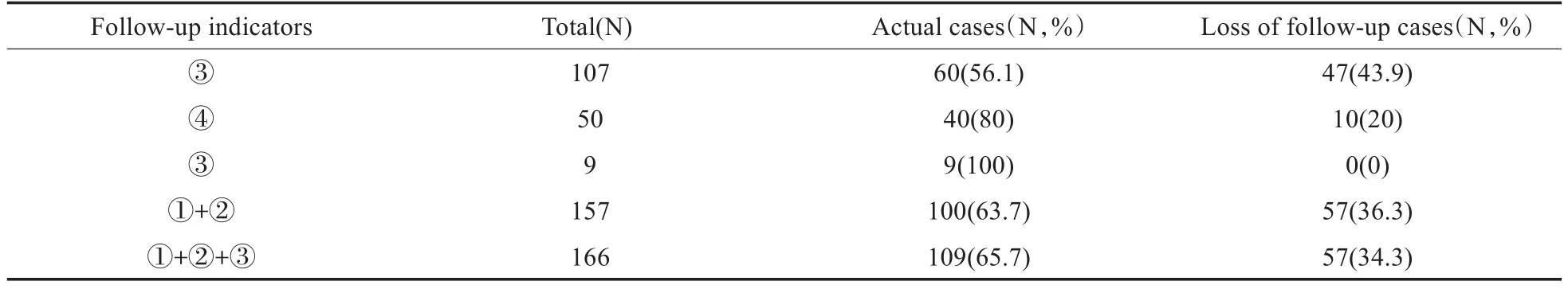
表4 随访及失访情况Table 4 Follow-up and loss of follow-up

