miR-24-3p靶向HAP1基因对STZ诱导胰岛β细胞凋亡的影响
付莎莉 王莉 付阿丹 李娜
(华中科技大学同济医学院附属武汉市中心医院内分泌科,湖北 武汉 430000)
胰岛β细胞功能受损是引发2型糖尿病的主要因素,而细胞凋亡是促使胰岛β细胞功能异常的重要原因,胰岛β细胞凋亡可通过破坏胰岛结构及降低其功能进而促使患者血糖升高〔1,2〕。因而探讨胰岛β细胞凋亡发生机制对有效提高2型糖尿病患者治疗效果具有重要研究价值。研究表明1型和2型糖尿病患者的血浆中微小RNA(miR)-24水平升高〔3,4〕。在肥胖相关的糖尿病小鼠的胰岛中miR-24的表达明显高于对照组,过表达miR-24会导致胰岛β细胞的胰岛素分泌功能障碍并抑制胰岛β细胞增殖〔5〕。然而,miR-24-3p在链尿佐菌(STZ)诱导的胰岛β细胞凋亡过程中的表达未见相关报道。通过靶基因预测软件分析亨廷顿蛋白相关蛋白(HAP)1可能是miR-24-3p的靶基因,研究表明沉默 HAP1 表达可增加小鼠胰岛β细胞株NIT细胞凋亡,同时也能促进STZ诱导的胰岛NIT 细胞的凋亡〔6〕。本研究拟探讨miR-24-3p是否通过靶向调节HAP1表达影响STZ诱导的胰岛NIT 细胞凋亡。
1 材料与方法
1.1主要试剂 STZ购自美国Sigma公司;小鼠胰岛β细胞系NIT购自上海通派生物科技有限公司;RPMI1640培养基购自上海博升生物科技有限公司;胎牛血清购自北京全式金生物技术有限公司;miR-24-3p mimic、miR-24-3p抑制剂(anti-miR-24-3p)及其对照均购自广州锐博生物科技有限公司;pcDNA3.1载体购自美国Invitrogen公司;LipofectamineTM2000 转 染 试 剂 盒购自上海慧颖生物科技有限公司;聚合酶链反应(PCR)试剂盒购自美国Thermo Fisher公司;双荧光素酶报告基因质粒(pGL3载体)购自上海汉恒生物科技有限公司;双荧光报告系统购自美国Promega公司;细胞裂解液购自北京奥维亚生物技术有限公司;Annexin V/碘化丙啶(PI)细胞凋亡试剂盒购自美国Life公司;HAP1 siRNA及si-NC均购自山东维真生物科技有限公司;HAP1抗体购自美国Sigma公司;B细胞淋巴瘤(Bcl)-2与Bcl-2相关X抗体(Bax)抗体均购自美国Abcam公司;活化的半胱氨酸蛋白酶(cleaved-caspase)-3抗体购自美国CST公司;辣根过氧化物酶标记的免疫球蛋白(Ig)G二抗购自美国Thermo公司。
1.2胰岛β细胞培养及转染 取出冻存胰岛β细胞NIT,接种于6孔板(2×105个细胞/ml),置于含有10%胎牛血清的RPMI1640培养基,放入37℃、5%CO2培养箱培养,转染前1 d更换为不含胎牛血清的RPMI1640培养基,分别将anti-miR-NC、anti-miR-24-3p、pcDNA 、pcDNA-HAP1转染入NIT细胞,转染6 h后更换RPMI1640完全培养基。转染过程均严格按照LipofectamineTM2000转染试剂说明书进行操作。
1.3胰岛β细胞处理及分组 选取对数生长期NIT分为Con组、STZ组,其中Con组NIT细胞不进行任何处理,STZ组NIT细胞中加入5 mmol/L STZ作用24 h〔7〕。收集转染后12 h的NIT细胞,分别加入5 mmol/L STZ作用24 h,分别为STZ+anti-miR-NC组、STZ+anti-miR-24-3p组、STZ+pcDNA组、STZ+pcDNA-HAP1组。为了验证HAP1与miR-24-3p在STZ诱导的胰岛β细胞凋亡过程中的作用,分别将si-NC、si-HAP1与anti-miR-24-3p共同转染NIT细胞,12 h后分别加入5 mmol/L STZ作用24 h,分别为STZ+anti-miR-24-3p+si-NC组、STZ+anti-miR-24-3p+si-HAP1组。
1.4实时荧光定量(qRT)-PCR实验 用Trizol法提取各组NIT细胞总RNA,利用紫外分光光度计测定RNA浓度与纯度(1.8≤A260/A280≤2.0),分别取2 μl RNA进行反转录合成cDNA,采用qRT-PCR检测miR-24-3p 、HAP1 mRNA表达水平,反应体系20 μl:2×SYBR Premix Ex TaqTM10 μl,cDNA 2 μl,上下游引物各0.8 μl,50×ROX Reference 0.4 μl,ddH2O 补足至20 μl。PCR反应程序设置为95℃预变性5 min循环1次,95℃变性20 s,60℃退火20 s,72℃延伸30 s,共循环40次。根据PCR仪分析软件计算miR-24-3p 、HAP1 mRNA相对表达量。
1.5Western印迹实验 提取各组NIT细胞总蛋白,定量蛋白,以每孔30 μg蛋白样加入10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)孔内,将分离蛋白凝胶转移到聚偏氟乙烯(PVDF)膜,采用脱脂奶粉封闭,2 h后分别加入HAP1、Bcl-2、Bax、cleaved-caspase-3蛋白一抗(1∶1 000),4℃避光孵育,过夜,分别加入二抗(1∶5 000),用电化学发光液(ECL)显影,曝光,置于凝胶成像分析系统分析各蛋白条带并应用Quantity one软件分析蛋白条带灰度值,HAP1、Bcl-2、Bax、cleaved-caspase-3均以GAPDH为内参基因。实验均重复3次。
1.6双荧光素酶报告实验 收集对数生长期NIT细胞,接种于24孔细胞培养板,分别将野生型(WT)-HAP1、突变型(MUT)-HAP1与miR-NC、miR-24-3p mimic共转染,24 h后利用双荧光素酶报告基因检测系统检测细胞荧光素酶活性,弃各孔培养基,分别加入细胞裂解液,摇床振荡1 h后分别收集细胞裂解液,置于离心机离心1 min(1 200 r/ min转速),接种于96孔细胞培养板,严格按照荧光素酶检测试剂盒说明书操作并检测细胞相对荧光素酶活性。
1.7流式细胞术实验 取1.3中各组NIT细胞,胰蛋白酶消化,预冷磷酸盐缓冲液(PBS)洗涤细胞,加入500 μl结合缓冲液重悬细胞,依次分别加入5 μl Annexin V-异硫氰酸FITC、PI,混匀后室温避光孵育5 min,置于流式细胞仪检测各组NIT细胞凋亡率。
1.8统计学处理 采用SPSS21.0软件进行独立样本t检验、单因素方差分析、χ2检验。
2 结 果
2.1STZ对胰岛β细胞中miR-24-3p和HAP1表达的影响 STZ组胰岛β细胞中miR-24-3p相对表达量相较于Con组明显升高(P<0.001),而HAP1 mRNA及蛋白表达均明显降低(P<0.001),见图1、表1。表明STZ可促使胰岛β细胞中miR-24-3p表达上调,HAP1表达下调,由此推测miR-24-3p与HAP1可能存在负向调控关系。

图1 HAP1蛋白表达

表1 STZ对胰岛β细胞中miR-24-3p和HAP1表达的影响
2.2miR-24-3p靶向调控HAP1的表达 HAP1可能为miR-24-3p的靶基因,见图2A。双荧光素酶报告实验验证miR-24-3p与HAP1的靶向关系,miR-24-3p mimic与WT-HAP1基因3′非翻译区(UTR)报告基因载体共转染时,胰岛β细胞NIT的荧光素酶活性明显被抑制(P<0.001),而miR-24-3p mimic与WT-HAP1基因3′UTR报告基因载体共转染时,NIT细胞荧光素酶活性无明显变化(P>0.05),见表2。在NIT细胞中转染miR-24-3p mimic后,miR-24-3p组HAP1蛋白(0.16±0.03)显著低于miR-NC组(0.57±0.05,P<0.05);而转染miR-24-3p抑制剂后anti-miR-24-3p组HAP1蛋白(0.89±0.08)显著高于anti-miR-NC组(0.58±0.05,P<0.05),见图2B。表明HAP1是miR-24-3p的靶基因,miR-24-3p可负向调控靶基因HAP1表达。
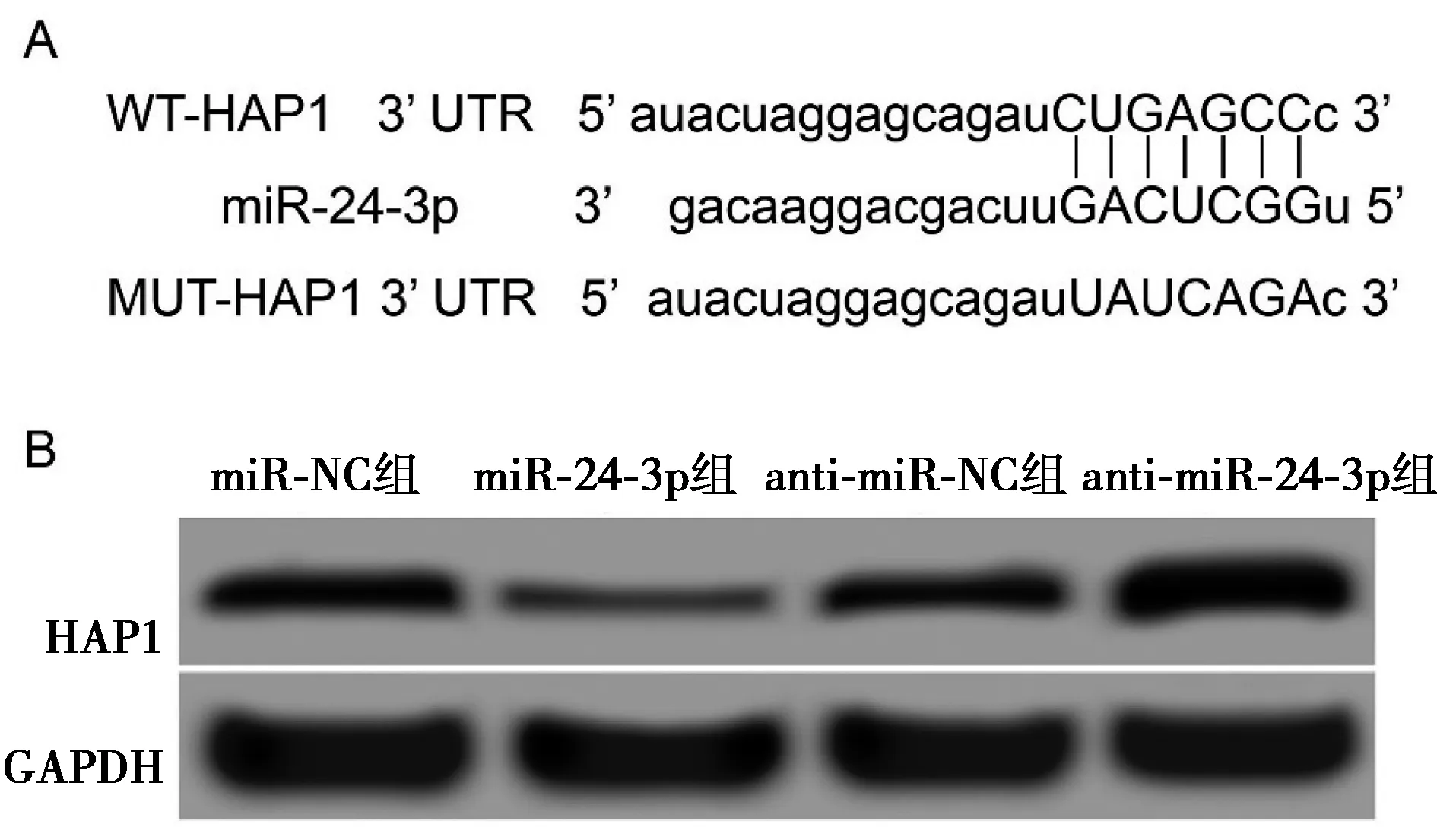
A:HAP1的3′UTR中含有与miR-24-3p互补的核苷酸序列;B:HAP1蛋白表达图2 miR-24-3p靶向调控HAP1的表达

表2 双荧光素酶报告实验
2.3抑制miR-24-3p表达对STZ诱导的胰岛β细胞凋亡的影响 STZ组NIT细胞凋亡率明显高于Con组(P<0.05),表明STZ可促使胰岛β细胞凋亡。与STZ+anti-miR-NC组相比,STZ+anti-miR-24-3p组NIT细胞凋亡率明显降低,差异有统计学意义(P<0.05),抗凋亡蛋白Bcl-2蛋白表达上调,差异有统计学意义(P<0.05),促凋亡蛋白Bax、cleaved-caspase-3蛋白表达下调(P<0.05),见图3、图4、表3。表明STZ可能通过上调miR-24-3p表达进而促进胰岛β细胞凋亡。

1~4:Con组、STZ组、STZ+anti-miR-NC组、STZ-anti-miR-24-3p;图5同图3 Western印迹检测Bcl-2、Bax、cleaved-caspase-3蛋白表达

图4 抑制miR-24-3p表达对STZ诱导的胰岛β细胞凋亡的影响

表3 抑制miR-24-3p表达对STZ诱导的胰岛β细胞凋亡的影响
2.4HAP1过表达对STZ诱导的胰岛β细胞凋亡的影响 与STZ+pcDNA组相比,STZ+pcDNA-HAP1组NIT细胞中HAP1蛋白表达明显上调(P<0.05),提示HAP1过表达NIT细胞株构建成功。相较于STZ+pcDNA组,STZ+pcDNA-HAP1组NIT细胞凋亡率明显降低(P<0.05),Bax、cleaved-caspase-3蛋白表达水平降低(P<0.05),而Bcl-2蛋白表达水平升高(P<0.05),见表4、图5。表明HAP1过表达可能通过上调Bcl-2蛋白表达并促使Bax、cleaved-caspase-3蛋白表达下调进而抑制STZ诱导的胰岛β细胞凋亡。

表4 HAP1过表达对STZ诱导的胰岛β细胞凋亡的影响

图5 HAP1和凋亡相关蛋白表达
2.5抑制HAP1表达逆转了抑制miR-24-3p表达 对STZ诱导的胰岛β细胞凋亡的作用 STZ+anti-miR-24-3p+si-HAP1组NIT细胞中HAP1蛋白表达明显低于STZ+anti-miR-24-3p+si-NC组(P<0.05),表明抑制miR-24-3p表达可拮抗STZ对HAP1蛋白表达的抑制作用。与STZ+anti-miR-24-3p+si-NC组相比,STZ+anti-miR-24-3p+si-HAP1组NIT细胞凋亡率及Bax、cleaved-caspase-3蛋白表达水平均明显升高(P<0.05),而Bcl-2蛋白表达水平明显降低(P<0.05),见表5、图6。表明抑制HAP1表达可提高STZ对miR-24-3p表达的促进作用进而促进胰岛β细胞凋亡。

表5 抑制HAP1表达逆转了抑制miR-24-3p表达对STZ诱导的胰岛β细胞凋亡的作用

1~4:STZ+anti-miR-NC组、STZ+anti-miR-24-3p组、STZ+anti-miR-24-3p+si-NC组、STZ+anti-miR-24-3p+si-HAP1组图6 HAP1和凋亡相关蛋白表达
3 讨 论
胰岛素抵抗与胰岛β细胞功能紊乱均为2型糖尿病发病机制,而胰岛β细胞凋亡可促使其功能紊乱,同时还可促使胰岛素细胞数量减少〔8,9〕。因而保护胰岛β细胞及避免其细胞凋亡是治疗2型糖尿病的关键环节。miR具有调节细胞增殖、分化及凋亡的作用,研究表明miR表达异常与胰岛β细胞凋亡有关〔10〕。miR-24可通过抑制Neurodl蛋白表达进而抑制小鼠胰岛β细胞系MIN6细胞数量及胰岛素分泌〔11〕。研究表明,miR-24可通过抑制细胞周期依赖蛋白激酶(Cdk)4、细胞周期蛋白(Cyclin)D3 蛋白表达进而抑制胰岛β细胞增殖,Cdk4、CyclinD3 过表达后可逆转这一效应,但关于其具体作用机制仍需探究〔12,13〕。1型与2型糖尿病患者血清中miR-24-3p表达上调并可参与疾病进展过程〔14,15〕。胰岛β细胞凋亡的主要途径为线粒体凋亡途径,Bax与Bcl-2异常表达可增加线粒体外膜通透性进而促使细胞内细胞色素C释放至细胞外,细胞色素C又可激活caspase-3等进而促使细胞凋亡〔16,17〕。提示抑制miR-24-3p表达可通过降低Bax、cleaved-caspase-3蛋白表达而上调Bcl-2蛋白表达进而抑制线粒体凋亡途径最终抑制胰岛β细胞凋亡。
HAP1可广泛分布于机体甲状腺、胰岛等组织器官,研究显示,HAP1可在胰岛β细胞及大鼠β细胞瘤细胞系中特异性表达,HAP1表达异常可影响胰岛β细胞分泌胰岛素的功能〔18,19〕。研究发现,HAP1可通过抑制神经元细胞凋亡进而保护神经元〔20〕。但HAP1是否也可通过抑制胰岛β细胞凋亡进而发挥保护作用仍未可知。本研究说明HAP1表达降低可能促使胰岛β细胞凋亡,HAP1过表达可能通过上调Bcl-2蛋白表达并促使Bcl-2/Bax比例失衡导致线粒体凋亡途径失活进而对胰岛β细胞发挥抗凋亡作用。抑制HAP1表达可逆转抑制miR-24-3p表达对STZ诱导的胰岛β细胞凋亡的作用。提示miR-24-3p可直接靶向调控HAP1表达进而促进胰岛β细胞凋亡。

