38株西藏牦牛源肠产毒性大肠杆菌ESBLs基因型检测及耐药性分析
王刚 赵燕娟 索朗斯珠 翟新验

摘要:为了解38株西藏牦牛源肠产毒性大肠杆菌携带超广谱β-内酰胺酶(ESBLs)基因亚型流行及耐药性情况。利用药敏试验、PCR检测技术对实验室保存的38株肠产毒性大肠杆菌携带超广谱β-内酰胺酶基因菌株进行耐药性分析及耐药基因研究。ESBLs检测结果显示,在初筛以及确认试验中,有21株牦牛源肠产毒性大肠杆菌检测为产ESBLs菌株,检出率为55.3%。基因型检测结果表明,38株肠产毒性大肠杆菌中有34株产毒性大肠杆菌携带CTX-M-U,检出率为89.5%;13株产毒性大肠杆菌携带CTX-M-1,检出率为34.2%;4株产毒性大肠杆菌携带CTX-M-9,检出率为10.5%;30株产毒性大肠杆菌携带TEM,检出率为78.9%;所有菌株均未检出OXA及SHV基因型。药敏检测结果显示,38株牦牛源肠产毒素大肠杆菌对万古霉素、四环素、复方新诺明、红霉素、氟苯尼考、头孢噻肟等均表现为高度耐药,对头孢噻肟的耐药率高达100%;对氯霉素、诺氟沙星、青霉素、阿奇霉素的耐药率分别为63.2%、50.0%、86.8%、73.7%;仅对链霉素、丁胺卡那、庆大霉素、头孢唑林、头孢西丁等表现为敏感。说明目前西藏地区产ESBLs菌株的确存在,且产ESBLs菌株的基因型以CTX型为主,TEM型次之。ESBLs的产生能明显增加菌株的耐药性,提示我们在临床用药中,不仅要合理使用抗生素,而且还要注意结合酶抑制剂的联合应用。
关键词:牦牛;大肠杆菌;超广谱β-内酰胺酶;耐药性;药敏试验
中图分类号: S855.1+2 文献标志码: A
文章编号:1002-1302(2020)14-0211-04
大肠杆菌病是由致病性大肠杆菌引起的以下痢、全身性败血症为主要临床症状的多种病的总称,此病一年四季均可发生,以新生犊牛为主[1]。近年来,产超广谱β-内酰胺酶(ESBLs)的大肠杆菌菌株呈逐年上升的趋势,严重制约着临床用药治疗大肠杆菌病的效果,使治疗陷入极大困境[2]。ESBLs是β-内酰胺酶的最主要酶型,它的产生可水解包括头孢等三代β-内酰胺类药物,是菌株对该类药物产生耐药的最主要原因[3]。目前,已发现的ESBLs基因型主要有TEM型、SHV型、CTX-M型、OXA型等[4]。本试验对临床分离得到的38株肠产毒性大肠杆菌(ETEC)进行ESBLs基因型检测,并对其耐药性进行分析,旨在为西藏地区临床用药提供科学依据及理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株来源
本试验38株牦牛源肠产毒性大肠杆菌菌株,均为西藏高原动物疫病研究自治区高校重点实验室保存菌株,编号为1~38;质控菌为大肠埃希菌ATCC25922,购自中国兽医药品监察所。
1.1.2 主要试剂
PCR试剂、核酸染料4S Red plus等,均购自生工生物工程(上海)股份有限公司;营养肉汤培养基、普通琼脂培养基、麦康凯培养基及链霉素、头孢唑林、青霉素、红霉素等14种常用抗菌药物,均购自杭州微生物试剂有限公司。
1.1.3 主要仪器
隔水式电热恒温培养箱、DZF-6021型真空干燥箱,均购自北京市六一仪器厂;AB204-N型电子分析天平,购自上海医用核子仪器厂;SW-CJ-JC超净工作台,购自蘇州净化设备公司;CHA-S型往复空气恒温摇床,购自常州金坛良友仪器有限公司。
1.2 试验方法
1.2.1 试验菌株的复壮
将实验室-80 ℃保存的38株牦牛源肠产毒性大肠杆菌菌株分别接种于装有营养肉汤培养基的三角瓶中,置于37 ℃,120 r/min 摇速的摇床中,过夜培养。
1.2.2 药敏试验
药敏试验采用美国临床实验室标准化协会(CLSI)推荐的K-B法,其详细操作步骤可见参照文献[5]。抑菌结果的判定参照美国临床实验室标准化委员会(NCCLS)2013等公布的标准以敏感、中介、耐药等3种形式对抑菌圈大小作出判定[6]。
1.2.3 ESBLs的检测
根据CLSI推荐的表型筛选和确证试验进行操作和判读[7]。
1.2.4 ESBLs基因型检测
从GenBank中检索已登录的TEM、SHV、CTX-M(CTX-M-U、CTX-M-1、CTX-M-9)、OXA(OXA-1、OXA-2、OXA-10)的基因序列,分别设计TEM、SHV、CTX-M、OXA的通用引物,然后采用Primer 5设计引物[8-9](表1),由生工生物工程(上海)股份有限公司合成。反应体系为94 ℃预变性5 min;94 ℃ 变性1 min,54 ℃退火30 s,72 ℃延伸 1 min,循环30 次;72 ℃延伸10 min。反应结束后,取5 μL PCR产物进行1.5%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 纸片扩散法药敏试验结果
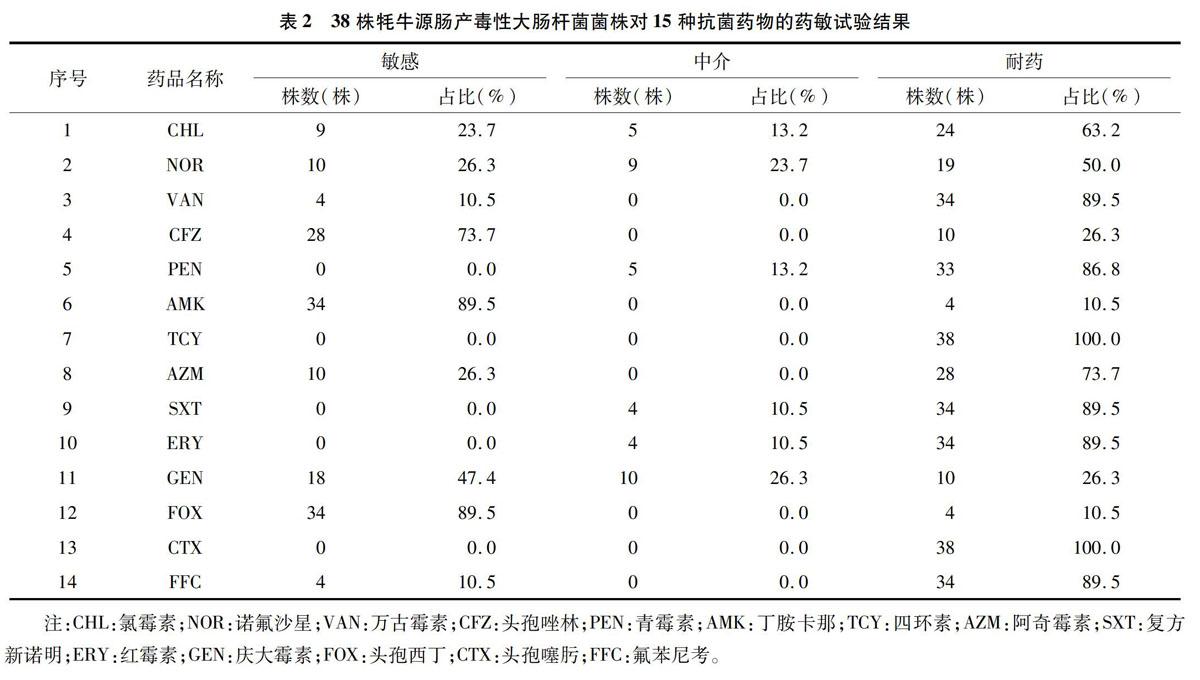
38株牦牛源肠产毒性大肠杆菌对14种常用抗生素的药敏检测结果,由表2可知,38株牦牛源肠产毒性大肠杆菌对万古霉素、四环素、复方新诺明、红霉素、氟苯尼考、头孢噻肟、氯霉素、诺氟沙星、青霉素和阿奇霉素等均表现为耐药,其中对四环素、头孢噻肟耐药率高达100.0%;所有菌株仅对丁胺卡那、庆大霉素、头孢唑林、头孢西丁等表现为敏感。
2.2 ESBLs检测结果
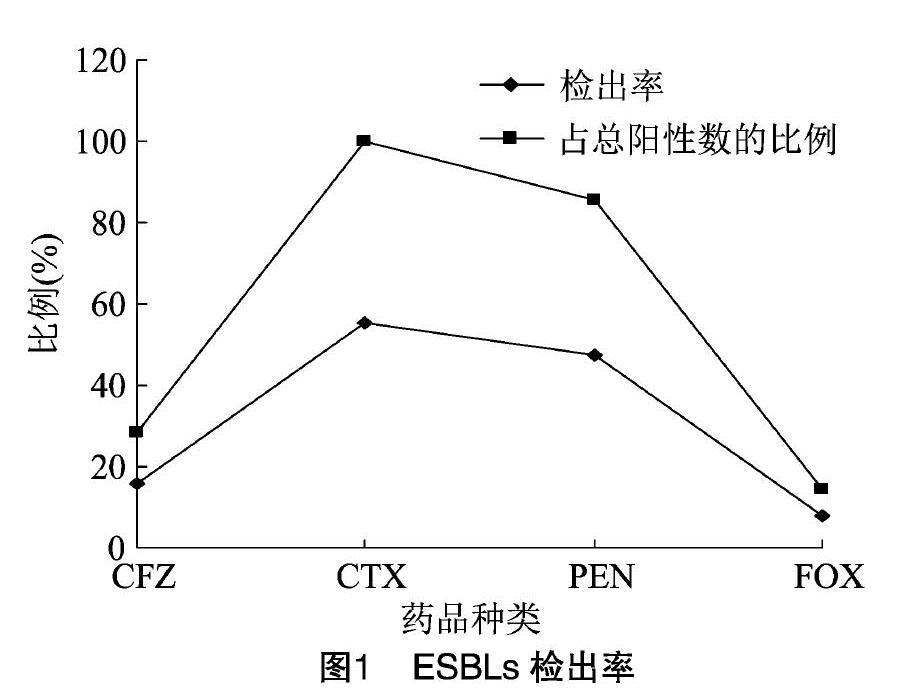
由图1可知,38株牦牛源肠产毒性大肠杆菌ESBLs检测结果表明,在初筛及确认试验中,有21株大肠杆菌检测为产ESBLs菌株,检出率为55.3%。其中,CFZ检出6株,检出率为15.8%,占总阳性株数的28.6%,CTX检出21株,检出率为55.3%,占总阳性株数的100%,PEN检出18株,检出率为47.4%,占总阳性株数的85.7%,FOX检出3株,检出率为7.9%,占总阳性株数的14.3%。
2.3 ESBLs基因型检测结果
由表3可知,38株肠产毒素性大肠杆菌中有34株肠产毒性大肠杆菌携带 CTX-M-U,检出率为89.5%;有13株肠产毒性大肠杆菌携带CTX-M-1, 检出率为34.2%;有4株肠产毒性大肠杆菌携带CTX-M-9,检出率为10.5%;有30株肠产毒性大肠杆菌携带TEM,检出率为78.9%;所有菌株均未检出OXA及SHV基因型。
3 讨论与结论
本试验对38株牦牛源肠产毒性大肠杆菌进行ESBLs检测,共检出21株为产ESBLs菌株,阳性率为55.3%,本结果要高于Yum等报道的28.4%[10],比苑丽等报道的76.7%低[2]。据有关报道,发现产ESBLs菌株可通过接合、转化和转导等方式在细菌间快速传播耐药基因,这给临床治疗带来困难,更加说明了加强β-内酰胺酶监测的迫切性和必要性[11]。
ESBLs基因型检测结果表明,目前西藏地区产ESBLs牦牛源大肠杆菌流行的基因型主要以TEM型和CTX-M型为主,尚未检测出SHV型。ESBLs基因型与菌株的耐药表型相关,TEM的产生可使菌株对PEN耐药,而CTX-M的产生对CTX水解效率更高,耐药率也随之增高[2,12],本次药敏试验结果显示所有菌株对青霉素、头孢噻肟的耐药率分别为868%、100.0%,产ESBLs菌株中TEM及CTX-M-U的檢出率分别为78.9%、89.5%,这一检出率高于谢苗苗报道的检出率[13],同时可以看到本试验中药敏试验结果与耐药基因检出率基本一致,这与TEM主要介导PEN耐药、CTX-M介导CTX耐药观点相一致。本次ESBLs基因型检测结果同时也显示,产CTX-M型ESBLs菌株耐药率高于产TEM型ESBLs菌株,并且对其他种类药物的耐药率也高于TEM型ESBLs菌株,这提示临床中对CTX-M型耐药菌株的治疗将更加艰难,须引起我们高度警惕。
通过本药敏试验结果可知,21株产酶菌对三代头孢类抗生素的耐药率为10.5%~100.0%,并非都是100.0%,即仍存在着部分菌株对此类药物表现出体外敏感,但产ESBLs菌株通常表现为体外敏感而体内耐药的特点[14],因此只用体外药敏试验结果的方法来指导临床用药是不全面的。鉴于牦牛源大肠杆菌产酶检出率较高,因此建议在临床中应用药敏试验检测的同时,也要进行ESBLs的检测,一旦检测到阳性菌株,则不管药敏试验结果如何都应视为分离株对第三代头孢药物耐药[15]。本研究中药敏试验结果还显示,产ESBLs菌株对除β-内酰胺类药物以外的其他抗菌药物也同时存在较高的耐药率,即在交叉耐药和多重耐药现象上表现的要比非产酶菌株严重的多,至于什么原因导致该现象的产生尚须通过后续研究其耐药机制来进行阐述。
参考文献:
[1]庞书琴. 犊牛大肠杆菌病的防治[J]. 中国畜牧兽医文摘,2018,34(1):190-191.
[2]苑 丽,刘建华,胡功政,等. 30株鸡大肠杆菌ESBLs基因型检测及耐药性分析[J]. 中国预防兽医学报,2009,31(6):438-443.
[3]王 鹏. 肠杆菌科细菌中超广谱β-内酰胺酶和外膜蛋白的研究[D]. 上海:复旦大学,2012.
[4]沈莉萍,徐 锋,张维谊,等. 1997—2010年上海市猪源大肠杆菌耐药性和产ESBLs菌的基因型检测[J]. 中国动物检疫,2017,34(9):26-30,45.
[5]索朗斯珠,王 刚,罗润波,等. 西藏牦牛源大肠杆菌主要耐药表型及耐药基因检测[J]. 中国兽医学报,2017,37(8):1501-1506.
[6]贡 嘎,王 刚,拉 珍,等. 西藏牦牛大肠杆菌对常用抗菌药物的耐药性分析[J]. 中国兽医杂志,2014,50(8):80-82.
[7]付秀玲,吴 华,陈红英,等. 禽致病菌ESBLs和AmpC酶的检测及药敏分析[J]. 华中农业大学学报,2007,26(2):217-222.
[8]张青娴,徐引弟,王治方,等. 河南省猪源大肠杆菌ESBLs基因型检测及耐药性分析[J]. 山西农业科学,2018,46(12):2087-2093.
[9]魏 丹. 肺炎克雷伯菌临床分离株的耐药性及产ESBLs的基因型分析[D]. 郑州:郑州大学,2015.
[10]Yum J H,Kim S,Lee H,et al. Emergence and wide dissemination of CTX-M-type ESBLs,and CMY-2- and DHA-1-type AmpC β-lactamases in Korean respiratory isolates of Klebsiella pneumoniae[J]. Journal of Korean Medical Science,2005,20(6):961-965.
[11]孙 红. 肺炎克雷伯菌ESBLs检测和KPC酶分析[D]. 合肥:安徽医科大学,2011.
[12]Palzkill T.Structural and mechanistic basis for extended-spectrum drug-resistance mutations in altering the specificity of TEM,CTX-M,and KPC β-lactamases[J]. Frontiers in Molecular Biosciences,2018,5:16.
[13]谢苗苗. 畜禽肉源大肠杆菌CTX-M型ESBLs的流行状况及传播机制研究[D]. 南京:南京农业大学,2016.
[14]高莉莉,刘章平. 产ESBLs大肠埃希菌和克雷伯菌的耐药性分析[J]. 延安大学学报(医学科学版),2008,6(4):9,11.
[15]陈天宝,陈建魁,于 农,等. 同时产ESBLs和AmpC酶菌株的表型检测及其意义[J]. 中国误诊学杂志,2008,8(24):5802-5803.
收稿日期:2019-08-31
基金项目:国家肉牛牦牛产业体系项目(编号:CARS-37);元亨基金项目(编号:603318017)。
作者简介:王 刚(1988—),男,河南信阳人,硕士,助教,主要从事高原动物传染病研究。E-mail:1039376778@qq.com。
通信作者:索朗斯珠,博士,教授,主要从事高原动物疫病防控研究。E-mail:xzslsz@163.com。

