遗传性易栓症致静脉血栓栓塞症的口服抗凝药物治疗现状
胡子旋?曾勉
【摘要】遗传性易栓症是指由于患者机体内存在某种基因缺陷而导致抗凝蛋白、凝血因子、纤溶蛋白等相应的蛋白含量减少或者异常,从而具有高血栓栓塞倾向,这些患者常合并静脉血栓栓塞症,而口服抗凝治疗是该类患者管理的重要一环。相比于传统的维生素K拮抗剂(如华法林)作用于多种凝血因子,非维生素K拮抗剂(如新型口服抗凝剂)则仅抑制某一个凝血因子,由于其具有无需常规监测凝血指标、与食物和药物之间相互作用更少、发生出血等不良事件更少等优点,近年来已被越来越广泛地应用于临床抗凝治疗上。该文对口服抗凝药用于遗传性易栓症致静脉血栓栓塞症患者的抗凝治疗进行综述。
【关键词】遗传性易栓症;静脉血栓栓塞症;非维生素K拮抗剂;抗凝治疗
Research progress on oral anticoagulants in patients with venous thromboembolism induced by inherited thrombophilia Hu Zixuan, Zeng Mian. Medical Intensive Care Unit, the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080,China
Corresponding author, Zeng Mian, E-mail: zengmian2004@ 163. com
【Abstract】Inherited thrombophilias are hereditary conditions caused by certain genetic defects that predispose patients to thrombosis. By affecting the quantity and/or function of anticoagulant protein, coagulation factor, or fibrinolytic protein, inherited thrombophilias can disturb the coagulation system. Patients with inherited thrombophilia are constantly complicated with venous thromboembolism. Oral intake of anticoagulants plays an important role in the management of these patients. Compared with traditional vitamin K antagonists (such as warfarin), which inhibit a series of coagulation factors, non-vitamin K antagonists (new oral anticoagulants) only inhibit a certain coagulation factor. Non-vitamin K antagonists offer advantages over vitamin K antagonists,such as less food-drug interaction, no need for laboratory monitoring of coagulation parameters, lower risk of major bleeding. In recent years, non-vitamin K antagonists have been more and more widely applied in clinical anticoagulation therapy. In this article, research progresses on the usage of oral anticoagulants in patients with venous thromboembolism induced by inherited thrombophilia were reviewed.
【Key words】Inherited thrombophilia; Venous thromboembolism; Non-vitamin K antagonist;
Anticoagulation therapy
急性肺栓塞(PE)是指來自身体其他部位的物质(包括血栓、肿瘤、空气、脂肪等)阻塞肺动脉或其分支所导致的疾病,以肺血栓栓塞症(PTE)最为常见,后者的病因主要是来源于下肢的深静脉血栓形成(DVT)的栓子引起的栓塞,属于静脉血栓栓塞症(VTE)。其中易栓症为VTE的危险因素之一,患有易栓症的患者发生首次VTE事件的概率显著高于无易栓症人群[1]。
易栓症是指由于遗传性或获得性危险因素而具有高血栓栓塞倾向[2]。临床上通常将其分为遗传性易栓症和获得性易栓症。遗传性易栓症则指的是由于患者机体内存在某种基因缺陷导致与其相应的蛋白含量减少或者异常所致。常见遗传性易栓症包括凝血因子Ⅴ(FⅤ)Leiden突变、抗凝血酶(AT)缺乏症、蛋白C缺乏症、蛋白S缺乏症、凝血酶原G20210A突变等。亚洲人群最常见的是AT缺乏症、蛋白C缺陷症、蛋白S缺陷症,而FⅤ Leiden突变和凝血酶原基因G20210A突变主要见于西方人群[3]。国内一项纳入了138例VTE患者的临床研究显示,抗凝蛋白缺陷总发生率为44.9%,其中单纯抗凝蛋白缺陷中蛋白C、蛋白S和AT缺陷比例分别为18.1%、4.3%、5.1%[4]。
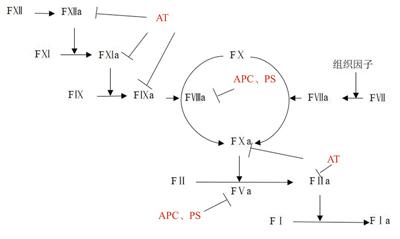
对于PE的抗凝治疗,目前临床上常用的抗凝治疗包括使用胃肠道外抗凝(如皮下注射普通肝素、低分子肝素)、维生素K拮抗剂(如华法林)、非维生素K拮抗剂。其中维生素K拮抗剂如华法林可以抑制维生素K依赖型FⅡ、FⅦ、FⅨ、FⅩ,而非维生素K拮抗剂(NOAC)则仅抑制某一个凝血因子,包括直接FⅩa抑制剂如阿哌沙班、利伐沙班、依度沙班,直接FⅡa抑制劑如达比加群。NOAC由于其具有无需依赖AT而发挥抗凝作用、无需常规监测凝血指标、与食物和药物之间相互作用更少、相对安全性更高等优点,目前临床上已被越来越广泛地用于遗传性易栓症致VTE患者的抗凝治疗。
一、常见遗传性易栓症致VTE及口服抗凝治疗
1. AT缺乏症
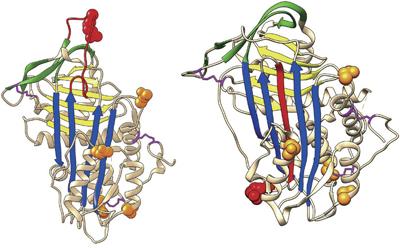
AT是肝细胞和血管内皮细胞合成的单链糖蛋白,属于丝氨酸蛋白酶抑制剂,其构象见图1。反应中心环的蛋白裂解导致了AT靶蛋白酶的抑制,Arg425-Ser426裂解后,插入裂解的反应中心环成为新的β-折叠,将丝氨酸蛋白酶抑制剂转变为高稳定构象,见图2。在血栓形成过程中,AT在肝素的催化下可以通过与凝血酶原FⅡa或FⅩa、FⅨa、FⅪa、FⅫa等结合而导致酶的灭活,其中以灭活FⅡa、FⅩa为主。AT基因(SERPINCI)位于1q23 ~ 25,全长约13 000 bp,
包含7个外显子,约80%的AT缺陷患者存在SERPINCI基因突变,其中以外显子和侧翼区的点突变、缺失或插入突变为主[5]。
理论上,肝素的抗凝效果依赖于AT的活性和抗原水平,无论使用普通肝素还是低分子肝素,均有可能发生肝素抵抗。但在临床实践中,可以通过提高普通肝素的用量使活化部分凝血活酶时间(APTT)达标,而由于低分子肝素和磺达肝癸钠需通过检测抗FⅩa进行抗凝监测,可能会出现用药剂量达不到治疗量的情况。
对于广泛VTE或者有症状的VTE患者,可考虑使用AT浓缩剂。AT浓缩剂可分为人血浆来源AT(pdAT)和重组人AT(rhAT),其中pdAT可用于预防妊娠期及术后血栓并发症、AT缺乏患者血栓栓塞的治疗和预防,治疗目标为提高AT活性至80% ~ 120%。而rhAT仅用于预防而非治疗。AT浓缩剂适用于对低分子肝素反应欠佳的妊娠期患者和急救[6]。
对于有AT缺陷患者,长期抗凝可以降低VTE的复发率,因此遗传性AT缺乏症患者或应考虑长期抗凝,但在长期抗凝治疗的同时,也需考虑患者的家族史、AT缺乏的类型、突变类型以及出血事件的发生,以进行个体化的治疗。目前,尚无有关应用NOAC进行AT缺乏症患者的抗凝治疗的有效性和安全性的大型研究。动物实验证实了直接FⅩa抑制剂依度沙班比低分子肝素在低AT抗原水平及活性的小鼠中有更显著的抗凝效果[7]。临床上也有病例报道证实了应用利伐沙班、依度沙班进行VTE合并AT缺乏患者的抗凝治疗的有效性。病例报道中的患者在1年随访过程中均未出现VTE复发或出血事件[8-9]。直接FⅡa抑制剂用于VTE合并AT缺乏症患者抗凝治疗的有效性和安全性尚未见病例报道,仍需进一步探索达比加群等对于VTE合并AT缺乏症患者的治疗效果。
2. FⅤ Leiden突变
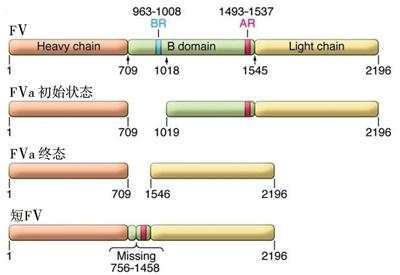
FⅤ是大小为330 kDa的单链蛋白,在FⅩa和凝血酶的激活下,在钙离子共同参与下,其B结构域被裂解,终产物105 kDa的重链和74 kDa的轻链,加速FⅩa对凝血酶原的激活,其中B结构域碱性氨基酸区和酸性氨基酸区的相互作用可以保持FⅤ的非活化状态,见图3[10]。灭活FⅤa的主要机制为APC裂解306、506、679位点精氨酸致失活,其中506位点的裂解是控制灭活速度的关键步骤。除此以外,APC还可以在506位点断裂FⅤ产生抗凝因子FⅤac,而FⅤac可以作为APC的协同因子发挥灭活FⅧa的作用。FⅤ Leiden突变FⅤ基因的1691位G→A的点突变,造成506位点氨基酸的精氨酸→谷氨酰胺改变,这种突变不仅使FⅤa灭活速度减慢,同时通过影响FⅤ转变为APC的协同抗凝因子影响FⅧa的灭活,进而导致高凝状态的产生[11]。
FⅤ Leiden突变的初始抗凝治疗可选用普通肝素或低分子肝素,后改为维生素K拮抗剂。研究显示,长期口服华法林的FⅤ Leiden突变患者的随访(中位时间2.3年)中,VTE的年复发率约为0.8% (95%CI 0.2 ~ 2.2),风险比(HR)为0.7 (95%CI 0.2 ~ 2.6) [12]。 FⅡa抑制剂如达比加群、FⅩa抑制剂如利伐沙班也均可用于FⅤ Leiden突变患者的抗凝治疗[13]。但是由于FⅤ Leiden突变的检测手段常为检测APC抵抗(Leiden突变患者APC抵抗率通常小于2.0)或者基因测序[12]。口服抗凝药如达比加群、比伐卢定、利伐沙班等可影响APC抵抗检查结果,导致误诊(研究显示,服用达比加群的患者APC抵抗率较基线升高,而服用利伐沙班的患者APC抵抗率较基线降低)[14]。因此对于使用口服抗凝药的患者推荐进行基因检测以得到更准确的结果。
3. 蛋白C缺乏、蛋白S缺乏
蛋白C是由肝脏细胞合成的维生素K依赖、大小为62 kDa丝氨酸蛋白酶原,包括二硫键连接的41 kDa的重链和21 kDa的轻链。在凝血过程中,蛋白C激活形成APC(图4),使FⅧa和FⅤa灭活[15]。而FⅧa可提高FⅨa对FX的激活速度,FⅤa可提高FⅩa激活凝血酶原的速度,以此抑制FⅩ和凝血酶原的激活[16]。蛋白C缺乏可分为2型,其中Ⅰ型为蛋白C抗原和活性同步下降,约占75%,Ⅱ型为蛋白C活性下降,但抗原水平正常[16]。
蛋白S是肝脏细胞合成的维生素K依赖的单链糖蛋白,其基因包括具有转录活性的蛋白S基因(PROS1)和无转录活性的假基因两部分,其中PROS1基因位于染色体3p11.1-q11.2上,长度大约80 kb,包含15个外显子和14个内显子(如图5)[17]。蛋白S作为APC的辅助因子,可使APC对FⅧa和FⅤa的灭活作用增强,起到间接抗凝作用;同时蛋白S也可以直接与FⅤa和FⅩa结合,抑制凝血酶原酶复合物的形成,从而抑制凝血酶原的激活;蛋白S还可以与FⅧa结合,抑制FⅩa的活性。蛋白S缺乏分为3型,其中Ⅰ型为血浆总蛋白S及游离蛋白S抗原含量的减少,Ⅱ型为血浆总蛋白S抗原含量水平正常,但蛋白S活性下降,该型最为常见,发生率可达55%,Ⅲ型为血浆总蛋白S抗原含量水平正常,但游离蛋白S抗原含量减少[18]。
由于蛋白C、蛋白S的合成需要维生素K参与,而华法林为维生素K拮抗剂,口服华法林可使血浆蛋白C、蛋白S抗原含量和(或)活性下降,即华法林在抑制依赖维生素K合成的凝血因子的同时,也抑制了机体蛋白C、蛋白S的合成。口服华法林可引起上皮组织坏死,原因在于华法林与蛋白C、蛋白S缺乏引起体内高凝状态形成微血栓相关,即蛋白C、蛋白S缺乏的患者单独口服华法林,在治疗初期可导致血栓栓塞加重甚至皮肤坏死。NOAC不会抑制依赖维生素K的蛋白,可以作为蛋白C缺乏、蛋白S缺乏患者长期抗凝治疗方式之一。有病例报道显示,达比加群、利伐沙班均可用于蛋白C缺乏、蛋白S缺乏患者的抗凝,并且可用于患者因华法林而产生皮肤坏死的治疗,但是在应用利伐沙班时,需要增加利伐沙班的用量以达到治疗效果[19]。
4. 凝血酶原基因G20210A突变
凝血酶原是由肝脏细胞合成维生素K依赖的单链糖蛋白,包括Gla结构域(残基1 ~ 46)、序列-1(残基65 ~ 143)、序列-2(残基170 ~ 248)、蛋白酶结构域(残基285 ~ 579),其中蛋白酶结构域在R320位点可被剪切为A链(残基285 ~ 320)和B链(残基321 ~ 579),见图6[20]。在凝血酶原激活物的作用下,凝血酶原被激活成为凝血酶,在凝血酶的作用下,溶于血浆中的纤维蛋白原转变为纤维蛋白单体,同时凝血酶激活FⅩⅢ使之活化为FⅩⅢa,使纤维蛋白单体相互连接形成纤维蛋白多聚体,参与血液凝固。凝血酶原G20210A的突变为FⅡ基因3端非翻译区20210位碱基G→A,突变后凝血酶原基因合成增加,从而使凝血酶原水平升高,导致血液高
凝[21]。相比于非携带者,凝血酶原G20210A突变纯合子患者发生VTE的相对危险度为5.00(95%CI,2.10 ~ 11.92),凝血酶原G20210A突变杂合子患者发生VTE的相对危险度为1.88 (95%CI,0.90 ~ 3.67)[22]。
在凝血酶原基因G20210A突变患者的抗凝治疗方面,除应用华法林抗凝外,新型口服抗凝药如阿哌沙班、利伐沙班、达比加群等均有报道可用于凝血酶原基因G20210A突变患者的抗凝治
疗[13, 23]。其中也有报道在应用利伐沙班于凝血酶原基因G20210A突变合并DVT及PE的抗凝治疗过程中,12个月后患者再发DVT,但是在将利伐沙班改为达比加群后的17个月随访中,未观察到VTE事件的复发[13]。
二、维生素K拮抗剂与NOAC比较
1. 对易栓症检测的影响
由于使用维生素K拮抗剂如华法林会导致蛋白C和蛋白S的活性降低,直接FⅩa抑制剂则可使凝固法检测的蛋白C、蛋白S活性升高,FⅩ法检测的AT活性升高,直接FⅡa抑制剂则可使凝固法检测的蛋白C、蛋白S活性升高,FⅡ法检测的AT活性升高,因此在血栓急性期进行抗凝蛋白活性检测可能会无法得知是否真实存在相关缺陷[24]。Connors[25]建议检测时机为:若应用维生素K拮抗剂则停药至少2周后进行检测,若应用NOAC则需停用至少5个半衰期后进行检测,一般约2 ~ 3 d。若患者停药后有较高VTE复发风险,由于检测结果一般不影响患者的治疗方案,应考虑继续抗凝治疗。
2. 有效性及安全性
目前尚无大型研究直接对比不同种类NOAC用于抗凝治疗的有效性及安全性,一项荟萃分析纳入了多个使用维生素K拮抗剂及不同NOAC进行VTE抗凝治疗的RCT试验,比较使用阿哌沙班、利伐沙班、达比加群、依度沙班及维生素K拮抗剂进行抗凝治疗的病死率及发生出血时间概率,结果显示使用阿哌沙班、利伐沙班、达比加群、依度沙班及维生素K拮抗剂的患者在病死率方面无显著差异,使用阿哌沙班的患者在发生出血事件的概率上要低于使用利伐沙班、达比加群、依度沙班及维生素K拮抗剂的患者,而使用达比加群的患者在发生出血事件的概率上要低于使用利伐沙班、依度沙班及维生素K拮抗剂的患者[26]。
3. 药物间相互作用
在抗凝药物的选择上,由于无需检测国际标准化比值(INR)和無饮食限制,患者会更倾向于选择服用新型口服抗凝药,较好的依从性可以有效改善VTE患者的预后。由于新型口服抗凝药较华法林的半衰期更短(华法林38 ~ 42 h,达比加群12 ~ 17 h,利伐沙班7 ~ 11 h,阿哌沙班9 ~ 14 h),如果发生漏服,会导致抗凝效果不佳且短期内VTE复发的概率会升高。同时相比较华法林,新型口服抗凝药与其他药物间相互作用更少[27]。这使得新型口服抗凝药更适用于需长期服用其他药物的患者,可以减少或者尽量避免因用药不当造成的药物疗效下降或者出血等不良事件。
4. 逆转抗凝作用
应用口服抗凝药进行抗凝治疗时,较为严重的并发症为发生出血事件尤其是危及生命的出血事件,此时如何逆转抗凝作用是临床上关注的重点。目前已上市的NOAC包括达比加群的拮抗剂依达赛珠单抗、利伐沙班和阿哌沙班的拮抗剂Andexxa。其中Andexxa可降低利伐沙班89%(95%CI 58% ~ 94%)的抗FⅩa活性、阿哌沙班93%(95%CI,87% ~ 94%)的抗FⅩa活性[28]。其他新型口服抗凝药均无有效拮抗剂上市。如果使用血液透析,直接FⅩa抑制剂由于其蛋白结合率较高,较难通过血液透析的方式清除,难以达到逆转抗凝作用。
5. 肾功能不全患者的用药调整
口服抗凝药的排泄都在一定程度上依赖于肾脏,肾功能受损会影响患者对于华法林的反应,但是可以通过INR进行剂量调整以达到抗凝目的,而NOAC如达比加群的肾脏清除率达80%,依度沙班的肾脏清除率为50%,利伐沙班的肾脏清除率为35%,阿哌沙班的肾脏清除率为27%,临床上肾功能不全是减少NOAC用量的指征之一,对于使用达比加群的患者,当Ccr < 30
ml/min時应减少用量,而对于使用利伐沙班的患者,Ccr < 50 ml/min时也应减少用量。如果在严重肾功能不全患者中没有减少NOAC的用量,则患者发生出血事件的概率可增长为2倍[29]。因此,在将NOAC用于患者的抗凝治疗时,也应考虑患者肾功能的情况,并根据Ccr适当调整用药剂量以提高用药的安全性。
6. 有消化道病变患者的用药选择
消化道出血也是抗凝治疗的主要并发症之一。研究发现,与使用华法林的患者相比,使用NOAC的患者更常因息肉和(或)瘤形成而发生下消化道出血事件(18.6% vs. 8.8%),原因可能在于NOAC不能在胃肠道中被完全吸收而产生一定的腔内抗凝活性,易因息肉等病变引起腔内出血,而华法林则因可以被完全吸收而无腔内抗凝活性[30]。因此,对于有消化道病变如息肉等, NOAC可能不是最优的抗凝药物。
三、NOAC用于治疗遗传性易栓症的前景与挑战
如上所述,相比于传统的抗凝药物维生素K拮抗剂,NOAC由于具有无需依赖AT而发挥抗凝作用、无需常规监测凝血指标、与食物和药物之间相互作用更少、发生出血等不良事件更少且用药剂量相对固定等优点,已被越来越广泛地应用于临床抗凝治疗。对于遗传性易栓症患者来说,抗凝治疗是治疗方案中的关键环节。除使用传统的肝素或低分子肝素、维生素K拮抗剂如华法林外,目前已有越来越多的病例报道NOAC可应用于遗传性易栓症患者的抗凝治疗,且均取得了一定的疗效。然而NOAC应用于临床抗凝治疗仍有许多问题需要解决,如寻找更合适的检测方式消除其对抗凝蛋白活性的影响、寻找可以快速且有效的治疗手段逆转其抗凝作用以用于发生致命出血事件或紧急情况的抢救等。同时,未来还需大样本的研究以评估NOAC对于不同类型遗传性易栓症合并VTE患者的长期抗凝治疗有效性和安全性的评估,为临床医师进行抗凝药物选择提供更好的依据。除此之外,目前对于遗传性易栓症患者的抗凝治疗时长尚无确切推荐,仍需临床研究以明确不同抗凝治疗时长的收益与风险,以期对临床工作做出更明确的指导。
综上所述,NOAC应用于遗传性易栓症患者的抗凝治疗拥有着巨大前景,有望成为优于维生素K拮抗剂的更好选择,但仍需更多研究探索其长期使用的有效性和安全性。
参 考 文 献
[1] Campello E, Spiezia L, Adamo A, Simioni P. Thrombophilia, risk factors and prevention. Expert Rev Hematol, 2019, 12(3):147-158.
[2] Colucci G, Tsakiris DA. Thrombophilia screening revisited: an issue of personalized medicine. J Thromb Thrombolysis, 2020, 49(4):618-629.
[3] Tang L, Hu Y. Ethnic diversity in the genetics of venous thromboembolism. Thromb Haemost, 2015, 114(5):901-909.
[4] 刘蕾,马壮,张云,高莹.静脉血栓栓塞症患者易栓症的临床研究.临床肺科杂志,2018, 23(3):456-458.
[5] Corral J, de la Morena-Barrio ME, Vicente V. The genetics of antithrombin. Thromb Res, 2018, 169:23-29.
[6] Bauer KA, Nguyen-Cao TM, Spears JB. Issues in the diagnosis and management of hereditary antithrombin deficiency. Ann Pharmacother. 2016, 50(9):758-767.
[7] Fukuda T, Kamisato C, Honda Y, Matsushita T, Kojima T, Furugohri T, Morishima Y, Shibano T. Impact of antithrombin deficiency on efficacy of edoxaban and antithrombin-dependent anticoagulants, fondaparinux, enoxaparin, and heparin. Thromb Res, 2013, 131(6):540-546.
[8] Appignani M, Sciartilli A, Caputo M, Di Girolamo E. Successful treatment with rivaroxaban of an extended deep vein thrombosis complicated by pulmonary embolism in a patient with familial antithrombin III deficiency: a case report. Eur Heart J Case Rep, 2019, 4(1):1-5.
[9] Kawano H, Maemura K. Edoxaban was effective for the treatment of deep vein thrombosis and pulmonary thromboembolism in a cancer patient with antithrombinⅢ deficiency. Intern Med, 2016, 55(22):3285-3289.
[10] Broze GJ Jr, Girard TJ. Factor V, tissue factor pathway inhibitor, and east Texas bleeding disorder. J Clin Invest, 2013, 123(9):3710-3712.
[11] Van Cott EM, Khor B, Zehnder JL. Factor V Leiden. Am J Hematol, 2016, 91(1):46-49.
[12] Campello E, Spiezia L, Simioni P. Diagnosis and management of factor V Leiden. Expert Rev Hematol. 2016, 9(12):1139-1149.
[13] Undas A, Goralczyk T. Non-vitamin K antagonist oral anticoa-gulants in patients with severe inherited thrombophilia: a series of 33 patients. Blood Coagul Fibrinolysis, 2017, 28(6):438-442.
[14] Gessoni G, Valverde S, Gessoni F, Valle R. The effect of dabigatran and rivarovaban on a prothrombinase-based assay for activated protein C resistance: a preliminary study in subjects heterozygous for factor V Leiden. Blood Transfus, 2015, 13(4):666-668.
[15] Togashi T, Meguro-Horike M, Nagaya S, Sugihara S, Ichinohe T, Araiso Y, Yamaguchi K, Mori K, Imai Y, Kuzasa K, Horike SI, Asakura H, Watanabe A, Morishita E. Molecular genetic analysis of inherited protein C deficiency caused by the novel large deletion across two exons of PROC. Thromb Res, 2020, 188:115-118.
[16] Dinarvand P, Moser KA. Protein C deficiency. Arch Pathol Lab Med, 2019, 143(10):1281-1285.
[17] ten Kate MK, van der Meer J. Protein S deficiency: a clinical perspective. Haemophilia, 2008, 14(6):1222-1228.
[18] Gupta A, Tun AM, Gupta K, Tuma F. Protein S deficiency. Treasure Island (FL): StatPearls Publishing, 2020.
[19] Menon N, Sarode R, Zia A. Rivaroxaban dose adjustment using thrombin generation in severe congenital protein C deficiency and warfarin-induced skin necrosis. Blood Adv, 2018, 2(2):142-145.
[20] Acquasaliente L, Pelc LA, Di Cera E. Probing prothrombin structure by limited proteolysis. Sci Rep, 2019, 9(1):6125.
[21] Favaloro EJ. Genetic testing for thrombophilia-related genes: observations of testing patterns for factor v leiden (G1691A) and prothrombin gene "Mutation" (G20210A). Semin Thromb Hemost, 2019, 45(7):730-742.
[22] Shemesh A, Hoffman R, Nadir Y, Keren-Politansky A, Monreal M, Brenner B, Tzoran I. Clinical significance of prothrombin G20210A mutation in homozygous patients. Am J Hematol, 2017, 92(10): E618-E620.
[23] Janion-Sadowska A, Natorska J, Siudut J, Z?bczyk M, Stanisz A, Undas A. Plasma fibrin clot properties in the G20210A prothrombin mutation carriers following venous thromboembolism: the effect of rivaroxaban. Thromb Haemost, 2017, 117(9):1739-1749.
[24] 张宇, 张竹, 舒适, 翟振国.易栓症检测在静脉血栓栓塞症中的应用进展. 中国实用内科杂志,2019,39(12):1088-1091.
[25] Connors JM. Thrombophilia testing and venous thrombosis. N Engl J Med, 2017, 377(12):1177-1187.
[26] Cohen AT, Hamilton M, Mitchell SA, Phatak H, Liu X, Bird A, Tushabe D, Batson S. Comparison of the novel oral anticoagulants apixaban, dabigatran, edoxaban, and rivaroxaban in the initial and long-term treatment and prevention of venous thromboembolism: systematic review and network meta-analysis. PLoS One, 2015, 30, 10(12): e0144856.
[27] Jobski K, Hoffmann F, Herget-Rosenthal S, D?rks M. Drug interactions with oral anticoagulants in German nursing home residents: comparison between vitamin K antagonists and non-vitamin K antagonist oral anticoagulants based on two nested case-control studies. Clin Res Cardiol, 2020, 109(4):465-475.
[28] Connolly SJ, Milling TJ Jr, Eikelboom JW, Gibson CM, Curnutte JT, Gold A, Bronson MD, Lu G, Conley PB, Verhamme P, Schmidt J, Middeldorp S, Cohen AT, Beyer-Westendorf J, Albaladejo P, Lopez-Sendon J, Goodman S, Leeds J, Wiens BL, Siegal DM, Zotova E, Meeks B, Nakamya J, Lim WT, Crowther M; ANNEXA-4 Investigators. Andexanet alfa for acute major bleeding associated with factorⅩa inhibitors. N Engl J Med, 2016, 375(12):1131-1141.
[29] Yao X, Shah ND, Sangaralingham LR, Gersh BJ, Noseworthy PA. Non-vitamin K antagonist oral anticoagulant dosing in patients with atrial fibrillation and renal dysfunction. J Am Coll Cardiol, 2017, 69(23):2779-2790.
[30] Diamantopoulou G, Konstantakis C, Skroubis G, Theocharis G, Theopistos V, Triantos C, Thomopoulos K. Acute Lower gastrointestinal bleeding in patients treated with non-vitamin k antagonist oral anticoagulants compared with warfarin in clinical practice: characteristics and clinical outcome. Gastroenterology Res, 2019, 12(1):21-26.
(收稿日期:2020-04-30)
(本文編辑:林燕薇)

