阿尔茨海默病外周血内皮祖细胞数量及功能的研究
李海员?徐雪?刘敏?韦伶郁?古钎林?宋汉聪?陈秋蕾?徐嘉
【摘要】目的 观察内皮祖细胞(EPC)在阿尔茨海默病(AD)外周血中的数量及功能,探讨AD潜在的血管机制。方法 选择58例AD患者分为轻度痴呆组19例、中度痴呆组21例和重度痴呆组18例,并以18名无痴呆者作为对照组,采集外周血,分离及培养EPC,采用荧光标记方法评估体外培养EPC数量,同时检测EPC的迁移和黏附功能,分别进行组间EPC数量、迁移和黏附功能的对比。结果 4组外周血EPC数量比较差异无统计学意义(P > 0.05)。中度痴呆组和重度痴呆组的外周血 EPC的迁移和黏附功能均低于轻度癡呆组和无痴呆组(P均< 0.05)。结论 AD患者的EPC功能下降,导致内皮细胞修复功能降低,这可能与AD的发生发展有关。
【关键词】阿尔茨海默病;内皮祖细胞;血管机制
Study of quantity and function of endothelial progenitor cells in peripheral blood of patients with Alzheimers disease Li Haiyuan, Xu Xue, Liu Min, Wei Lingyu, Gu Xianlin, Song Hancong, Chen Qiulei, Xu Jia. Care Center for the Elderly with Dementia, Home for the Aged Guangzhou, Guangzhou 510550, China
Corresponding author, Xu Jia, E-mail: 2828stone@ sina. com
【Abstract】Objective To observe the quantity and function of endothelial progenitor cells (EPCs) in the peripheral blood of patients with Alzheimers disease, and to explore the potential vascular mechanism of Alzheimers disease. Methods Fifty-eight patients with Alzheimers disease were divided into the mild (n = 19), moderate (n = 21) and severe groups (n = 18), and 18 normal control were assigned into the control group. The EPCs were isolated from the peripheral blood and cultured in vitro. The quantity of EPCs was evaluated by AC-LDL/lectin fluorescent labeling method, and the migration and adhesion ability of EPCs were detected. The number, migration and adhesion function of EPCs among four groups were statistically compared. Results The number of circulating EPCs did not significantly differ among four groups (all P > 0.05). The migration and adhesion function of circulating EPCs in the moderate and severe groups were significantly lower than those in the mild and control groups (all P < 0.05). Conclusions Patients with Alzheimers disease present with decreased EPCs function. The decline in repair function of endothelial cells caused by the vascular mechanism is probably involved in the incidence and development of Alzheimers disease.
【Key words】Alzheimers disease;Endothelial progenitor cell;Vascular mechanism
阿尔茨海默病(AD)是最常见的老年期痴呆类型,其所致的渐进性记忆障碍、日常生活能力下降及精神行为异常给社会及家庭带来了沉重的负担,是人类所面临的最大的全球公共卫生事件[1]。目前AD的病因仍不明确,尽管神经变性机制是最被公认的机制之一,但仍存在不能通过变性机制可以解释的地方,例如AD患者合并血管相关基础疾病的比例更高,而发生过血管病变患者的AD进展会更快[2-3]。血管学说在AD的致病机制中的作用越来越受到重视,对AD机制的研究可为AD的预防和治疗提供更多的线索依据。内皮祖细胞(EPC)能直接反映血管内皮功能的指标,其数量和功能的减低提示血管内皮功能失调及血管修复能力下降[4]。本研究旨在分析EPC在不同严重程度AD患者外周血中的表达,以探讨AD潜在的发病机制。
对象与方法
一、研究对象
选择2018年10月至2019年12月广州市老人院失智老人照顾中心及中山大学附属第一医院东院神经内科收治的58例AD患者(研究组),均符合2011年美国国立老化研究所和AD协会(NIA-AA)提出的很可能AD诊断标准[5]。另选择同期在中山大学附属第一医院东院因其他原因住院、经痴呆分级评定量表(CDR)判定为无痴呆的18名志愿者为正常对照组。排除标准:①近3个月内有新发心肌梗死、外周血管栓塞、外伤、手术事件者;②未获控制的内科疾病如中枢或外周感染、严重高血压病、全身代谢紊乱等;③脑梗死、抑郁症、药物滥用所致的认知功能下降。本研究已经征得入组者及其家属或代理者的知情同意。
二、研究方法
1. 临床资料的收集
收集所有受试者的病历资料,记录性别、年龄,是否合并高血压病、糖尿病、冠状动脉粥样硬化性心脏病(冠心病)、高脂血症,以及头颅影像学等资料,并采集受试者空腹血糖、总胆固醇、LDL-C等血液学检查资料。符合入组标准的受试者以肝素抗凝管于清晨空腹采集外周静脉血15 ml用于EPC的相关实验室检测。
2. 量表评价
采用CDR对受试者本人及其照料知情者进行访谈[6-7]。采集其关于记忆、定向、判断解决问题能力、社会事务、家务及业余爱好、个人自理6个方面的资料,将受试者分为无痴呆、轻度痴呆、中度痴呆、重度痴呆共4组。量表评估均由经过痴呆相关量表培训且有多年痴呆诊治经验的神经内科医师完成。
3. 人外周血 EPC 的分离和培养
Ficoll密度梯度离心法提取外周血单个核细胞:取外周静脉血,用等体积磷酸盐缓冲液(PBS)稀释后,小心加入至含人淋巴细胞分离液的离心管上层,2000转/分离心15 min,用玻璃吸管小心吸取中层白色雾状的单个核细胞层,PBS 洗涤2次后,离心10 min 获取单核细胞,将单核细胞重悬于含10%胎牛血清的 EPC 全培养基,置37℃,每 4 d换液1次,培养1周。
4. 流式细胞仪测定外周血 EPC 数量
取200 ?l外周血,依次加入胎肝激酶-1(FLK-1)流式细胞荧光抗体一抗、FLK-1二抗、CD34流式细胞荧光抗体分别进行孵育各20 min。加入2 ml红细胞裂解液,梯度离心5 min,弃上清后再次离
心4 min,剩余細胞以2%多聚甲醛固定,以流式细胞仪检测CD34/KDR双阳性细胞即EPC的数量。
5. EPC迁移功能检测
在避光培养的EPC板中加入10 μl活细胞染色剂 CM-Dil及2.5 ml EBM-2内皮细胞培养基,于培养箱中放置5 min后,弃EBM-2,加入 0.25%胰蛋白酶消化6 min,弃上清,PBS清洗2次;加入EBM-2 400 μl重悬已染CM-Dil的EPC,进行细胞计数,统一数量为1×104/ml;将其加入Transwell 上室,悬浮在500 μl DMEM培养液的下室之上,培养24 h后,轻擦掉上室膜上未迁移的细胞,随机选取5个显微镜200倍视野,计数迁移的细胞并取平均值。
6. EPC黏附功能检测
将EPC传代于6孔板48 h后,弃培养基,以PBS洗2次,加入500 μl DAPI荧光染料孵育5 min,弃DAPI,PBS清洗2次后,将CM-Dil标记的同等数目 2 ml EPC悬液加入其中,37℃孵育3 h,然后吸去培养液,以2 ml 4% PFA固定液处理10 min,采集5个显微镜200倍视野,计数贴壁细胞并取平均值。
三、统计学处理
所有数据统计均使用SPSS 19.0处理。对计量资料先行正态性(K-S)检验,正态分布计量资料用描述,多组比较用单因素方差分析,组间两两比较采用SNK-q检验。计数资料以例(%)表示,组间比较采用χ2检验。α= 0.05。
结果
一、无痴呆组、轻度痴呆组、中度痴呆组和重度痴呆组的一般资料比较
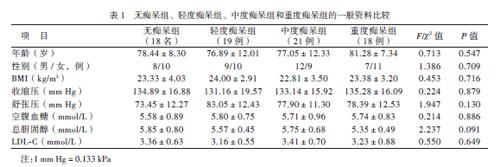
4组的年龄、性别构成、BMI、血压、血糖 、血脂等比较差异均无统计学意义(P均> 0.05),见表1。
二、无痴呆组、轻度痴呆组、中度痴呆组和重度痴呆组的外周血EPC数量比较
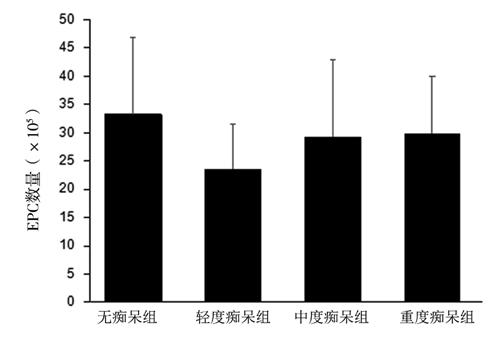
4组外周血EPC数量比较差异无统计学意义(F = 2.163,P > 0.05),见图1。
三、无痴呆组、轻度痴呆组、中度痴呆组和重度痴呆组的外周血EPC迁移功能比较
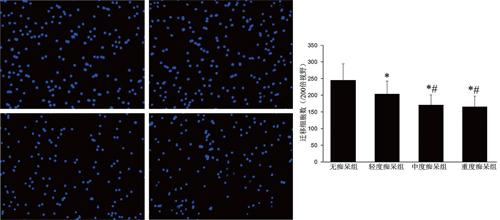
4组外周血EPC迁移功能比较差异有统计学意义(F = 17.220,P < 0.001)。其中,轻度痴呆组EPC迁移功能低于无痴呆组,中度痴呆组外周血EPC迁移功能低于无痴呆组及轻度痴呆组,重度痴呆组外周血EPC迁移功能低于无痴呆组及轻度痴呆组(P均< 0.05),中度痴呆组与重度痴呆组外周血EPC迁移功能比较差异无统计学意义(P > 0.05),见图2。
四、无痴呆组、轻度痴呆组、中度痴呆组和重度痴呆组的外周血EPC黏附功能比较
4组间外周血EPC黏附功能比较差异有统计学意义(F = 11.869,P < 0.001)。重度痴呆组EPC黏附功能低于其他3组,中度痴呆组高于重度痴呆组但低于无痴呆组和轻度痴呆组(P均< 0.05);无痴呆组与轻度痴呆组间外周血EPC黏附功能比较差异无统计学意义(P > 0.05),见图3。
讨论
AD是一种以老年斑形成、神经纤维缠结为主要病理表现的神经变性疾病。近年越来越多的研究支持血管机制在AD发生发展中的重要作用,且血管机制与变性机制、遗传背景等交错可能促进了AD的发生发展。流行病学和病理学研究表明,脑血管病变如动脉粥样硬化和AD之间存在着一定的联系和重叠,例如严重动脉粥样硬化患者发生AD或血管性痴呆的风险明显增加[9]。神经病理学研究表明,高达80%的AD患者有血管病变,如脑动脉的微梗死和动脉粥样硬化,AD患者存在脑血流量和脑血管反应性的降低[10]。有学者在AD患者的组织切片中观察到ApoE-C1q复合物,并指出动脉粥样硬化可能损害脑血流和神经-血管偶合导致脑血管功能障碍,从而导致认知功能下降[11]。探讨AD的血管机制以及其可能存在的保护因素有助于寻找新的预防及治疗策略,延缓AD的进展。
骨髓来源的EPC在病理状态下,参与内皮细胞的修复,在组织修复和血管新生中发挥着重要的作用[12]。本研究显示,无痴呆组、轻度痴呆组、中度痴呆组和重度痴呆组的EPC数量相近。Breining等[13]对痴呆患者内皮细胞功能障碍相关指标进行研究,同样也没有发现EPC数量上的差异,与本研究类似。但也有研究曾发现AD患者EPC数量的下降,其研究结果不一致,一方面可能是源于受试者年龄的差异(本研究平均年龄较大),另一方面单纯EPC的数量可能的确并不能作为预测痴呆发生或其严重程度的指标,因EPC由骨髓细胞分泌至外周血后需要归巢至受损内皮细胞或血管外组织进一步分化为血管内皮细胞等才可发挥作用[14-15]。因此EPC功能学上的研究可能比单纯数量上的研究更有意义,因此本研究进一步在EPC的功能学差异上进行了探讨。
进一步研究显示,中度痴呆组和重度痴呆组外周血EPC迁移和黏附功能均较无痴呆组及轻度痴呆组下降,提示中重度痴呆患者血管内皮细胞功能受损,且血管内皮细胞功能的下降可能参与了痴呆的发生发展。EPC功能下降导致脑血管内皮细胞的修复能力下降,脑血管内皮细胞可调节神经元微环境中淀粉样蛋白的水平,内皮细胞功能障碍可影响血脑屏障的通透性,导致淀粉样蛋白等物质向脑的渗透性增加,造成神经元毒性损伤,从而加重了AD的发生、发展。EPC可抑制海馬淀粉样β蛋白(Aβ)、淀粉样前体蛋白的升高,减轻淀粉样斑块的沉积和相关的组织病理学改变,有助改善记忆缺陷和AD样病理功能障碍[16]。Zhang等[17]研究显示,上调EPC功能可改善小鼠的空间学习记忆功能,EPC可以升高紧密连接蛋白的表达,修复血脑紧密连接功能,刺激血管生成,促进Aβ清除,减少神经元丢失,最终改善认知功能。
本研究尚存在需进一步探讨之处,譬如是何原因导致不同程度痴呆患者EPC功能的不一致性,其潜在的诱导或趋化因子的差异在何处。对于AD治疗领域,单纯提高EPC水平可能无法带来下游的获益,如何改善EPC的功能才是关键所在,这对于目前AD血管机制研究以及干预策略制定带来了新的启发。
参 考 文 献
[1] 阿尔茨海默病创新药物临床试验中国专家小组. 阿尔茨海默病创新药物临床试验中国专家共识. 中华老年病研究电子杂志, 2016, 2(3): 1-11
[2] Iturria-Medina Y, Hachinski V, Evans AC. The vascular facet of late-onset Alzheimers disease: an essential factor in a complex multifactorial disorder. Curr Opin Neurol, 2017, 30(6): 623-629.
[3] Iadecola C. Vascular and metabolic factors in Alzheimers disease and related dementias: introduction. Cell Mol Neurobiol, 2016, 36(2):151-154.
[4] Aragona CO, Imbalzano E, Mamone F, Cairo V, Lo Gullo A, DAscola A, Sardo MA, Scuruchi M, Basile G, Saitta A, Mandraffino G. Endothelial progenitor cells for diagnosis and prognosis in cardiovascular disease. Stem Cells Int, 2016, 2016:8043792.
[5] 中国痴呆与认知障碍写作组,中国医师协会神经内科医师分会认知障碍疾病专业委员会. 2018中国痴呆与认知障碍诊治指南(二):阿尔茨海默病诊治指南.中华医学杂志, 2018,98(13): 971-977.
[6] 中国老年医学学会认知障碍分会.临床痴呆评定量表简体中文版. 中华老年医学杂志, 2018, 37(4): 367-371.
[7] 杨渊韩, 贾建军, John Morris.临床痴呆评估量表的应用. 中华老年医学杂志,2018, 37(4): 365-366.
[8] Bai YP, Xiao S, Tang YB, Tan Z, Tang H, Ren Z, Zeng H, Yang Z. Shear stress-mediated upregulation of GTP cycloh-ydrolase/tetrahydrobiopterin pathway ameliorates hypertension-related decline in reendothelialization capacity of endothelial progenitor cells. J Hypertens, 2017, 35(4):784-797.
[9] Cortes-Canteli M, Iadecola C. Alzheimers disease and vascular aging: JACC focus seminar. J Am Coll Cardiol, 2020, 75(8):942-951.
[10] Liesz A. The vascular side of Alzheimers disease. Science, 2019, 365(6450):223-224.
[11] Fredman G. Resolving atherosclerosis and Alzheimer disease. Nat Rev Cardiol, 2019, 16(5):259-260.
[12] 陈伟栋, 徐嘉, 黄振华, 古钎林, 廖瑾莉, 韦秋霞, 詹红. EPC、FMD与脓毒症患者病情严重程度的相关性研究. 新医学, 2019, 50(5):361-365.
[13] Breining A, Silvestre JS, Dieudonné B, Vilar J, Faucounau V, Verny M, Néri C, Boulanger CM, Boddaert J. Biomarkers of vascular dysfunction and cognitive decline in patients with Alzheimers disease: no evidence for association in elderly subjects. Aging Clin Exp Res, 2016, 28(6):1133-1141.
[14] Lee ST, Chu K, Jung KH, Park HK, Kim DH, Bahn JJ, Kim JH, Oh MJ, Lee SK, Kim M, Roh JK. Reduced circulating angiogenic cells in Alzheimer disease. Neurology, 2009, 72(21): 1858-1863.
[15] 孔晓冬, 张蕴, 张建宁, 卫重娟, 孙宁, 刘丽, 张明义. 外周血内皮祖细胞数目和阿尔茨海默病关系研究. 中华神经医学杂志,2011, 10(3):303-307.
[16] Safar MM, Arab HH, Rizk SM, El-Maraghy SA. Bone marrow-derived endothelial progenitor cells protect against scopolamine-induced Alzheimer-like pathological aberrations. Mol Neurobiol, 2016, 53(3):1403-1418.
[17] Zhang S, Zhi Y, Li F, Huang S, Gao H, Han Z, Ge X, Li D, Chen F, Kong X, Lei P. Transplantation of in vitro cultured endothelial progenitor cells repairs the blood-brain barrier and improves cognitive function of APP/PS1 transgenic AD mice. J Neurol Sci, 2018, 387:6-15.
(收稿日期:2020-03-03)
(本文编辑:林燕薇)

