醋酸钴合成过程中漫料事故分析与预防措施
倪玉峰,熊厚文,杨金华,余立明
(金浦新材料股份有限公司,江苏南京 210047)
醋酸钴是一种重要的化工产品,是对二甲苯、均三甲苯液相空气氧化的催化剂[1-2]。过氧化氢法生产醋酸钴,是采用金属钴(Co)与醋酸(CH3COOH)及过氧化氢(双氧水,H2O2)直接反应制备[3]1-3[4-6],反应器的设计和H2O2的利用是该生产方法的关键[7]。H2O2由于其结构的特殊性而具有较大的不稳定性,在金属表面、温度上升、pH增加、金属离子及其他杂质的影响下,极易分解放热并产生氧气[8-9]。
金浦新材料股份有限公司自2016年对醋酸钴合成反应釜进行内部结构优化改造,生产过程具有流程短和反应条件温和等特点,生产负荷和醋酸钴的产品质量均有明显的改观,但作为原料之一的H2O2,其消耗量一直不稳定,使用消泡剂消除釜内液相表面气泡的情况时有发生。本文结合近年来发生的醋酸钴合成过程漫料事故,研究了关键工艺参数对合成反应的影响,分析了漫料事故原因并提出预防措施,为醋酸钴合成单元的生产优化提供了理论借鉴。
1 工艺简介
醋酸钴合成单元简易流程如图1所示,为常压间歇操作。
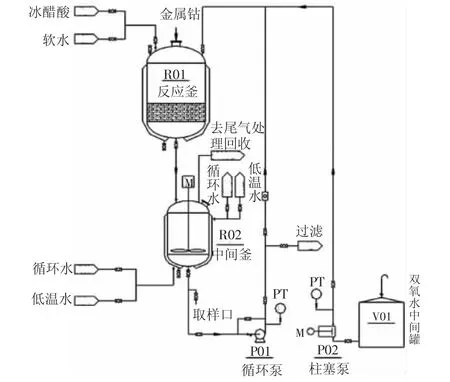
图1 醋酸钴合成单元简易流程图
首先,向反应釜R01内投入金属钴原料,床层厚度约400 mm,注入1.5 t质量分数为15%~20%的醋酸水溶液。启动循环泵P01后,开启H2O2泵P02开始添加H2O2(质量分数30%),混合液体流经金属钴床层进行醋酸钴的合成反应。待中间釜R02内的溶液酸度和醋酸钴浓度合格后,关闭H2O2泵P02,进入过滤工序。过氧化氢法生产醋酸钴反应方程式如下所示[3]10,方程式括号中s代表固相,l代表液相。
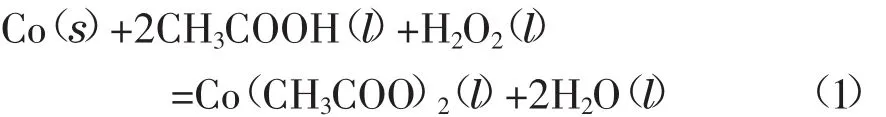
2 醋酸钴合成过程理论分析
2.1 双氧水沿床层纵向的浓度分布
在反应釜中任意截取一段高度为dZ的微元钴层,如图2所示。图中L为混合液体流量,L/s;Z为钴床层高度,m;dZ为微元钴层高度,m;CH2O2为混合液体中双氧水量浓度,mol/L;dCH2O2为双氧水量浓度变化,mol/L;C1为钴床层顶部混合液体中双氧水量浓度,mol/L;C2为钴床层底部混合液体中双氧水量浓度,mol/L。
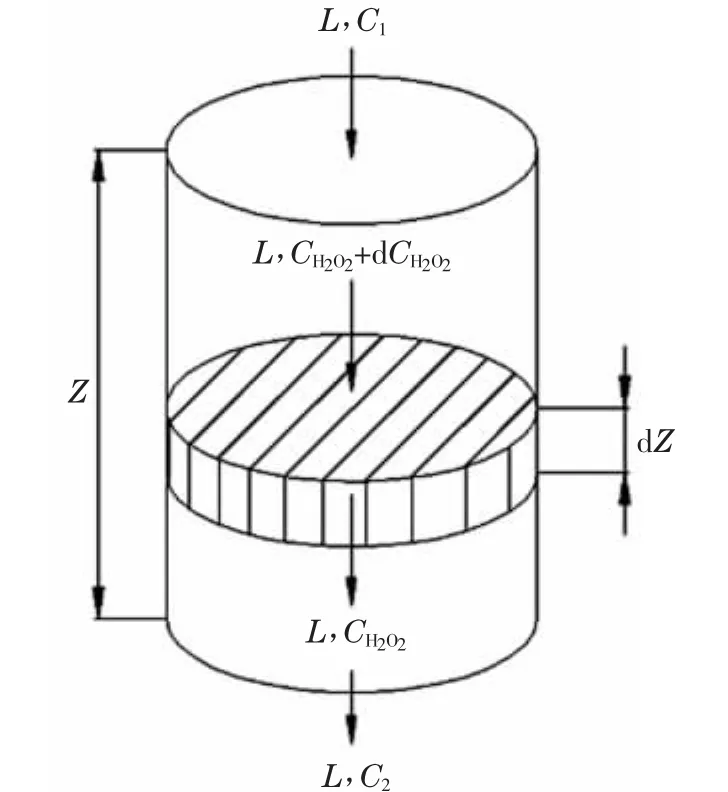
图2 高度为dZ的微元钴层
若不考虑双氧水在床层内的分解,对此微元钴层内的H2O2做物料衡算可知,单位时间内参与合成醋酸钴的双氧水的物质量为:

式中,dFH2O2为单位时间内参与合成醋酸钴的双氧水的物质量,mol/s;r为反应速率,mol/(m2·s);L为混合液体流量,L/s;dCH2O2为双氧水浓度变化,mol/L;dA为微元钴层内的液、固相界面积,m2;a为单位体积钴床层所具有的反应表面积,m2/m3;Ω为反应釜截面积,m2;dZ为微元钴层高度,m。
假设总反应由表面反应控制,则微元钴层中的反应速率方程式为:
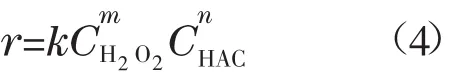
式中,CHAC、CH2O2表示混合溶液中醋酸和H2O2的量浓度,mol/L;m、n为反应级数,无量纲;k为反应速率常数,单位为[mol/(m2·s)]/(mol/L)m+n。
k一般符合阿伦尼乌斯方程:

式中,A称为指数前因子或指前因子,又称为表观频率因子,其单位与k相同;Ea为阿伦尼乌斯活化能,J/mol;R为摩尔气体常数,8.314 J/(mol·K);T为温度,单位为K;e为自然常数,值约为2.718 28。
由式(2)~(4)可得:
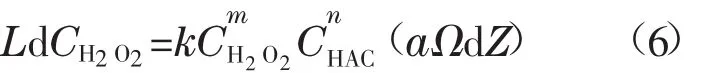
反应釜截面积Ω为常数,H2O2进料量相比循环泵流量较小,视L为常数,在反应原料钴片和醋酸过量的情况下,单股混合液体通过钴床层时a和CHAC可视为常数。不考虑床层内温度的变化,则反应速率常数k也可视为常数,于是可在全釜钴床层范围内积分如下:
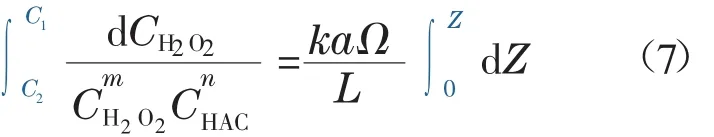
2.2 床层结构和双氧水进料速度对反应过程的影响
由公式(7)可知,若钴床层高度Z或单位体积钴床层所具有的反应表面积a较大,混合液体通过反应釜后,钴床层底部混合液体中H2O2浓度C2较低,即H2O2的转化率较高;反之,则钴床层底部混合液体中H2O2的浓度C2偏高,在反应釜内未被消耗的双氧水进入中间釜,部分随循环液体再次进入钴床层参与反应,其余部分则在温度、杂质、金属离子和pH增高等因素的影响下分解生成水和氧气,并放出热量。
若双氧水进料速度过快,即进入钴层的混合液体中H2O2的初始浓度C1较高,由公式(7)可知,在床层末端的混合液体中双氧水的浓度C2偏高,将会出现H2O2的分解现象,有大量氧气和热量产生。
假设存在某双氧水的低浓度C*,在此低浓度条件下,H2O2参与醋酸钴合成反应和自身分解的速度均可以忽略。在床层Z足够高的情况下,混合液体在反应釜内自上而下流动过程中将分别经历2段钴床层 Z1、Z2,且 Z1+Z2=Z。在床层 Z1内部,混合液体中的H2O2参与醋酸钴合成反应,浓度降至C*,流至床层Z2末端时H2O2浓度C2≈C*。提高双氧水的进料速度,即增加混合液体中H2O2的初始浓度C1后,在经过一段 Z1′(Z1′>Z1)的钴床层后,H2O2浓度降至 C*,在床层 Z2′末端 H2O2浓度 C2≈C*,Z1′+Z2′=Z,即钴床层高度足够的情况下,在一定的双氧水进料速度范围内,提高其进料速度既可避免H2O2的无效分解,又可缩短醋酸钴的合成时间。
3 漫料事故经过、原因分析及预防措施
3.1 漫料事故经过
2019年12月6日,在车间某生产批次的巡检过程中,透过中间釜R02视窗发现,液相体积膨胀使得液面逐渐上升至釜顶位置,紧急启动停车程序。从启动H2O2进料泵P02(柱塞泵,设定开度20%)至事故发生时,H2O2进料时间共约2 h,循环水调节阀在整个生产过程中始终处于全开状态。DCS(分布式控制系统)操作记录显示,当液相温度达到56℃时,联锁切断H2O2进料泵P02,待液相温度逐步降低至40℃后重新启动H2O2泵P02,以此间断方式注入H2O2进行醋酸钴的合成。打开中间釜R02入孔,发现液面上方分布一层泡沫状物质,较为稳定,不易破裂。
3.2 漫料事故原因分析
3.2.1 H2O2进料速度
生产过程中虽然采取了温度和H2O2注入泵的联锁,即在液相温度达到56℃后,联锁切断P02,使事故发生时温度不再持续上升,但泵P02出口20%开度对应的注入速度可能较快,液相温度达到56℃后,在循环水冷却的作用下,温度逐渐降低,而H2O2分解产生的氧气可使混合溶液的气含率增高,液面上升。尤其在合成反应的后期,混合溶液中醋酸浓度较低,大量的H2O2进入反应釜内,实际参与合成醋酸钴的量较少,大多数H2O2在短时间内急剧分解产生大量氧气,使混合溶液的气含率大大增高,液面快速上升。这是漫料事故发生的最直接原因。
3.2.2 反应釜钴床层高度
从床层结构对反应过程的影响可知,在漫料事故发生时,金属钴床层的高度可能偏低,反应釜R01内H2O2的转化率不高,分解严重,中间釜R02混合溶液气含率增高,液面上升,是导致此次事故发生的另一个重要因素。
3.2.3 原料钴质量
一般而言,醋酸钴制备原料会含有一定的杂质成分[10],合成反应结束后均需进行过滤操作,而且在储存和搬运过程中钴原料也存在被污染的可能。微细的疏水性颗粒粘附于气泡表面后,随气泡一起浮升到液面,形成泡沫浮渣[11-12]。同时,杂质的存在也导致双氧水分解产生的氧气气泡的上升阻力增加,从而加剧漫料事故的发生。因此,事故现场观察到的液体表面浮渣说明原料杂质是导致本次漫料的不可忽视的因素之一。
3.3 漫料事故预防措施
漫料事故的发生,可能是某单一因素导致的,也可能是以上原因综合作用的结果,可以从以下几个方面提出预防措施。
(1)从床层结构和双氧水进料速度对反应过程的影响来看,应适当减小双氧水的进料速度、增加金属钴床层高度或选用比表面积较大的钴原料。同时,应严格控制醋酸和水的配比,提高双氧水使用效率,使每批次产品的原料消耗量稳定,并及时投入原料钴,确保反应釜R01内钴床层高度相对稳定;(2)要合理安排计划,控制每批次生产负荷,防止生产过程中釜内液面过高;(3)要注重原料质量及其储存运输条件,防止带入疏水性杂质;(4)可在中间釜上设置消泡剂滴加管口进行快速消泡处理,制定落实现场巡检制度,提高生产事故的应急处置能力。
4 结束语
双氧水分解导致的溶液气含率增高,是诱发漫料事故的一个重要因素。通过物料衡算,建立混合溶液通过金属钴床层时H2O2的浓度分布方程式,直观反映床层结构、双氧水进料速度对反应过程的影响,可为分析漫料事故原因、制定防范措施提供依据。原料杂质的存在不仅会形成稳定的泡沫浮渣,而且会增加双氧水分解产生的气泡的上升阻力,从而加剧漫料事故的发生,故而控制原料质量也是预防漫料事故的有效方式,同时应注重生产安排、加强现场巡检和提高生产事故应急处置能力。

