鱼类肠道中抑制哈维氏弧菌群体感应及生物膜形成的乳酸菌的筛选和鉴定
孙梦桐 吕欣然 崔天琦 林 洋 白凤翎 励建荣
(渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013)
哈维氏弧菌(Vibrio harveyi)是一种栖息在海洋生态环境中的革兰氏阴性菌, 是海产养殖业主要致病菌之一,引起鱼类、贝类及甲壳类等海洋动物疾病[1]。 目前,预防和控制哈维氏弧菌疾病一般采用抗菌类药物, 而长期反复使用抗菌药物可导致哈维氏弧菌产生耐药性, 形成药物浓度与细菌抗性的恶性循环,加剧水体环境污染,并带来巨大的食品安全隐患[2-3]。
哈维氏弧菌的致病作用与群体感应(Quorum sensing,QS)密切相关,它能够产生酰基高丝氨酸内酯 (Acyl-homoserine lactones,AHLs)、呋 喃糖基硼酸二酯 (Furanosyl borate diester)AI-2 和(S)-3-羟基十三烷-4-酮【(S)-3-hydroxytridecan-4-one】3 类信号分子[4-5]。 其中,AHLs 类信号分子是介导群体感应的主体成分, 当AHLs 达到一定浓度时可改变基因表达来协调群体行为[6]。 AHLs类群体感应系统主要由AHLs、AHLs 合酶(LuxI蛋白)和AHLs 受体(LuxR 族蛋白)3 类成分组成。LuxR 与AHLs 结合后,激活生物膜和毒力因子等基因表达[7-9]。 Rajamanikandan 等[10]利用分子对接技术确定了AHLs 分子在LuxR 上的结合位点,明确AHLs 类信号分子是引起致病作用的主要原因。 找到相对应的群体感应抑制剂(Quorum sensing inhibitor,QSI)是控制哈维氏弧菌引起的水产动物疾病的一种安全有效的方法[11-12]。
在自然环境中寻找群体感应抑制剂是目前该领域的研究热点之一, 针对哈维氏弧菌群体感应抑制剂的研究已有文献报道[13]。 Naik 等[14]应用分子模拟技术发现新型吸附剂黏土材料加利百灵-Z(Calibrin Z)可将哈维氏弧菌AHLs 分子降解成更小的片段,使之丧失群体感应的信息传导功能,说明这类食品级黏土材料对哈维氏弧菌群体感应具有淬灭作用。 Srinivasan 等[15]研究发现象橘提取物LA-M 和LA-EA 对哈维氏弧菌KUMB-VA4 生物膜结构形成具有抑制作用, 并降低其代谢活性。Muras 等[16]发现海洋细菌粘着杆菌(Tenacibaculum sp.)20J 变形体的提取物对口腔链球菌(Streptococcus oralis)和牙链球菌 (Streptococcus dentisani)的生物膜形成具有抑制作用。目前,从自然环境中筛选对哈维氏弧菌AHLs 分子具有降解作用的乳酸菌,鲜见研究报道。Chatterjee 等[17]研究发现牧草青贮中分离的植物乳杆菌能产生抑制铜绿假单胞菌PAO1 毒力因子的QSI。经过分离提纯发现该抑制剂为3-苯基乳酸(PLA),能够抑制铜绿假单胞菌蛋白酶和鼠李糖脂及生物膜形成。 Park等[18]发现从泡菜中筛选出的清酒乳杆菌(Lactobacillus sakei)NR28对大肠埃希氏杆菌(Escherichia coli)ATCC43894 的AI-2具有淬灭作用,能达到降低致病性的目的。本文从海水鱼和淡水鱼肠道分离的乳酸菌中筛选出对哈维氏弧菌AHLs 分子具有降解作用的菌株,并对其抑制作用机制进行分析,为研发一种新型、绿色、安全的水产品养殖生物制剂奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及培养条件 乳酸菌菌株:菌株LY1-1,LY1-2,LY2-2,LY2-4,LY3-1,LY4-1 来源于鲤鱼肠道; 菌株LP1-4,LP1-5,LP2-1,LP4-4,LP4-17 来源于大菱鲆肠道;DY1-1,DY1-2,DY1-9,DY2-1,DY2-5,DY2-11,DY3-2,DY3-14,DY3-15 来源于刀鱼肠道;JK1-3,JK4-5,JK19-6 来源于镜框鱼 肠道;YP1-5,YP2-4,YP2-14,YP3-2,YP4-4,YP4-5,YP4-14 来源于牙鲆鱼肠道。
指示菌株:紫色杆菌CV026(Chromobacterium violaceum)为紫色杆菌ATCC 31532 的mini-Tn5突变体。
目标菌株:哈维氏弧菌ATCC BB-170,美国典型菌种保藏中心。
以上菌株由本实验室保藏。
1.1.2 培养基和试剂 琼脂粉、LB 琼脂、LB 肉汤、MRS 肉汤,北京奥博星生物技术有限公司;碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(200 000 U/g)、中性蛋白酶(200 000 U/g)、胰蛋白酶(250 000 U/g)、胃蛋白酶(15 000 U/g),华蓝化学有限公司;乳酸菌生化鉴定管, 杭州天和微生物试剂有限公司; 细菌基因组DNA 快速抽提试剂盒、DNA 标记-D、Taq PCR 反应混合物、卡那霉素,上海生工生物工程有限公司。
1.2 设备与仪器
DL-CJ-2N 工作台, 北京市东联哈尔仪器制造有限公司;IKA Vortex GENIUS 3 振荡器,德国IKA 公司;5804R 高速冷冻离心机, 德国Eppendorf 公司;SPX-25 生化培养箱, 宁波海曙赛福实验仪器厂; GI54DS 立式高压蒸汽灭菌锅, 致微(厦门)仪器有限公司;RE-2000A 旋转蒸发器,上海亚荣生化仪器厂;Labconco Free Zone 2.5 台式真空冷冻干燥机, 美国LABCONCO 公司;MS105UD 电子分析天平, 瑞士梅特勒-托利多有限公司;DYY-8C 电泳仪, 北京市六一仪器厂;Quantity One 凝胶成像系统、mark 酶标仪, 美国Bio-Rad 公司; ABI stepone plus PCR 仪, 德国Eppendorf 公司; S-4800 扫描电镜、E-1045 镀金仪,日本日立公司。
1.3 试验方法
1.3.1 乳酸菌无细胞上清液及哈维氏弧菌AHLs的制备 在MRS 液体培养基中接种分离自鱼肠道的乳酸菌菌株,于37 ℃培养24 h,传代2 次。 以接种量2.0%接种于MRS 液体培养基, 于37 ℃恒温条件下培养24 h 后,4 ℃、6 500 r/min 条件下离心15 min, 上清液用0.22 μm 滤膜过滤得到乳酸菌无细胞上清液(Cell free supernatants,CFS),于4 ℃条件保存。
参考Vattem 等[19]的方法,将-80 ℃保藏的哈维氏弧菌以接种量2.0%接种于LB 肉汤中,30 ℃恒温培养24 h,传代2 次后以接种量1.0%接种于LB 肉汤中,30 ℃恒温条件下培养12 h,在4 ℃、6 500 r/min 条件下离心15 min, 用0.22 μm 滤膜过滤得到哈维氏弧菌CFS。 将哈维氏弧菌CFS 与乙酸乙酯等体积混合震荡, 静置15 min 待分层,收集乳化层,重复萃取2 次。 将收集的液体于50℃、120 r/min 旋转蒸发至乙酸乙酯完全蒸干,用甲醇溶解哈维氏弧菌AHLs 粗提物,于-18 ℃保存备用。
1.3.2 哈维氏弧菌群体感应产AHLs 的检验 将紫色杆菌CV026 以接种量2.0%接种于LB 肉汤中,30 ℃恒温培养24 h,传代2 代,取200 μL 接种于10 mL LB 肉汤中,其中含10 μg/mL 卡那霉素,30℃恒温条件下培养24 h。 与含有100 μL 哈维氏弧菌CFS 的10 mL LB 琼脂混合, 以未加哈维氏弧菌CFS 作为对照,于30 ℃培养24 h 后观察,产生紫色素立即进行下一步试验。
1.3.3 抑制哈维氏弧菌群体感应乳酸菌的筛选将200 μL 活化2 代紫色杆菌CV026 接种于10 mL LB 肉汤中, 其中含10 μg/mL 卡那霉素,30 ℃条件下培养24 h。 与加入100 μL AHLs 的10 mL LB 培养基混合,倒入底层铺有10 mL 凝固的素琼脂的平板中, 用牛津杯打孔法在每孔中加入乳酸菌CFS 180 μL,对照组孔中加入MRS 肉汤,30 ℃培养24 h 后,记录每孔外围出现的白色浑浊圈直径,每个菌株设3 个平行试验。
1.3.4 乳酸菌菌株鉴定
1.3.4.1 生理生化鉴定 选择对哈维氏弧菌群体感应有抑制作用的乳酸菌菌株,按《乳酸细菌分类鉴定及实验方法》及《常见细菌系统鉴定手册》初步鉴定菌株[20-21]。
1.3.4.2 16S rRNA 鉴定 取乳酸菌菌株培养12 h 后的菌悬液1.0 mL,接入1.5 mL EP 管中,8 000 r/min 离心15 min。 按照DNA 快速抽提试剂盒的方法提取乳酸菌菌株的DNA, 使用16S rDNA 通用引物扩增。 所用正向引物是27f (5’-AGAGTTTGATCCTGGCTCAG-3’),反向引物是1492r (5’-TACGGYTACCTTTGTTACGACTT-3’)[22]。PCR 扩增的反应程序:Taq PCR Master mix 12.5 μL,DNA 模板1.0 μL,dd H2O 9.5 μL,上游引物27f 1.0 μL, 下游引物1492r 1.0 μL, 总体积25 μL。PCR 扩增反应程序:94 ℃条件下2 min 的预变性,94 ℃条件下1 min 的变性,60 ℃条件下1 min的退火,72 ℃条件下90 s 的延伸,72 ℃条件下保持10 min,30 个循环次数, 结束时保存温度4 ℃。PCR 产物使用1%琼脂糖凝胶电泳20 min,用凝胶成像系统观察扩增结果并记录、保存。将剩余扩增成功的PCR 产物送至测序公司测序。 校对测序结果, 并与NCBI 上Gene Bank 数据库中己有序列BLAST 比对,下载相似序列,使用MEGA 5.0 软件构建系统发育进化树。
1.3.5 乳酸菌粗提物的制备 250 mL 分液漏斗中加入乳酸菌CFS 100 mL,100 mL 乙酸乙酯平均分为5 次加入,震荡、静置,待分层后收集上层的乳化层。 50 ℃、120 r/min 条件下真空旋转蒸发至乙酸乙酯气味完全消失,收集残留液,经真空冷冻干燥,于-18 ℃备用。
1.3.6 乳酸菌粗提物对紫色杆菌CV026 及哈维氏弧菌生长曲线的影响 用LB 肉汤将已活化的哈维氏弧菌稀释至106CFU/mL,吸取190 μL 稀释后的菌悬液于96 孔板中,加入10 μL(质量浓度分别为2.0,4.0,8.0,16.0,20,24,32.0 mg/mL)乳酸菌粗提物,对照为不加粗提物的LB 肉汤,于30 ℃培养24 h,每2 h 测定OD595值。
1.3.7 乳酸菌粗提物对哈维氏弧菌生物膜形成的影响
1.3.7.1 96 孔板法测定哈维氏弧菌生物膜抑制率
每孔加入180 μL 106CFU/mL 哈维氏弧菌菌悬液和20 μL 粗提物, 对照组加20 μL MRS 肉汤,30 ℃条件下培养24 h。 每孔除去孔内培养液,用200 μL 无菌水清洗3~5 次,200 μL 0.4%结晶紫保持染色5 min,无菌蒸馏水洗3 次,60 ℃干燥10 min, 每孔加95%乙醇200 μL, 每孔移出150 μL到另一96 孔板中,酶标仪测定OD595值,每个样品设平行3 个。 抑制率根据式(1)计算。

式中,OD对照——对照组OD595值;ODQSI——CFS 处理组OD595值。
1.3.7.2 显微镜观察 将无菌的盖玻片 (R=1.4 cm)放入24 孔板中,孔内加入1 mL LB 肉汤和10 μL 哈维氏弧菌菌悬液及100 μL 乳酸菌粗提物,30 ℃条件下恒温培养24 h 后,超纯水润洗盖玻片3 次,0.4%结晶紫保持染色20 min,用油镜观察。
1.3.7.3 扫描电镜分析 将无菌盖玻片 (R=1.4 cm)放入24 孔板中,孔内加入1 mL LB 肉汤、哈维氏弧菌菌悬液10 μL 及QSI 粗提物100 μL,30℃恒温培养24 h 后,盖玻片用超纯水洗3 次,于4℃,2.5%戊二醛溶液中固定24 h,用超纯水清洗3次去除戊二醛。分别用40%,70%,90%,100%的乙醇梯度脱水,每次洗15 min,真空干燥盖玻片后喷金,扫描电镜观察记录。
1.3.8 乳酸菌粗提物对哈维氏弧菌AHLs 的降解作用 参照Romero 等[23]的方法并稍做修改。 取10.0 μL AHLs 粗提物加到0.0,4.0,8.0 mg/mL 的乳酸菌粗提物中,37 ℃恒温培养24 h。 取2 mL 紫色杆菌CV026 与45~50 ℃的25 mL LB 固体培养基混匀倒入底层有10 mL 素琼脂的平板中, 采用牛津杯打孔法, 孔中加入180 μL 样品,30 ℃恒温培养24 h, 以0.0 mg/mL 的乳酸菌粗提物作为对照,V3 型全自动菌落计数仪记录孔周围出现的紫色圈。
1.3.9 乳酸菌粗提物对哈维氏弧菌群体感应抑制作用的影响因素
1)酶 调节乳酸菌粗提物pH 值分别为2.0,6.0,7.0,8.0 和10.0,加入木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、胰蛋白酶和中性蛋白酶,使其终质量浓度为1.0 mg/mL,37 ℃水浴2 h,将pH 值调为初始值。 对照组为未处理的乳酸菌粗提物,按1.3.3节测定其活性。
2)温度 在40,60,80,100,121 ℃处理乳酸菌粗提物30 min, 以未处理的乳酸菌粗提物为对照,按1.3.3 节测定其活性。
3)pH 用1.0 mol/L NaOH 和1.0 mol/L HCl 将菌株上清液的pH 值分别调为3.0,3.5,4.0,4.5,5.0,5.5,6.0,按1.3.3 节测定其活性。
1.3.10 数据处理 试验数据使用SPSS 18.0 分析,数据3 次平行,用平均值±标准偏差表示结果,软件Origin 8.0 绘图。
2 结果与讨论
2.1 哈维氏弧菌产AHLs 的检验及抑制其群体感应乳酸菌的筛选
采用平板倾注法检验哈维氏弧菌AHLs 分子的产生,结果表明CFS 使紫色杆菌CV026 发生紫色色素反应, 哈维氏弧菌具有AHLs 类群体感应活性。
采用牛津杯打孔法筛选出5 株对哈维氏弧菌群体感应有抑制作用的乳酸菌菌株,结果见图1。菌株LY3-1,LP4-17,LP2-1,JK19-6,YP4-4 的抑菌圈直径分别为14.21,11.46,11.55,10.40,10.12 mm, 其中菌株LY3-1 抑制活性最强。 选择菌株LY3-1 做后续研究。
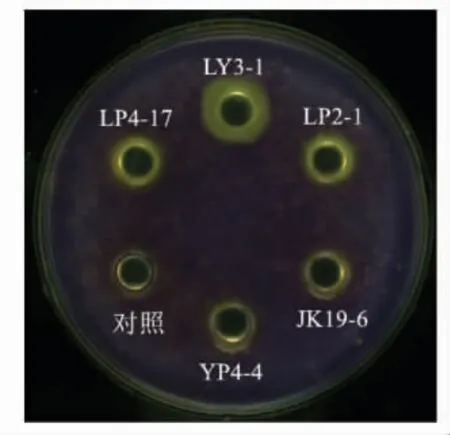
图1 对哈维氏弧菌群体感应有抑制作用的乳酸菌Fig.1 Lactic acid bacteria with inhibitory effect on quorum sensing of V. harveyi
2.2 乳酸菌菌株鉴定
菌株LY3-1 的鉴定结果见表1,对照文献[21]初步判定菌株LY3-1 为乳酸乳球菌(Lactococcus lactis)。

表1 菌株LY3-1 的生理生化鉴定结果Table 1 Physiological and biochemical test results of strain LY3-1
菌株LY3-1 的16S rRNA 基因扩增结果如图2a 所示。 菌株LY3-1 在1 500 bp 处有一特异性条带, 表明菌株LY3-1 的目标片段扩增成功。图2b 为菌株LY3-1 构建的系统发育进化树,菌株LY3-1 与KX881782.1(Lactococcus lactis)在同一分支上,置信度为98%。 鉴定菌株LY3-1 为乳酸乳球菌(Lactococcus lactis)。
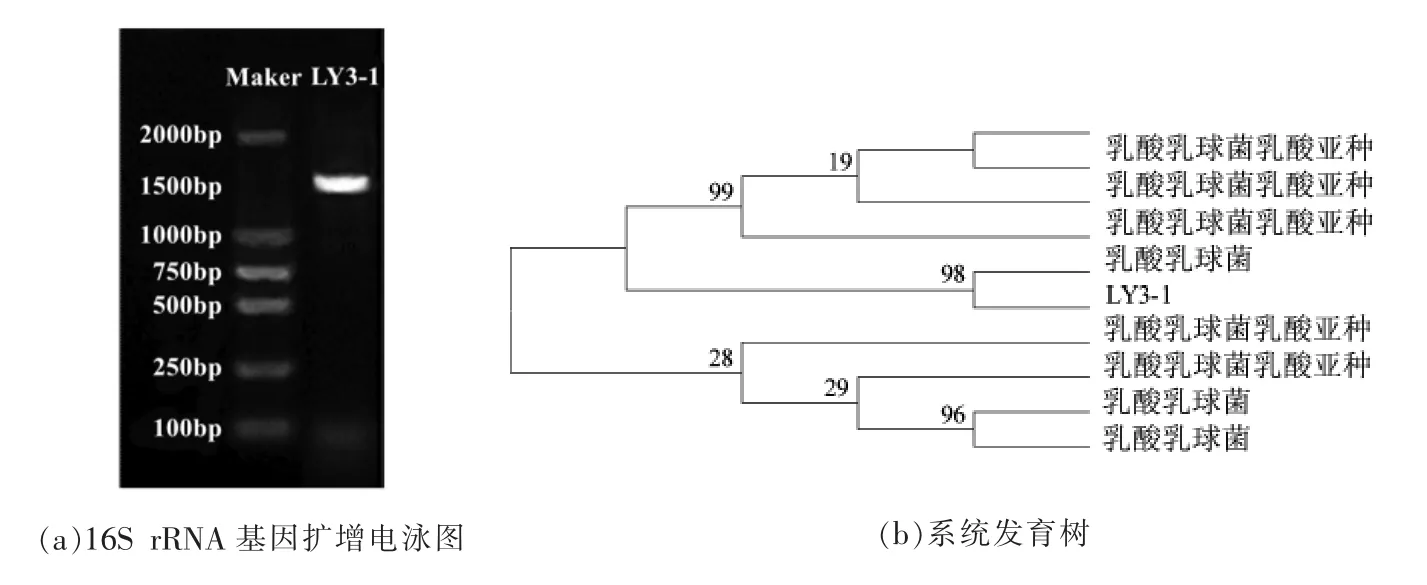
图2 菌株LY3-1 的16S rRNA 测序Fig.2 Sequencing analysis of 16S rRNA of strain LY3-1
2.3 乳酸菌粗提物对紫色杆菌及哈维氏菌生长曲线的影响
图3 为菌株LY3-1 粗提物对紫色杆菌及哈维氏弧菌生长的影响。 与对照相比,经2.0,4.0,8.0 mg/mL 的菌株LY3-1 粗提物处理的哈维氏弧菌生长曲线呈正常生长趋势。 当LY3-1 粗提物质量浓度达到16.0 mg/mL 时, 哈维氏弧菌的生长量大幅下降; 当LY3-1 粗提物质量浓度上升至20.0,24.0,32.0 mg/mL 时, 哈维氏弧菌的生长量接近于0,表面生长完全被抑制,说明菌株LY3-1 对紫色杆菌的生长没有影响,也没有抑制作用。
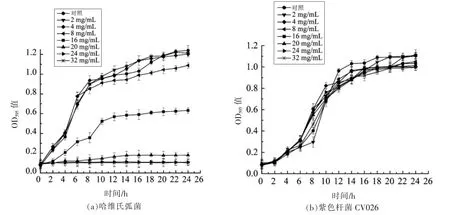
图3 菌株LY3-1 粗提物对哈维氏弧菌和紫色杆菌CV026 生长曲线的影响Fig.3 Effects of strain LY3-1 crude extracts on growth curves of V. harveyi and C. violaceum CV026
2.4 乳酸菌粗提物对哈维氏弧菌生物膜形成的影响
由表2 可知,当菌株LY3-1 粗提物的质量浓度为16.0 mg/mL 时,抑制率为90.6%。根据此结果及粗提物浓度对哈维氏弧菌和紫色杆菌生长活性的影响,选择质量浓度为8.0 mg/mL 的菌株LY3-1 粗提物做后续研究。
菌株LY3-1 粗提物对哈维氏弧菌生物膜形态结构的影响如图4 所示。光镜观察结果表明,对照组哈维氏弧菌在24 h 后初步形成生物膜,而粗提物处理组的哈维氏弧菌菌体呈分散状态, 未形成完整的生物膜(图4a~h)。 图5 中,扫描电镜结果表明:经相同处理时间,对照组(i 和k)生物膜结构完整,而经菌株LY3-1 粗提物处理的试验组(j 和l)生物膜结构丧失。 这与Devi 等[24]对枯草芽孢杆菌R-18 提取物以80 μg/mL 质量浓度处理干扰了S. marcescens 的群体感应系统,导致生物膜的破坏的结果相近。
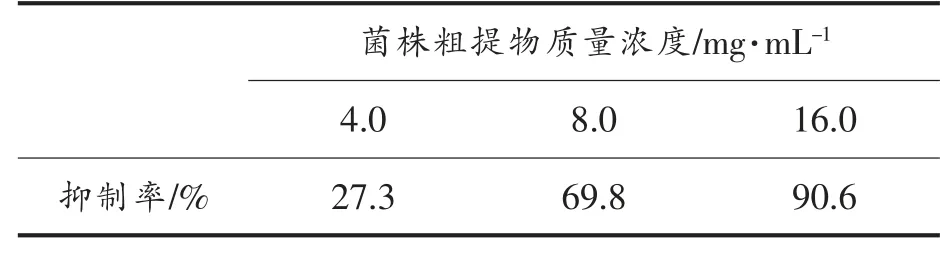
表2 菌株LY3-1 粗提物对哈维氏弧菌生物膜的抑制作用Table 2 Inhibition effects of crude extracts of strain LY3-1 on biofilm of V. harveyi
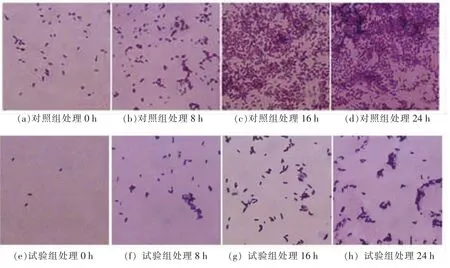
图4 光镜观察菌株LY3-1 粗提物对哈维氏弧菌生物膜的影响Fig.4 Effects of strain LY3-1 crude extraction on biofilm microscopic of V. harveyi by light microscope

图5 电镜观察菌株LY3-1 粗提物对哈维氏弧菌生物膜形态的影响Fig.5 Effects of strain LY3-1 crude extraction on biofilm microscopic of V. harveyi electron microscope
2.5 乳酸菌粗提物对哈维氏菌AHLs 分子的降解作用
采用菌株LY3-1 粗提物降解哈维氏弧菌AHLs 的结果见图6。 由图6 可知,8.0 mg/mL 菌株LY3-1 粗提物降解哈维氏弧菌AHLs 的直径为14.35 mm, 降解率41.7%;16.0 mg/mL 菌株LY3-1粗提物降解时,紫色完全消失,表明该粗提物对哈维氏弧菌AHLs 具有较强的降解作用。 Soukarieh等[25]在喹啉类分子库中筛选出抑制剂Ia、Ii、IIa 和IIi 抑制菌株铜绿假单胞菌 (Pseudomonas aeruginosa)中PaO1-L 和PA14 信号分子形成,具有较强群体感应抑制活性,且不干扰细菌生长。这与本结果类似。
2.6 乳酸菌粗提物对哈维氏菌群体感应抑制作用的影响因素
1)蛋白酶 图7 是经蛋白酶处理后菌株LY3-1 粗提物对哈维氏弧菌群体感应抑制作用的结果。 对照组中抑制直径为13.49 mm, 经胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶和胃蛋白酶处理后平均抑制直径为9.22 mm, 表明菌株LY3-1 粗提物对哈维氏弧菌群体感应的抑制活性显著降低,该活性物质对蛋白酶敏感,属于蛋白质类物质。
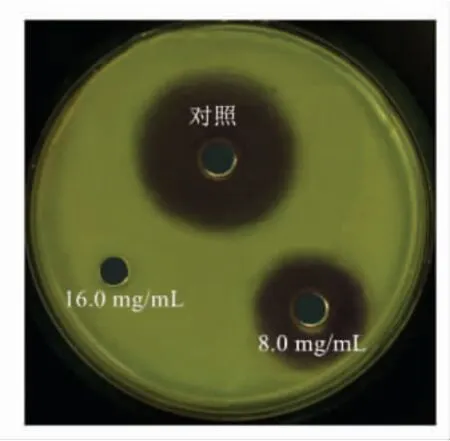
图6 菌株LY3-1 粗提物对哈维氏弧菌AHLs 的降解Fig.6 AHLs-degradation of V. harveyi by crude extraction of strain LY3-1

图7 蛋白酶对菌株LY3-1 粗提物抑制活性的影响Fig.7 Effects of protease on the activity of crude extraction of strain LY3-1
2)温度和pH 表3 为不同温度和pH 处理后菌株LY3-1 粗提物对哈维氏弧菌群体感应抑制作用的结果。 由表3 可知, 经40,60,80,100,121 ℃处理的粗提物对哈维氏弧菌群体感应的抑菌作用与对照组无显著性差异(P>0.05),表明菌株LY3-1 粗提物具有较好的耐热性。 在pH 3.5~7.0 范围,菌株粗提物对哈维氏弧菌群体感应具有抑制活性;在pH4.5~5.5 范围,抑制活性较好(P<0.05),表明菌株LY3-1 粗提物在酸性和偏中性条件下对哈维氏弧菌群体感应具有较强的抑制作用。
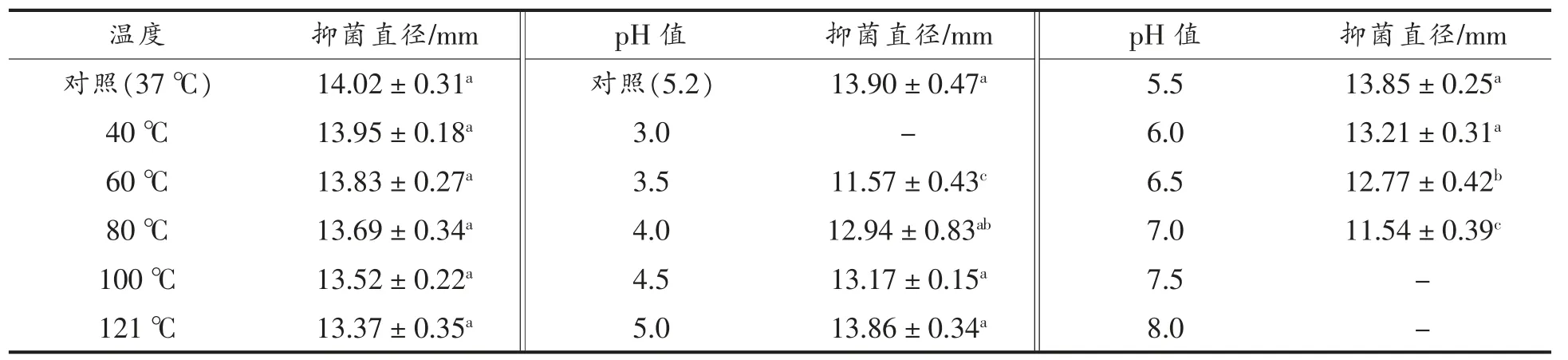
表3 温度和pH 处理对菌株LY3-1 粗提物抑制活性的影响Table 3 Effects of temperature and pH on inhibitory activity of strain LY3-1 crude extracts
3 结论
从鲤鱼肠道中筛选出对哈维氏弧菌群体感应及生物膜形成具有抑制作用的乳酸菌菌株LY3-1,经生理生化反应和16S rRNA 测序鉴定为乳酸乳球菌。 8.0 mg/mL 菌株LY3-1 粗提物可降低哈维氏弧菌生物膜生成量,降解率为69.8%。 当其质量浓度达到16.0 mg/mL 时,可完全降解哈维氏弧菌群体感应AHLs 分子。 对蛋白酶、温度、pH 等影响因素的研究表明: 菌株粗提物抑制活性物质属于蛋白质类,具有热稳定性。本文从自然环境中获得微生物源性革兰氏阴性菌群体感应抑制剂,为控制哈维氏弧菌等致病菌找到一种新型生物制剂。

