犬瘟热病毒受体SLAM TaqMan荧光定量PCR方法的建立
王介淞,林佳旭,王鑫磊,黄 娟
(青岛农业大学动物医学院 山东省兽药诊断试剂工程技术研究中心,山东 青岛 266109)
犬瘟热 (Canine distemper,CD) 是由副黏病毒科(Paramyxoviridae) 麻疹病毒属(Morbillivirus) 的犬瘟热病毒(Canine distemper virus, CDV) 感染引起的多种动物共患传染病[1]。其中犬科、鼬科、猫科等动物是犬瘟热的易感宿主,感染后死亡率为 30%~80%[2]。近年来,随着我国毛皮市场日益壮大,水貂、狐狸和貉的养殖行业蒸蒸日上,密度的扩大加上饲养条件的不规范,使得犬瘟热在养殖场内广泛流行,给养殖户造成巨大的经济损失[3]。
病毒研究的热点之一为病毒受体的研究,受体在病毒感染细胞过程中起很重要旳作用[4-6]。细胞表面受体决定了病毒的组织嗜性和感染宿主范围,因此,CDV的跨种间传播现象与其感染宿主的细胞受体的表达有着密切关系[7]。犬瘟热病毒的表面糖蛋白(血凝素蛋白、融合蛋白)与受体相互识别、吸附,导致CDV侵染宿主细胞[8-9]。信号淋巴细胞激活分子(Signaling lymphocyte activation molecule, SLAM,又称CD150)是犬瘟热病毒的主要受体,在犬瘟热病毒侵染宿主细胞的过程中发挥着重要的作用[10]。研究CDV感染不同阶段SLAM的动态分布,有助于我们进一步阐明CDV的致病机制。但是,目前尚无文献报道SLAM荧光定量PCR(Flurogenic quantitative polymerase chain reaction,FQ-PCR)检测方法。
本试验采用TaqMan探针技术建立了检测水貂淋巴细胞SLAM基因的实时荧光定量PCR方法,为下一步研究CDV感染动物不同阶段SLAM的动态分布提供有效的检测手段。
1 材料与方法
1.1 材料
1.1.1 病毒及质粒 犬瘟热病毒、克隆了水貂SLAM基因的重组质粒pMD18-T-SLAM均由本实验室保存。
1.1.2 主要试剂和仪器 PremixExTaqTM(Probe qPCR)、 PremixExTaqPrimeScript RT reagent Kit(Perfect Real Time)试剂盒、RNAiso plus裂解液,均购自TaKaRa公司;其他试剂均为国产或进口分析纯。主要仪器有Light Cycler 96 SW PCR仪、电泳仪、凝胶成像系统。
1.1.3 试验动物 60日龄的健康水貂,来自青岛某水貂养殖场。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank中已发表的水貂SLAM基因核酸序列(FJ626692),利用Primer5设计1对特异性引物。SLAM基因的引物序列为:F:5′-TCCAGAGGCATAAGTAAG-3′;R:5′-TCCAGATGAAAGGTATAGC-3′;探针序列为:5′-(FAM)CGTCCTTGTCACCAGAGCAGA(Eclipse)-3′。引物和探针由TaKaRa公司合成,荧光标记选择FAM作为报告发光基团,NFQ为淬灭基团,扩增目的片段长度为158 bp。
1.2.2 标准品质粒拷贝数的计算 以pMD18-T-SLAM质粒作为标准品,用紫外分光光度计测定未稀释标准品质粒的OD260值及OD280值,计算标准品质粒的质量浓度(ng/μL)和拷贝数。对其依次进行10-2、10-3、10-4、…、10-12倍梯度稀释,-20 ℃保存备用。
1.2.3SLAMTaqMan荧光定量PCR反应体系和条件的优化
1.2.3.1 引物和探针浓度的优化 以10-2倍稀释的标准品作为模板,引物和探针经过稀释配比成5、10、15、20、25、30 μmol/L的浓度,用矩阵法来筛选构建的SLAM基因荧光定量PCR最佳的引物和探针的使用量。
1.2.3.2 循环条件的优化 为了获得较好的荧光增幅和扩增效率,对TaqMan实时荧光定量PCR循环次数进行筛选;退火温度选择从55 ℃逐渐递增到60 ℃,筛选出最佳的反应条件。
1.2.3.3 荧光定量PCR产物电泳 以优化好的反应条件进行荧光定量PCR,产物于1%琼脂糖凝胶上电泳,拍照记录结果。
1.2.4 标准曲线的构建 以10-2、10-3、10-4、…、10-7倍稀释的标准品做模板,用优化后的反应体系和程序进行TaqMan实时荧光定量PCR,循环阈值作为纵坐标,质粒拷贝数的常用对数(lgC)作为横坐标,绘制标准曲线,计算出其标准线性回归方程,并计算出R值。
1.2.5 敏感性试验 以10倍倍比稀释的标准品为模板,用相应的引物、探针及优化后的条件进行实时荧光定量PCR扩增,并以双蒸水代替模板作为阴性对照,记录数据。

1.2.7 TaqMan荧光定量PCR方法对临床样品的检测 取水貂场60日龄的健康水貂外周血分离淋巴细胞,铺96孔板,并用200 TCID50CDV感染,分别在感染前(0 h)和感染后12 h提取CDV感染组和细胞对照组细胞总RNA,用反转录试剂盒反转录成cDNA,用构建好的TaqMan荧光定量PCR进行检测并记录数据。
2 结果
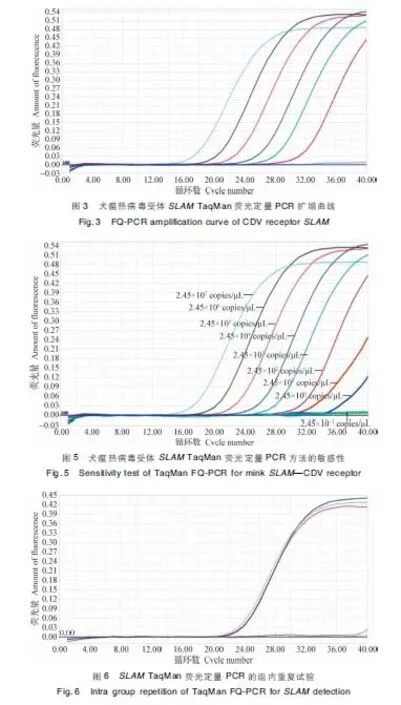
2.1SLAMTaqMan荧光定量PCR反应体系和条件的优化 经过优化,PCR反应总体系为25 μL,其中PremixExTaqTM(Probe qPCR)12.5 μL,上下游引物各0.5 μL,探针1 μL,质粒模板2 μL,补双蒸水至25 μL,反应程序为:95 ℃预变性30 s;95 ℃变性5 s, 55 ℃退火10 s,72 ℃收集荧光20 s,40个循环。此条件能获得良好的扩增曲线(图1),PCR产物呈现单一条带,大小符合预期(158 bp)(图2)。
2.2SLAMTaqMan荧光定量PCR标准曲线的建立 分别以10-2~10-7倍稀释的标准品进行荧光定量PCR见封三彩版图3,建立的标准曲线见图4。SLAM基因的扩增效率为97.8%,R2为0.998 2,表明建立的标准曲线具有良好的线性关系,各个稀释度相关性好,误差较小;循环阈值(y)与质粒拷贝数的常用对数(lgC)的关系式为:y=-2.725 7x+37.212。

图1 水貂SLAM TaqMan荧光定量PCR扩增曲线Fig.1 TaqMan FQ-PCR curve for mink SLAM gene
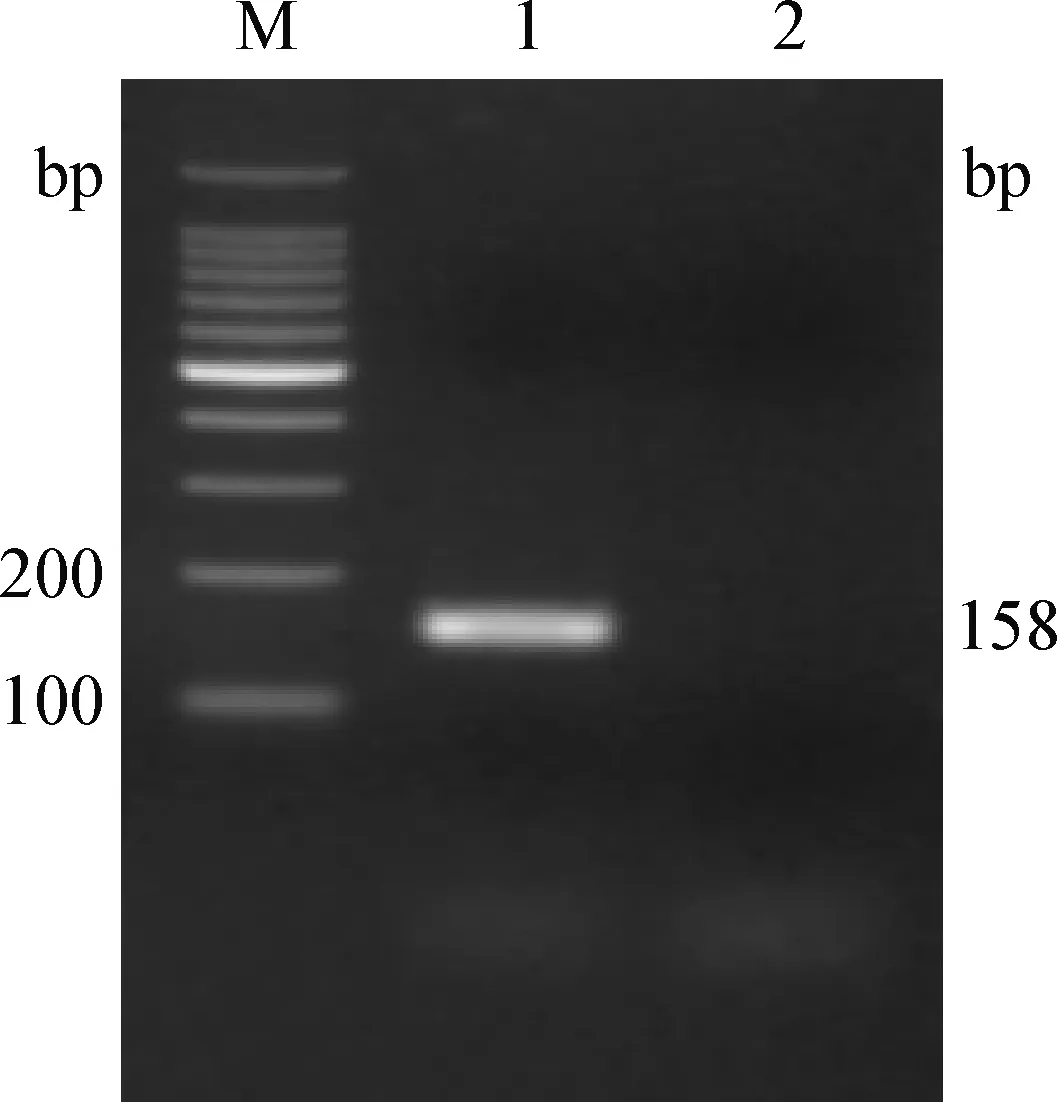
图2 水貂SLAM TaqMan荧光定量PCR产物电泳Fig.2 Electrophoresis of TaqMan FQ-PCR product of mink SLAM geneM:100 bp DNA Laddar Marker; 1:PCR产物; 2:阴性对照M:100 bp DNA Laddar Marker; 1:PCR product; 2:Negative control
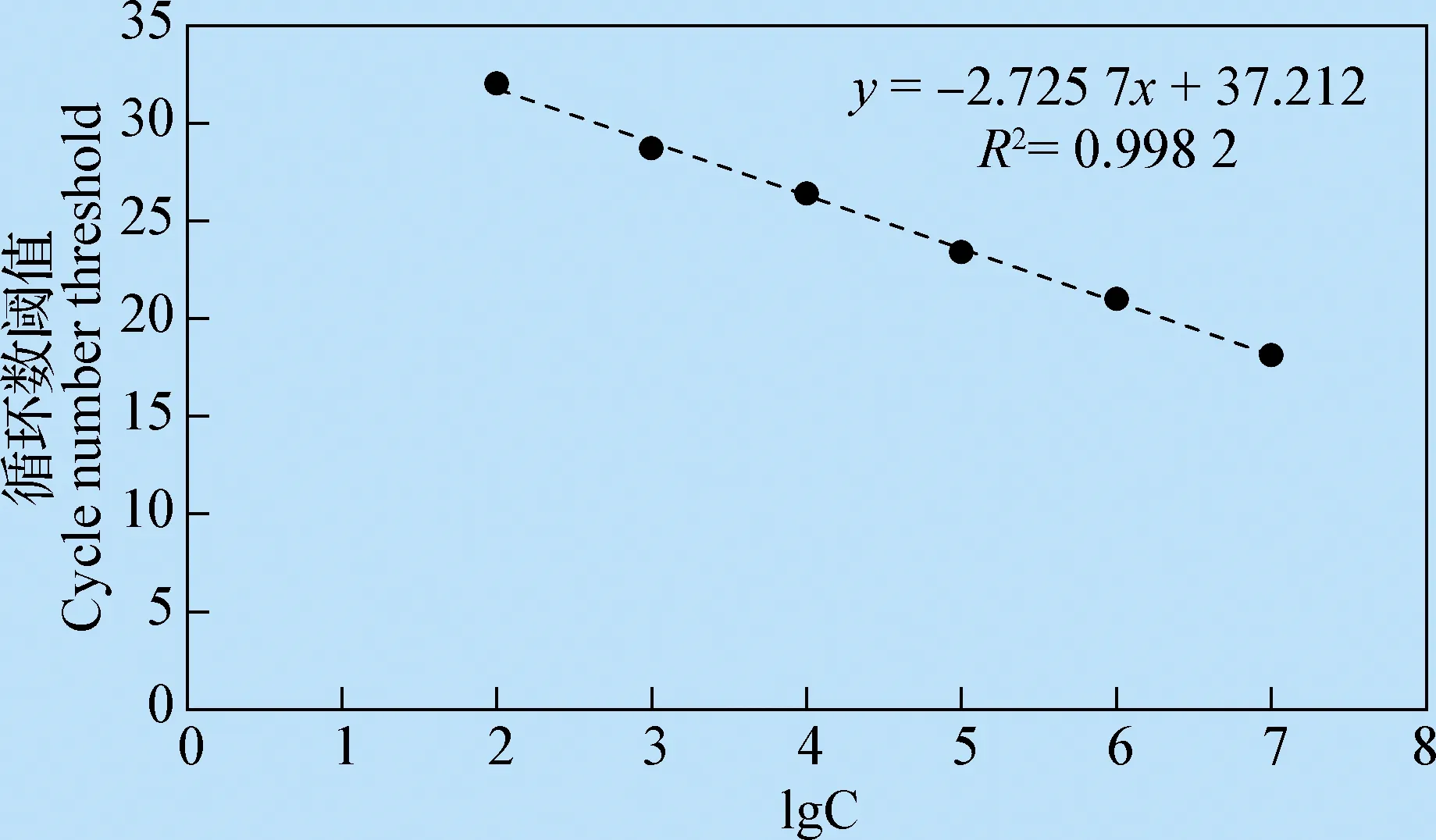
图4 犬瘟热病毒受体SLAM TaqMan荧光定量PCR检测方法的标准曲线Fig.4 Standard curve of FQ-PCR for CDV receptor SLAM detection
2.3SLAMTaqMan 荧光定量PCR方法的敏感性试验 经计算,标准品的起始浓度为2.45×109拷贝/μL,以10倍倍比稀释的标准品进行TaqMan荧光定量PCR,当标准品的拷贝数为2.45 拷贝/μL时,才有扩增曲线出现,而2.45×10-1拷贝/μL及空白对照无扩增曲线(见封三彩版图5),因为模板加入量为2 μL,所以该方法的最低检出限度为4.9个拷贝。
2.4SLAMTaqMan 荧光定量PCR方法的重复性试验
2.4.1 组内重复试验 以同一稀释度的标准品质粒为模板,一次性进行3个样品的重复性试验,结果Cq值分别是21.89、21.87、21.88(见封三彩版图6)。
2.4.2 组间重复试验 以10-2倍、10-3倍、10-4倍稀释的标准品,分别进行6次试验,结果Cq值变异系数均小于1%(见表1),表明检测方法具有较好的组间重复性。
2.5SLAMTaqMan荧光定量PCR方法对临床样品的检测 对体外培养的淋巴细胞在CDV感染前后进行荧光定量PCR检测,结果显示该方法能够检测出外周血淋巴细胞中的SLAM基因,CDV感染后SLAM基因表达量较感染前有所上升,细胞对照组SLAM基因表达量基本保持稳定趋势(见表2)。
3 讨论
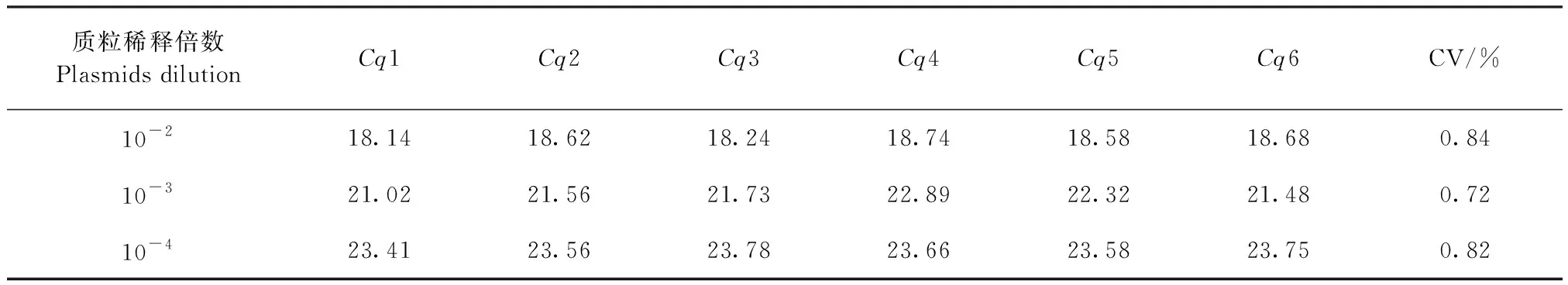
表1 水貂SLAM基因实时荧光定量PCR组间重复试验Table 1 Inter group repetition of TaqMan FQ-PCR based on SLAM

表2 SLAM TaqMan荧光定量PCR方法对体外淋巴细胞的检测Table 2 Detection of SLAM in peripheral blood lymphocyte by TaqMan FQ-PCR assay
SLAM是麻疹病毒属病毒的共同受体,据报道,人麻疹病毒感染机体后并不会引起受体SLAM的下调[11]。为了更好的了解犬瘟热病毒致病机制,需要对其宿主SLAM受体进行多方面的研究,包括动物在发病前和发病后体内SLAM受体的表达情况都需要进一步研究。目前检测目的基因表达的常见方法有常规PCR、免疫组化等[5,12-13]。由于普通PCR只能检测样品中是否含有目的基因,但是不能准确分析样品中目的基因含量的多少;免疫组化利用抗原抗体能够特异性结合的原理,能够对某些成分进行定位,但不能准确定量[5]。本试验构建了相比普通PCR更能准确分析SLAM受体含量的实时荧光定量PCR方法,利用引物和探针相互作用的原理,能够特异性检测SLAM基因的表达情况,表达量的多少根据仪器的Ct(或Cq)值,代入构建好的标准曲线方程式中,在1~2 h以内就能完成检测,省时省力。
犬瘟热病毒受体SLAM荧光定量方法的构建,为研究SLAM与犬瘟热病毒的相互作用,阐明犬瘟热致病机制提供了有力的手段。目前已有报道受体SLAM在感染CDV后的动物体内的不同组织和器官的分布[5],但是至今尚未有研究报道在犬瘟热病毒感染动物后的不同发病时期的表达量的动态变化,通过研究犬瘟热发病不同阶段SLAM蛋白和CDV N蛋白表达量的动态变化和联系,为犬瘟热病的临床观察和预后治疗提供了新的思路和途径。本方法的建立也可以为以后研究犬瘟热病毒与其他受体之间的相互作用提供借鉴。当然,虽然FQ-PCR技术能够定量分析不同时期患病动物淋巴细胞上SLAM受体的mRNA转录情况,但还需与其他方法(如免疫组化结果)相互佐证,综合分析SLAM的基因转录和蛋白表达情况。