过表达TLR4基因绵羊对口蹄疫疫苗(O 型)免疫效应研究
姚玉昌,翟羽飞,宋旭婷,赵多维,陆 奇,徐利强,亓美玉,陆明海
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086;3.黑龙江省农垦科技职业学院动物科学系,哈尔滨 150431)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)所致急性、热性、高度接触性传染病[1],流行快、传播广、发病急,是危害最严重的动物疫病之一[2]。口蹄疫病毒属于微核糖核酸病毒科口蹄疫病毒属,可感染70多种偶蹄目动物[3],对年幼动物致死率较高[4],可在一段时间内影响成年动物生产力[5],包括体重降低、奶产量减少等。研究表明,牛、山羊和绵羊在感染口蹄疫后会成为携带者,2~3年内携带病毒[6]。目前,口蹄疫灭活疫苗是生产中防治口蹄疫主要手段。
Toll样受体4(Toll-like receptor 4,TLR4)作为识别革兰氏阴性菌模式识别受体,在激活机体先天性免疫过程中具有重要作用[7],是最早发现的哺乳动物TLR蛋白。近年研究发现,TLR4也可与部分病毒蛋白(例如流感病毒[8]、呼吸道合胞病毒[9]等)互相作用,激活下游IFN-β,介导炎症反应[10]。TLR4通过以TRIF为主的非依赖性途径,激活IRF-3,分泌IFN-β[11],抑制口蹄疫病毒复制和传播。Zhi等研究表明,FMDV刺激小鼠巨噬细胞后,TLR4的mRNA表达水平显著上调,IL-6、IL-1β、IFN-β等细胞因子表达均显著提高[12]。TLR4基因在机体对口蹄疫免疫应答过程中的介导作用目前仍不清楚。
本研究在前期获得过表达TLR4基因绵羊基础上,建立口蹄疫灭活疫苗(O型)免疫模型,旨在阐明免疫后血液中免疫细胞组成和口蹄疫抗体水平动态变化趋势,揭示细胞免疫和体液免疫状态,为解析TLR4基因在口蹄疫免疫应答过程中作用提供理论依据。
1 材料与方法
1.1 试验动物
选择体况良好、18~21月龄健康德国肉用美利奴公羊14头,其中过表达TLR4基因公羊和非转基因对照公羊各7头,均无口蹄疫感染史和口蹄疫疫苗接种史,由国家转基因重大专项课题组提供。试验羊饲养于东北农业大学绵羊新品种培育基地,每日提供全价精饲料0.5 kg,羊草自由采食,自由饮水。
1.2 试验动物免疫及样品采集
本研究选用O型口蹄疫灭活疫苗(OS株),由中农威特生物科技股份有限公司生产。每头试验羊肌肉注射口蹄疫疫苗2 mL,分别在第0、1、3、5、7、14、21、49天采集各组试验动物颈静脉全血,分离血清和淋巴细胞。
1.3 引物合成
根据GenBank中提供绵羊β-actin基因(NM_001009784.3)和TLR4基因序列(NM_001135930.1),利用Premier 5.0软件设计跨内含子定量PCR引物,引物序列见表1,引物合成由金唯智生物科技(北京)有限公司完成。

表1 定量PCR引物序列Table 1 Primers sequence for real-time PCR
1.4 血常规检测
采集颈静脉血2 mL至EDTA抗凝管后,置于冰盒,4 h内送至实验室,利用全自动血细胞分析仪(ProCyte DX,美国Idexx公司)检测血液中红细胞数(RBC)、血红蛋白含量(HGB)、平均红细胞体积(MCV)、白细胞(WBC)、中性粒细胞百分比(%NEU)、淋巴细胞百分比(%LYM)、单核细胞百分比(%MONO)、嗜酸性粒细胞百分比(%EOS)、嗜碱性粒细胞百分比(%BASO)、血小板(PLT)、平均血小板体积(MPV)。
1.5 外周血淋巴细胞分离
颈静脉采集羊全血10 mL加入肝素抗凝管中,反复颠倒若干次使管内肝素与血液混匀。抗凝血中加入相同体积生理盐水稀释并混匀,取稀释后血液置于淋巴细胞分离液(购自天津灏洋生物制品科技有限公司)液面(稀释后血液与淋巴细胞分离液比例为1∶1),2 500 r·min-1(×500 g)离心20 min,此时离心管中由上至下细胞分为4层,收集第2层絮状乳白色淋巴细胞至离心管中,2 300 r·min-1(×500 g)离心7 min,弃上清,沉淀分为3部分,第1部分沉淀加入Buffer RLT裂解,待提取RNA;第2部分加入1 mL PBS轻轻吹打重悬,所得细胞用于流式细胞分析。
1.6 淋巴细胞亚群分析
用1×PBS缓冲液重悬淋巴细胞,2 300 r·min-1(×500 g)离心7 min后加入1 mL红细胞裂解液吹打均匀,冰上孵育15 min,期间颠倒1次;2 300 r·min-1(×500 g)离心7 min,取沉淀加入1 mL含1%FBS的PBS重悬,2 300 r·min-1(×500 g)离心7 min;100倍稀释单克隆抗体CD4-RPE与CD8-FITC双染避光孵育30 min,2 300 r·min-1(×500 g)离心7 min,弃上清,加入1 mL 1%多聚甲醛固定细胞,吹打均匀,2 300 r·min-1(×500 g)离心7 min;沉淀用0.6 mL灭菌1×PBS缓冲液重悬,每组样品收集10 000个细胞,流式细胞仪(FACS Calibur,美国BD公司)上机检测。
1.7 血清中特异性抗体水平检测
利用中国农业科学院兰州兽医研究所O型口蹄疫抗体液相阻断ELISA试剂盒,分别在免疫后0、3、5、7、14、21、49 d检测血清中特异性抗体水平,具体操作步骤和判定标准依照说明书,若临界值>1∶1024,则将样品血清稀释后重新测定。
1.8 实时荧光定量PCR
提取淋巴细胞并用Buffer RLT裂解后,按照AXYGEN细胞总RNA小量制备试剂盒(货号:AXK-AP-MN-MS-RNA-250G)说明书操作。将提取1 μL RNA样品在1.5%琼脂糖凝胶上120 V电压电泳10 min,检测提取RNA完整度。取1 μL RNA样品滴入微量检测仪检测总RNA纯度和浓度,并将RNA浓度调整至同一数值。按照TakaraPrime-Script™ RT reagent Kit with gDNA Eraser反转录试剂盒说明书,反转录后得到cDNA。利用Roche公司SYBR®Premix Ex Taq™试剂盒和ABI 7500 Fast Real Time PCR仪实时荧光定量PCR。反应体系为cDNA模板1 μL,上、下游引物各0.4 μL,SYBR®Premix Ex TaqⅡ 5 μL,加入ddH2O至10 μL。反应条件:95℃预变性30 s,95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环,最后72℃终延伸7 min。实时荧光定量PCR所用引物详见表1,试验每个基因设置3个平行对照。检测免疫疫苗后淋巴细胞中TLR4基因表达情况,以β-actin为内参基因,采用相对定量法计算目的基因表达量。
1.9 数据分析
使用SPSS18.0软件对数据作统计学处理,采用独立样本T检验,“*”和P<0.05为差异显著,“**”和P<0.01为差异极显著,所有数据均为平均值±标准误(Mean±S.E.M)。
2 结果与分析
2.1 淋巴细胞中TLR4基因表达变化
利用实时荧光定量PCR检测TLR4基因表达水平变化,结果如图1所示。在口蹄疫疫苗免疫后两组TLR4基因表达趋势一致,mRNA水平首先降低,再持续升高;转基因组TLR4基因表达水平高于非转基因组,但未达差异显著(P>0.05)。
2.2 血常规分析
利用全血自动分析仪检测口蹄疫疫苗免疫后血液中各类型细胞数量变化,结果见表2、3及图2,指标均在绵羊正常参数范围。
由表2可知,免疫后0~21 d,试验羊红细胞相关指标均无显著变化(P>0.05),包括红细胞、红细胞比容、血红蛋白、平均红细胞体积、平均血红蛋白量、平均血红蛋白浓度、网织红细胞。白细胞相关指标变化见表3。
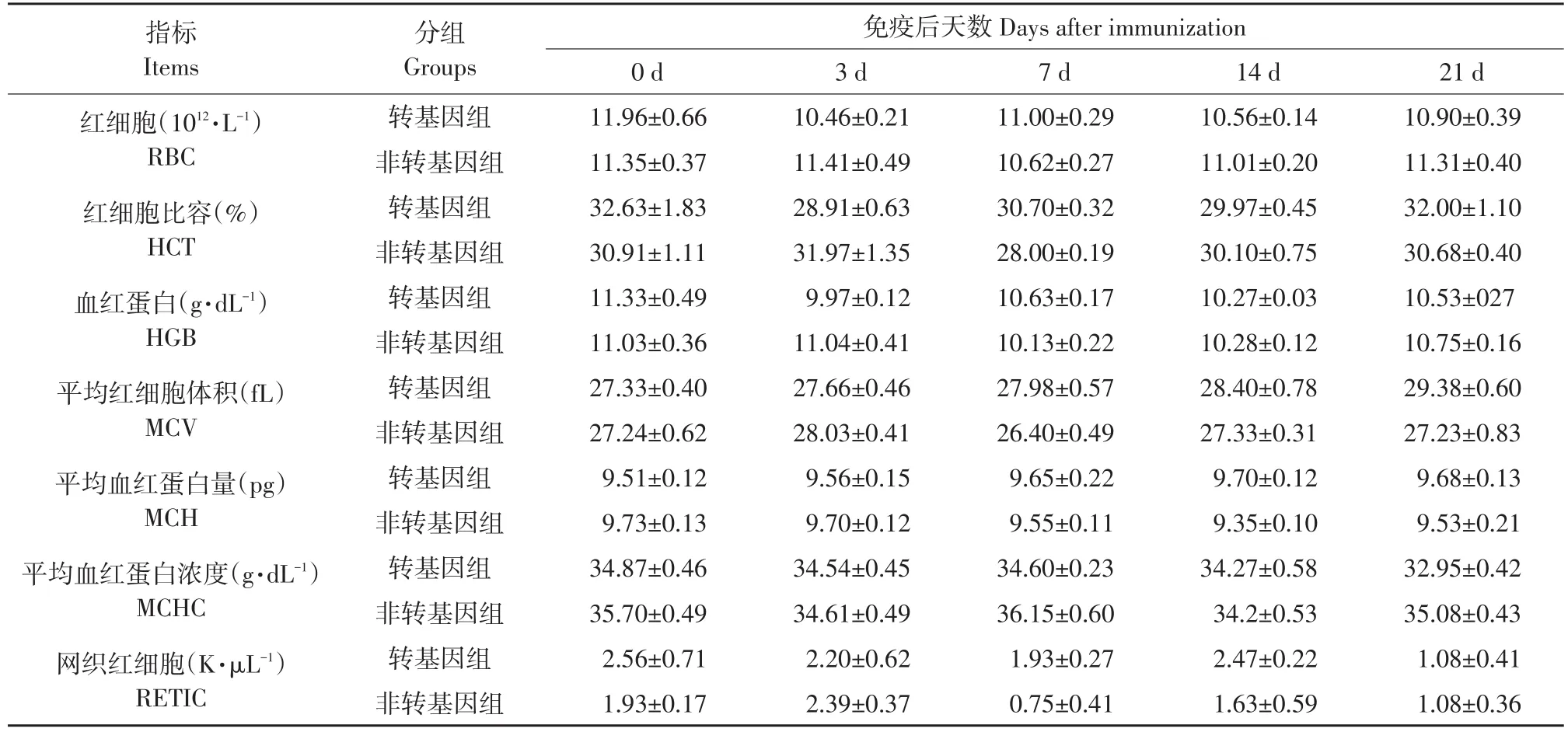
表2 免疫后红细胞指标变化Table 2 Effect on RBC after immunization

表3 免疫后白细胞指标变化Table 3 Effect on WBC after immunization
由表3可知,免疫后3~21 d,非转基因组白细胞数量随免疫时间延续逐渐减少,转基因组白细胞数量呈波动变化,但两组间差异不显著(P>0.05);免疫后淋巴细胞占比略降低,随后趋于稳定,转基因组略高于非转基因组,但未达差异显著(P>0.05);免疫后第3天单核细胞占比升高,后趋于稳定,但转基因组与非转基因组间差异不显著(P>0.05);中性粒细胞占比在免疫后第3天开始升高,随后波动降低,转基因组和非转基因组间差异不显著(P>0.05);嗜酸性粒细胞占比和嗜碱性粒细胞占比在转基因组与非转基因组间差异不显著(P>0.05)。由图2可知,血小板、平均血小板体积,过表达TLR4基因绵羊(转基因组)与非转基因绵羊(非转基因组)间无显著差异(P>0.05)。
2.3 T淋巴细胞亚群变化
利用流式细胞术,检测口蹄疫疫苗(O型)免疫后血液中T淋巴细胞亚群变化(见图3~4)。可知,CD4+T细胞亚群在免疫后第7天出现高峰,第14天时短暂降低,第21天再次升高,转基因组总体水平略高于非转基因组,差异不显著(P>0.05);CD8+T细胞亚群在免疫后7 d达到高峰期,随时间延续逐渐趋于稳定,转基因组与非转基因组间差异不显著(P>0.05)。随免疫后时间延续CD4+与CD8+比值(CD4+/CD8+)总体呈上升趋势,第14天转基因组CD4+/CD8+比值显著高于非转基因组(P<0.05)。
2.4 血液中O型口蹄疫抗体水平消长规律
口蹄疫疫苗免疫0~49 d检测血清中特异性抗体水平变化,如图5所示。由图5可知,转基因组与非转基因组抗体消长趋势一致,免疫后3~7 d,抗体水平持续升高;免疫后7~14 d,抗体水平达到高峰,进入平台期。转基因组抗体水平略高于非转基因组,但未达到差异显著水平(P>0.05)。
3 讨论与结论
先天性免疫反应为宿主抵御病毒感染第一道防线,可通过活化T细胞、巨噬细胞和产生特异性抗体等方式,激活细胞免疫和体液免疫,发挥清除病原体的作用[13]。TLR4基因作为先天免疫系统重要组成,被视为机体识别革兰氏阴性菌特异性受体。近年研究表明,TLR4基因还参与病毒感染性疾病发生和病毒免疫逃逸过程,一些病毒识别和抗病毒通路激活也与Toll样受体关系密切[14]。埃博拉病毒糖蛋白(GP)可与TLR4基因互作进而活化NF-κB途径,介导细胞因子生成,有助于缓解埃博拉病毒感染中循环休克[15]。水疱性口炎病毒(VSV)可经TLR4/CD14活化PI3K/AKT途径介导I型干扰素生成,具有抗病毒作用[16]。Zhi等研究发现,FMDV是激活小鼠和猪巨噬细胞重要先天免疫信号,TLR4 mRNA表达水平在口蹄疫病毒感染后显著上调[12]。本研究发现,TLR4基因表达水平在免疫3 d后降低,7~21 d持续升高,与Zhi等研究结果有一定差异,可能由于前人采用口蹄疫病毒活毒株直接作用于巨噬细胞,本文利用口蹄疫灭活疫苗注射,于绵羊体内不同时期分离巨噬细胞检测TLR4水平,体内、外试验存在差距,相关机制尚需进一步研究。
血常规指标可直观反映疾病变化,在人类和动物健康检测、临床诊断和预后中广泛应用[17]。本研究口蹄疫疫苗免疫21 d后,白细胞数量和淋巴细胞占比均有不同程度降低。贺凯丽研究也表明,荷斯坦奶牛免疫口蹄疫疫苗后,白细胞相关指标下降,说明疫苗激发机体免疫应答反应[18],与本研究结果一致。疫苗免疫后,淋巴细胞中部分B细胞分化为浆细胞,产生口蹄疫抗体,淋巴细胞转化率提高,导致淋巴细胞总量减少[19],与本研究结果中淋巴细胞含量降低后趋于稳定一致。嗜酸性粒细胞和嗜碱性粒细胞与过敏反应和抗敏反应密切相关,本试验嗜酸性粒细胞和嗜碱性粒细胞值均在正常范围且不涉及过敏反应。转基因组与非转基因组免疫细胞变化趋势一致,结果表明口蹄疫疫苗免疫后机体免疫应答系统发挥保护作用。
T淋巴细胞亚群负责机体内细胞免疫,具有抵抗病原侵入和调节免疫系统功能。CD4+T细胞在扩大和建立免疫系统中发挥重要作用,特异性CD4+T细胞产生的免疫应答可帮助抵抗FMDV[20]。CD8+T细胞参与识别病毒和消除病毒引起的感染[21]。在机体正常状态下,机体中CD4+、CD8+T淋巴细胞数量处于相对平衡状态,二者失衡时T淋巴细胞无法有效辅助或抑制免疫效应细胞,影响B淋巴细胞发育和IgG合成,出现体液免疫功能紊乱。因此,CD4+、CD8+T细胞分群检测可作为免疫功能分析及判断免疫水平重要方法[7,22]。本研究中,免疫后各时期CD4+和CD8+细胞数量均在正常范围内。转基因组中CD4+T细胞数量略高于非转基因组,变化规律与其生物学功能一致,即CD4+提高时机体免疫反应增强。蔡虎等研究发现,对注射口蹄疫疫苗免疫28 d的猪强毒攻毒,外周血淋巴细胞中CD4+细胞数量显著升高[23],与本试验结果一致。CD4+/CD8+比值越高,抵抗FMDV感染能力越强[24],本研究中羊在免疫口蹄疫疫苗后第3天,CD4+/CD8+比值较高,表明机体免疫机能增强。第14天,转基因羊CD4+/CD8+比值显著高于非转基因对照羊,代表转基因羊细胞免疫反应更强。
注射免疫口蹄疫(O型)疫苗后可有效诱发机体抗体水平提升,绵羊注射口蹄疫疫苗后第7天即产生抗体[25],11~14 d时,抗体阳性率达到最高值;免疫后50 d,抗体水平开始逐渐下降,失去保护力[27]。本研究中,血清中抗体水平在14 d达到峰值,抗体消长规律与前人报道结果一致[27]。过表达TLR4基因羊的抗体水平略高于非转基因羊,尽管未达差异显著(P>0.05),但口蹄疫抗体水平与保护效果呈正相关,因此过表达TLR4基因羊较高的抗体水平可提供更有效保护。

