胁迫条件下褪黑素诱导雨生红球藻虾青素合成
崔 静, 李 涛, 丁 巍, 赵永腾, 余旭亚
(昆明理工大学 生命科学与技术学院,云南 昆明650500)
虾青素具有淬灭单线态氧的能力,是一种具有强抗氧化特性的萜类化合物,被作为添加剂广泛应用于食品和水产生物的养殖中[1-2]。 在胁迫条件下,雨生红球藻会大量合成虾青素,被公认为是天然虾青素的最佳生物来源[3-4]。 虾青素作为一种具有强抗氧化特性的物质,其生物合成是雨生红球藻抵抗生物或非生物胁迫的一种防御作用[5-6]。 雨生红球藻中虾青素含量的积累,对提高其响应外界胁迫的防御作用尤为重要。
MLT 是一种新的植物生长调节剂和抗氧化剂,可提高植物对各种生物和非生物胁迫的耐受性[7]。Shi 等[8]的研究显示,外源添加MLT 处理病原菌Pst DC3000 侵染的拟南芥叶片,可增加NO 生成及SA相关基因的表达,增加对病原菌的抗性。 雨生红球藻作为一种真核单细胞绿藻, 在胁迫条件下,MLT对虾青素积累的作用,及其与藻细胞内信号分子之间的相互作用仍未见报道。
包括微藻在内的真核生物中,在外部环境刺激下,各种信号通路会开启或关闭,并逐级放大或相互关联,从而调控生物体内的复杂生理活动。 NO 作为一种多用途的细胞信号效应器,它在不同的代谢过程中起着重要作用, 如抗生物和非生物胁迫,调节激素信号传导等[9],是生物体内一种重要的信号分子。 有丝分裂激活蛋白激酶(MAPK)信号通路,在各种真核生物的复杂生理活动中扮演着重要的角色,NO 和MAPK 信号通路对调节多种细胞功能发挥了核心作用[10],但是在微藻中,关于这些信号级联的作用鲜有研究。
作者旨在缺氮联合高光照条件下,外源添加MLT 诱导雨生红球藻积累虾青素,初步阐明MLT对雨生红球藻应激反应的调控作用。并利用小分子抑制剂的化学遗传学,研究了MLT 调控NO 介导的MAPK 信号传导途径对雨生红球藻中虾青素积累的影响。
1 材料与方法
1.1 雨生红球藻的培养和诱导
雨生红球藻Haematococcus pluvialis LUGU 由云南泸沽湖水样中分离纯化所得[11]。以BBM 为基础培养基,于3 L 鼓泡式光生物反应器(直径0.2 m,高0.3 m)中培养,(其中含2 L BBM 培养基),并以0.1 vvm 的速度通入无菌空气,光照强度为2800 lx,培养温度(25±1) ℃,培养到对数后期(大约9.0×105cells/mL)。
3800g 离心5 min,无菌水洗涤2次,以去除残留的营养物质。 将所获的藻液沉淀,重新悬浮至缺氮的BBM(500 mL 锥形瓶,其中含360 mL 培养基)培养基中,最初的细胞浓度调整为2×105cells/mL。将不同的化学小分子加入到缺氮BBM 培养基中(表1)。将未经处理的藻细胞培养作为对照组。每组设3个平行样。以0.4 vvm 的速度通入无菌空气,光照10000 lx,温度保持在(28±1) ℃,室内培养13 d。
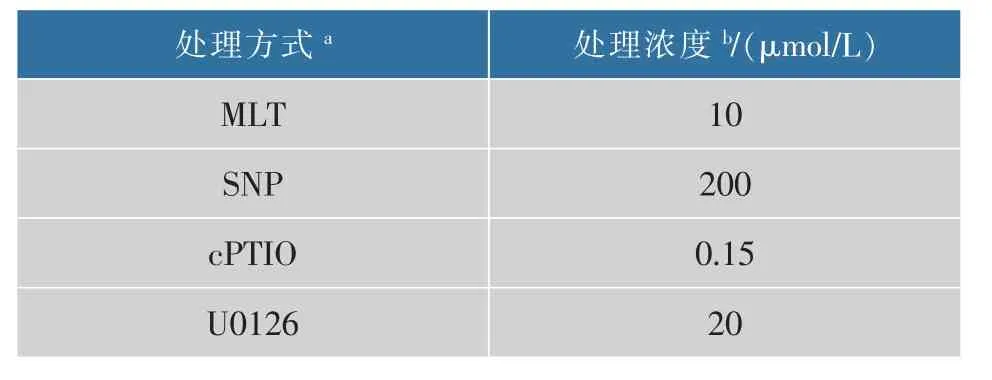
表1 诱导虾青素生物合成不同诱导子的处理浓度Table 1 Concentration of different treatments used for the induction of astaxanthin biosynthesis
1.2 藻细胞生物量、虾青素的测定
为测定Haematococcus pluvialis LUGU 的干细胞质量(DCW),每隔4 天取10 mL 诱导藻液,并3800 g 离心5 min, 所获沉淀用蒸馏水洗涤2次,离心、收集、置于EP 管中,储存于-20 ℃,冷冻干燥并测定质量。
利用高效液相色谱(HPLC)测定虾青素含量。取各干燥样品10 mg,充分研磨,然后用丙酮∶氯仿(1∶1,V/V) 溶液提取干藻粉中虾青素,4 ℃条件下,12000 g 离心5 min。 多次重复此过程,至藻细胞呈白色。 将提取后的溶液置于45 ℃真空干燥箱完全干燥。 随后用1 mL 甲醇∶二氯甲烷(3∶1,V/V)溶液溶解干燥的提取物,HPLC 上样检测。 其中,HPLC 条件为:流动相A 为丙酮,流动相B 是体积比为9∶1 的甲醇∶水; 洗脱梯度为:B 80%~20%25 min,B 20% 10 min,B 20%~80% 15 min,进样量20 μL, 流速为1.25 mL/min。 光谱扫描波长范围为250~700 nm,检测波长为476 nm。 用液相色谱标准曲线计算虾青素质量浓度c(mg/L),虾青素质量分数为:

其中,P 为虾青素质量分数,(mg/g);DCW 为干细胞质量浓度,(g/L)。
1.3 藻细胞内NO 的检测
用双胺荧光素(DAFM-FM DA)检测NO 水平[12]。将新鲜藻细胞(1×106cells/mL)离心、洗涤,加入5 μmol/L DAF-FM DA,避光、恒温37 ℃条件下,置于HEPES/PBS 缓冲液(pH 7.4)中振荡孵育20 min。 离心、洗涤,利用激光扫描共聚焦显微镜采集藻细胞荧光图片; 荧光分光光度计检测微藻细胞荧光强度,计算NO 含量。
1.4 总蛋白质提取和蛋白免疫印迹
取新鲜藻液5 mL,3500 g 离心10 min,将沉淀物悬浮于Tris 缓冲盐溶液 (TBS, 浓度50 mmol/L Tris-HCl,pH 7.4, 浓度150 mmol/L NaCl,pH 7.5)中。 12000 g 离心5 min,并将沉淀物加入含有浓度1 mol/L Tris-HCl(pH 8.0),体积分数0.2%聚乙烯吡咯烷酮, 体积分数2.0% 2-巯基乙醇,1 mmol/L EDTA,10 mmol/L 磷酸酶抑制剂复合物I 和1 mmol/L PMSF 的提取液中。 4 ℃匀浆研磨,12000 g 离心30 min 得到总蛋白质提取液。 根据Bradford[13]法测定上清液中总蛋白质的含量。上清液储存于-80 ℃。
样品蛋白质通过质量分数12% SDS-PAGE 分离并转移至硝酸纤维素膜。 将膜置于5 g/dL 脱脂奶粉TBST 溶液中封闭1 h, 然后放入含有p38MAPK抗体的抗血清溶液中4 ℃孵育过夜后, 用TBST 洗涤, 随后用1∶1000 稀释度的抗兔免疫球蛋白G 的辣根过氧化物酶缀合的抗体孵育2 h[14-15]。 通过使用增强的化学发光底物检测试剂盒使抗原抗体复合物可视化,进而得到MAPK 蛋白质表达量。
1.5 RNA 提取及基因表达量的检测
使用TriZol 试剂提取总RNA。利用RT-PCR 试剂盒(TaKaRa)对1 μg RNA 进行反转录,然后进行qRT-PCR 扩增,使用ABI 7500 荧光定量仪分析dxs和chy 相对转录水平。表2 为内参基因18 S 和dxs、chy 的荧光定量引物。 其中内参基因的作用即作为内标以调节RNA 的用量和循环数, 使内标基因在诱导条件下的表达丰度一致。qRT-PCR 数据结果用2-ΔΔCt[16]的方法进行分析。
1.6 统计分析
每组试验设置3个平行。 采用ANOVA(SPSS 20.0)一步法分析所得试验数据。最小显著性差异进行多重比较检验,分析不同试验的组间差异,当p<0.05 时具有显著性意义,p<0.01 具有极显著性意义。
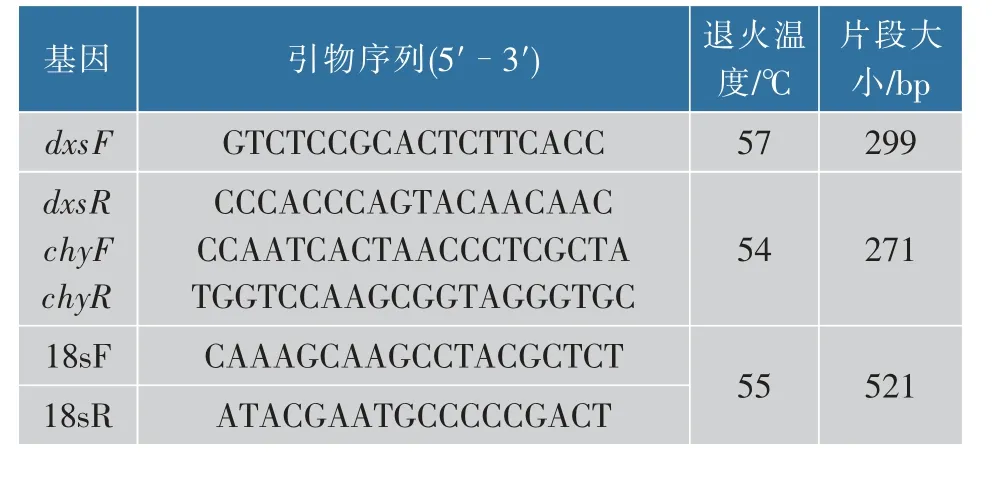
表2 酶基因荧光定量引物Table 2 Primers of Enzyme genes for qRT-PCR
2 结果与讨论
2.1 不同处理对雨生红球藻生物量和虾青素积累的影响
不同诱导方法对雨生红球藻生物量和虾青素积累的影响见图1,随着培养时间的延长,所有实验组的生物量呈上升趋势。经过13 d 的培养,对照组、MLT 组和SNP 组的生物量分别达到了0.61、0.59、0.70 g/L。 MLT 结合cPTIO 组和MLT 结合U0126 组的雨生红球藻生长受到抑制,与对照组相比,生物量分别降低22.95%和26.23%。

生物量增加的同时,虾青素的质量分数在所有实验组中也显示出不同程度的提高。 如图1 (b)所示,在0~13 d 培养过程中,对照组虾青素的质量分数为14.36 mg/g。 在外源添加MLT 后,细胞内的虾青素质量分数迅速增加至32.37 mg/g, 与对照组相比,增加了2.25 倍。 在SNP 诱导组中,虾青素质量分数也明显比对照组更高, 并在13 d 后达到峰值19.69 mg/g。 相比之下,cPTIO 和U0126 的预处理导致了虾青素的积累减少, 最高质量分数分别为11.04 mg/g 和9.03 mg/g。
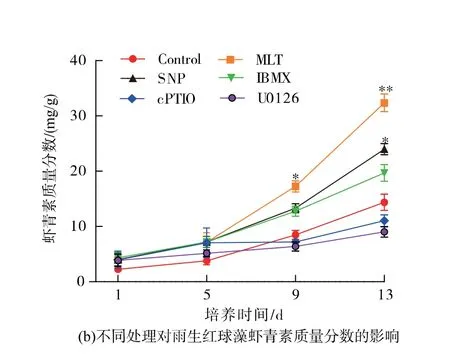
图1 不同处理对再生红球藻生物量和虾青素质量分数的影响Fig. 1 Effects of different treatments on biomass and astaxantin content of H.plunalis
2.2 不同诱导方法对雨生红球藻细胞内NO 水平的影响
生物体内,NO 是参与多种生理活动的信号分子。为了确定MLT 对虾青素积累的调控机制是否依赖NO 对胁迫的反应,应用MLT、SNP(NO 供体)和MLT 结合cPTIO (NO 消除剂)3 种处理方式处理雨生红球藻,另设有对照组。不同诱导方法对雨生红球藻细胞内NO 水平的影响如图2 所示。 相比对照组,MLT 处理组和SNP 处理组的NO 水平显著增加,而MLT 结合cPTIO 处理组细胞内NO 水平显著降低。
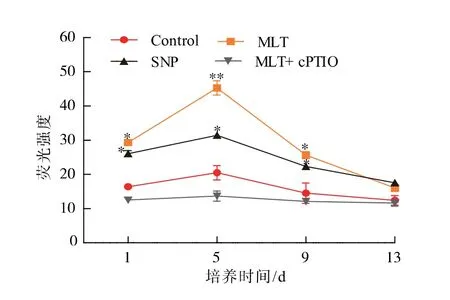
图2 不同处理对雨生红球藻细胞内NO 水平的影响Fig. 2 Effects of different treatments on nitric oxide levels in H.pluvialis
2.3 不同诱导方法对雨生红球藻细胞内MAPK 的影响
MAPK 是将细胞外刺激信号转换成细胞内反应的一类丝氨酸/苏氨酸蛋白激酶,在许多真核生物的生理过程中发挥着重要的细胞信号传导作用,参与细胞内多种代谢过程[17]。 Western blotting 检测MAPK表达水平的结果如图3 所示。 当利用不同化学分子诱导藻细胞后,在第5 天MAPK 的含量显示出显著差异。 相比对照组,MLT 诱导组和SNP 诱导组的MAPK 水平显著提高, 而MLT 结合cPTIO、MLT 结合U0126 处理组的MAPK 表达水平被明显抑制。至第13 天,与第5 天的水平相比,所有组的MAPK 含量均增加;相比之下,MLT 结合U0126 组,MAPK 水平仍然低于其他组,虾青素的合成也受到抑制(图1(b)),源于U0126 对MAPK 的抑制作用。

图3 不同处理对雨生红球藻细胞内MAPK 的影响Fig. 3 Effects of different treatments on MAPK in H.pluvialis cells
2.4 不同诱导方法对雨生红球藻虾青素积累相关基因转录水平的影响
环境胁迫条件下,外源化学物质或植物激素的添加,可调节微藻中与虾青素生物合成相关基因的表达量[18]。为了确定缺氮联合高光条件下,MLT 对雨生红球藻虾青素合成相关基因转录水平的影响,借助实时荧光定量PCR,在诱导5 d 和13 d,对藻细胞虾青素合成关键基因dxs 和chy 的表达水平进行检测、分析。 图4 显示,第5 天的cPTIO 诱导组中,上述2 种基因表达水平均相对较低。 在第13 天,MLT 诱导组和SNP 诱导组,dxs 和chy 的转录水平与对照相比均表现出显著性增加,达到最大转录水平。 其中,在MLT 处理组与对照组相比,dxs 和chy的最大转录水平分别提高了1.95 和1.74 倍;在SNP 组,dxs 和chy 的最大转录水平均是对照组的1.32 倍。 然而,在cPTIO 诱导组中,2 种基因的转录水平均显著降低。
2.5 讨论
研究表明,在胁迫条件下,雨生红球藻会大量积累虾青素,生物量也会受到一定影响[19]。在本研究中,MLT 诱导组生物量与对照组相比, 没有显著差异。 这一结论与之前的研究结果相似,强光照条件下添加MLT 可以抑制莱茵衣藻生物量的降低[20]。 周永斌等[21]发现SNP 对种子发芽势、发芽率及幼苗的根长、 叶绿素含量和生物量有明显的促进作用,且Giba 等[22]也发现NO 消除剂可抑制皇后树种子萌发而SNP 则促进种子萌发。 由于藻类和植物的相似性,我们的结果也与之相似,作为NO 的供体,SNP的添加促进了雨生红球藻的生长,生物量质量浓度达到了0.70 g/L;NO 清除剂-cPTIO 的添加和MAPK抑制剂-U1026 的添加均抑制了雨生红球藻的生长。

图4 不同处理对dxs、chy 转录水平的影响Fig. 4 Effects of different treatments on the transcription level of dxs,chy
一些化合物, 作为代谢的启动因子或增强子,能够直接调节细胞代谢,可以应用于雨生红球藻以促进虾青素的积累[23-24]。 近年的研究表明,茉莉酸(JA)、水杨酸(SA)、赤霉酸(GA3)、脱落酸(ABA)、黄腐酸(FA)和2,4-表油菜素内酶(EBR)均可以增强虾青素的积累[25-26]。 MLT 作为一种信号分子和抗氧化剂,其外源添加也显著促进了雨生红球藻虾青素含量。 在胁迫条件下,MLT 可能是以增强雨生红球藻中虾青素积累的方式响应外界刺激,提高雨生红球藻对外界胁迫的抵御能力。 另外,SNP 诱导组的虾青素含量得到提升,MLT 结合cPTIO 和U0126的处理导致了虾青素的积累减少,推测虾青素的积累可能与藻细胞内NO 水平有关, 而NO 作为信号分子可能是通过激活了MAPK 信号通路从而提高了虾青素积累量[27]。
通过测定雨生红球藻细胞内的NO 含量, 发现MLT 处理组和SNP 处理组的NO 水平提高,MLT 结合cPTIO 处理组细胞内NO 含量显著降低,相应地,虾青素积累量也显著降低(图1(b))。这一结果表明虾青素的积累与藻细胞内NO 水平有关,且MLT 调控雨生红球藻对外界胁迫的作用依赖于NO 的介导。
为了验证NO 作为信号分子是否通过激活MAPK 信号通路,从而提高虾青素积累量,即MAPK是否为NO 在藻细胞中的一个重要靶点, 本研究借助Western blotting 检测了MAPK 的表达水平。结果表明,MAPK 抑制组中,MAPK 含量显著低于对照组,虾青素的合成受到抑制(图1(b))。 NO 清除组中,MAPK 水平没有受到抑制,虾青素合成同样受到抑制(图1(b)),表明藻细胞内NO 水平可通过影响MAPK 含量影响雨生红球藻中虾青素的积累。
Neill[28]和Asai[29]的研究结果显示,NO 信号的传递与MAPK 信号通路有关,如:NO 处理能诱导拟南芥悬浮细胞4.7×104的MAPK 活性增高。 Pagnussat等[30]的研究也表明,外源NO 和生长素诱导黄瓜不定根形成过程中激活了4.8×104MAPK 活性,而NO清除剂-cPTIO 不仅能抑制该激酶活性的增加,而且能抑制外源NO 和生长素对不定根形成的诱导作用,证明了NO 激活MAPK 信号通路是生长素诱导不定根形成必需的。
Shi 等[31]发现MLT 可诱导高水平的NO 刺激防御相关基因的表达, 而NO 清除剂可抑制烟草和拟南芥中防御相关基因的表达。 本研究的结果与此一致,在胁迫条件下,外源MLT 的添加,提高了雨生红球藻细胞内的NO 水平, 激活了依赖于NO 的MAPK 信号通路, 虾青素的积累作为雨生红球藻响应外界刺激,提高其对外界胁迫的方式,虾青素合成关键酶基因的表达水平得到上调,从而提高了虾青素积累量。 在许丽丽等[32]的RNA-Seq 分析表明,MLT 的处理使葡萄果实中有30个sts 基因表达上调,提高了葡萄果实和根系中白藜芦醇的含量。
3 结 语
综上,可提出一种褪黑素诱导虾青素高效合成的信号通路模型(见图5)。 高光照、氮缺陷条件下,外源添加MLT 提高了雨生红球藻细胞内的NO 水平,激活了依赖于NO 的MAPK 信号通路,上调了虾青素合成关键酶基因dxs 和chy 的表达水平,进而促进了虾青素的大量积累。 实验证实了在雨生红球藻中MAPK 是NO 作用的一个靶点,这为基因工程改造雨生红球藻以提高虾青素产量提供了科学的依据,对进一步研究雨生红球藻高效合成虾青素具有一定的理论和实践意义。随着MLT 诱导雨生红球藻虾青素生物合成体系的建立和信号转导调控的进一步研究,分子水平调控雨生红球藻虾青素合成将为虾青素生产提供一种有效策略。
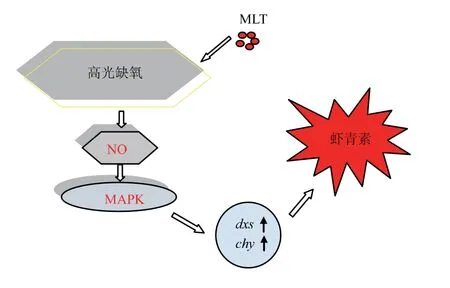
图5 褪黑素诱导雨生红球藻在胁迫条件下积累虾青素的信号通路假设模型示意Fig. 5 Schematic diagram of the signal pathway hypothesis model for the accumulation of astaxanthin in Haematococcus pluvialis induced by melatonin under stress

