硫化钠法合成聚苯硫醚过程反应动力学研究
曾旭旭,王 璐,甄卫军,赵 玲
(新疆大学 化学与化工学院 石油天然气精细化工教育部重点实验室,新疆 乌鲁木齐 830046)
由于原料易得、反应条件温和、收率高等优势,目前硫化钠法是聚苯硫醚(PPS)主要的工业生产方法,当单体对二氯苯(p-DCB)比硫化钠或硫氢化钠略过量时,在220~260 ℃下反应5~6 h可得到数均相对分子质量为4×104~6×104的聚合物[1-2]。Fahey 等[3-4]提出该反应为苯环上的亲核取代反应(SNAr),极性溶剂N-甲基吡咯烷酮(NMP)通过解离离子使SNAr反应更容易进行,贺建业等[5]发现钠离子被极性溶剂络合后充分裸露,硫离子亲核性加强。Rajan等[6-7]发现PPS聚合按二级反应历程进行,贺建业等[8]还根据AB型自缩聚统计理论建立了PPS合成宏观反应动力学方程,文帅等[9]建立了基于Monte Carlo方法的PPS聚合反应动力学模型,但这些动力学模型均在特定的一个或几个温度点下建立。目前工业PPS生产大都采用间歇工艺,为达到聚合物高产率、高相对分子质量,一般采用变温升温过程,因此需要了解更宽温度范围内PPS的合成动力学规律。
本工作在180~260 ℃温度范围内考察了硫化钠法制备PPS过程中单体转化率、氯化钠生成率随时间的变化规律,分别建立了反映单体消耗和缩聚程度的动力学模型,并通过基团贡献法估算了单体缩合反应热,分析了不同温度下的放热强度。为PPS工业制备过程优化和反应器的设计提供依据。
1 实验部分
1.1 实验原料
硫氢化钠(含水量70%(w))、1-氯萘(纯度大于85%(w)):上海阿拉丁生化科技股份有限公司;NMP:分析纯,天津市致远化学试剂有限公司;p-DCB(纯度大于99%(w))、氯化锂(纯度大于97%(w))、氢氧化钠(纯度大于96%(w)):天津市永晟精细化工有限公司产品;去离子水自制。
1.2 实验步骤
反应在配有冷凝管和搅拌器的三口瓶中进行。首先由硫氢化钠和氢氧化钠在溶剂NMP中进行脱水反应得到Na2S;然后加入一定量的含有氯化锂和p-DCB的NMP溶液,迅速升温至设定温度(控制精度±1 ℃),反应至设定时间终止;最后冷却过滤反应物料,并用热去离子水多次洗涤,收集所有过滤/洗涤液定容后分析氯离子和硫离子含量;干燥洗涤后的固体,得黄色PPS产物。
1.3 分析方法
分别采用沉淀滴定法和莫尔法测定过滤/洗涤液中硫离子和氯离子的含量[10],确定Na2S单体转化率和氯化钠生成率。
采用一点法测定PPS的特性黏度([η]),用溶剂1-氯萘配制聚合物含量为4 g/L的溶液进行分析,测定温度(208±0.2) ℃,重均相对分子质量(Mw)由Mark-Houwink方程(式(1))计算[11]。

式中,K和a为Mark-Houwink参数,K= 8.91×10-5,a= 0.747。
2 结果与讨论
2.1 PPS合成反应程度变化规律
在Na2S初始浓度为1.22 mol/kg、p-DCB初始浓度为1.36 mol/kg、氯化锂含量为2.86%(w)的PPS合成典型工艺条件下,考察了180~260 ℃范围内Na2S单体转化率、氯化钠生成率随反应时间的变化规律,实验结果见图1。由图1可知,Na2S单体转化率、氯化钠生成率的计算值与实验值的平均相对误差分别为4.9%和7.0%,总体上较好。
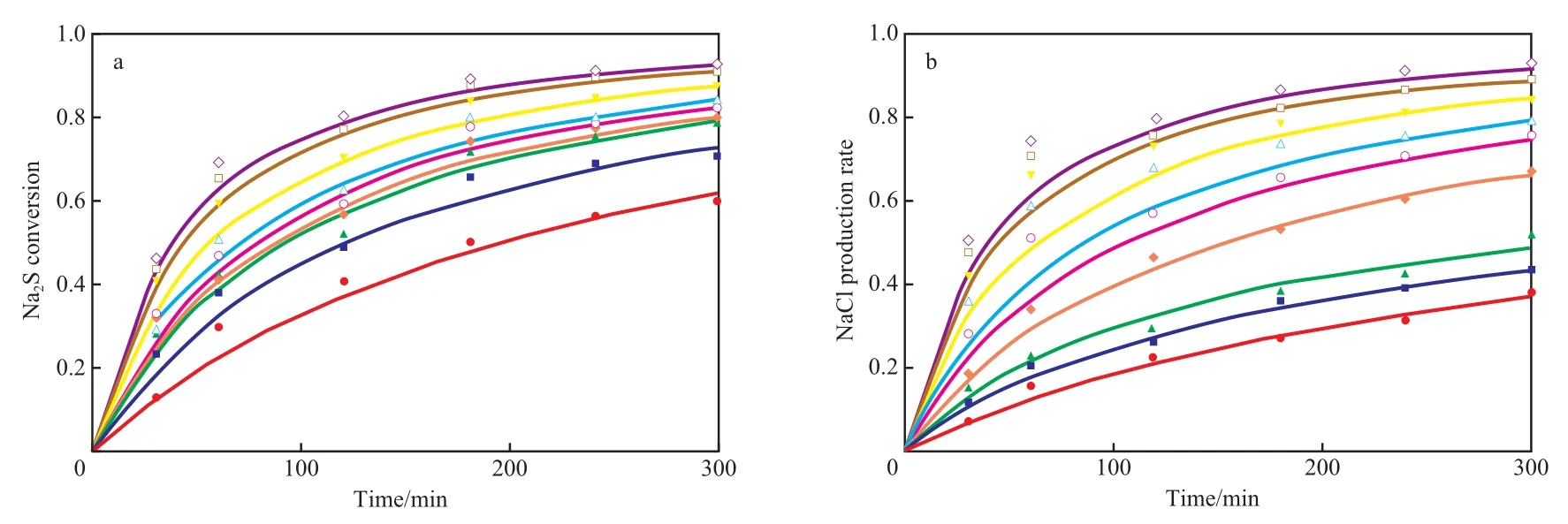
图1 不同温度下Na2S转化率和氯化钠生成率随反应时间的变化Fig.1 Na2S conversion and NaCl production rate change with reaction time at different temperatures.
PPS合成反应通式见式(2)。从式(2)可知,Na2S和p-DCB反应生成PPS是双官能团的A2B2型缩聚反应,但从图1可看出,Na2S单体转化率和氯化钠生成率并不相同,特别在低温下和反应前期,氯化钠生成率低于Na2S单体转化率,这也表明PPS聚合过程不是A2B2型反应[8]。按照目前公认的SNAr反应机理,PPS合成过程中Na2S单体和p-DCB先反应生成对氯硫酚钠,对氯硫酚钠再与单体反应生成链段长短不一的低聚物,之后体系中不同链段长度的低聚物之间再进行自缩聚反应,使低聚物不断向高聚物转变,最终生成具有高相对分子质量的线性PPS,反应式见式(3)~(5)。综上可知,PPS聚合反应实际是A2B2型小分子缩合反应和AB型自缩聚反应的串联[8-9]。

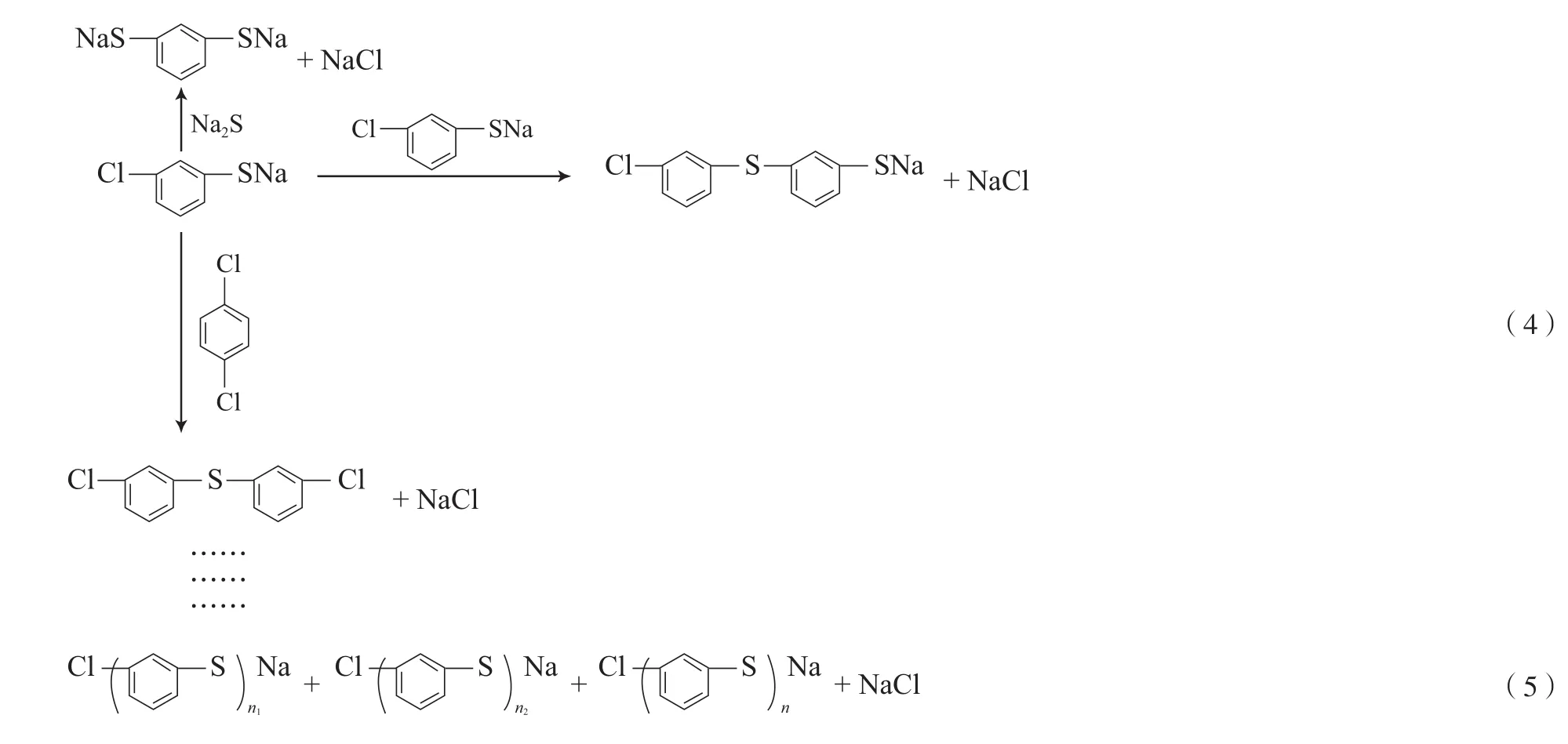
Na2S单体转化率(x)可以代表小分子缩合反应程度,氯化钠生成率(PNaCl)实际是小分子缩合反应和自缩聚反应的综合反应程度。根据物料衡算,通过自缩聚反应进一步生成PPS的反应程度(P)可用式(6)计算。

为得到高转化率和高自缩聚反应程度,必须在较高温度下反应足够长时间。实验数据表明,260 ℃下反应5 h,单体转化率和自缩聚反应程度才可达到90%以上,此时聚合物的重均相对分子质量约为13×104;而较低温180 ℃和190 ℃下反应5 h单体转化率低于80%,自缩聚反应程度小于30%,此时产物主要为重均相对分子质量只有几千的低聚物。
2.2 PPS合成反应动力学
一般认为PPS合成反应符合二级反应动力学规律[6-7],因此小分子缩合反应动力学方程可以用式(7)表示。
式中,cA为Na2S的质量摩尔浓度,mol/kg;cB为p-DCB的质量摩尔浓度,mol/kg;k1为小分子缩合的反应速率常数,kg/(mol·min);t为反应时间,min。
聚合单体为非等当比时,引入过量比(M)并结合cA=cA0(1-x),式(7)可解析为式(8)。
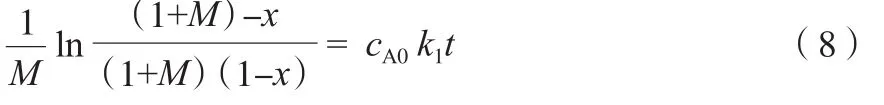
式中,M=cB0/cA0-1,cA0为Na2S的初始质量摩尔浓度,mol/kg;cB0为p-DCB的初始质量摩尔浓度,mol/kg。

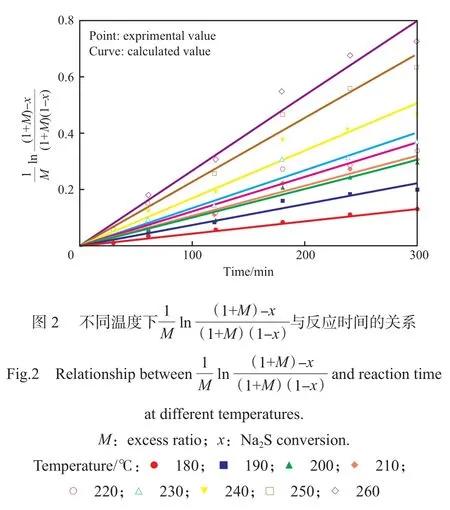
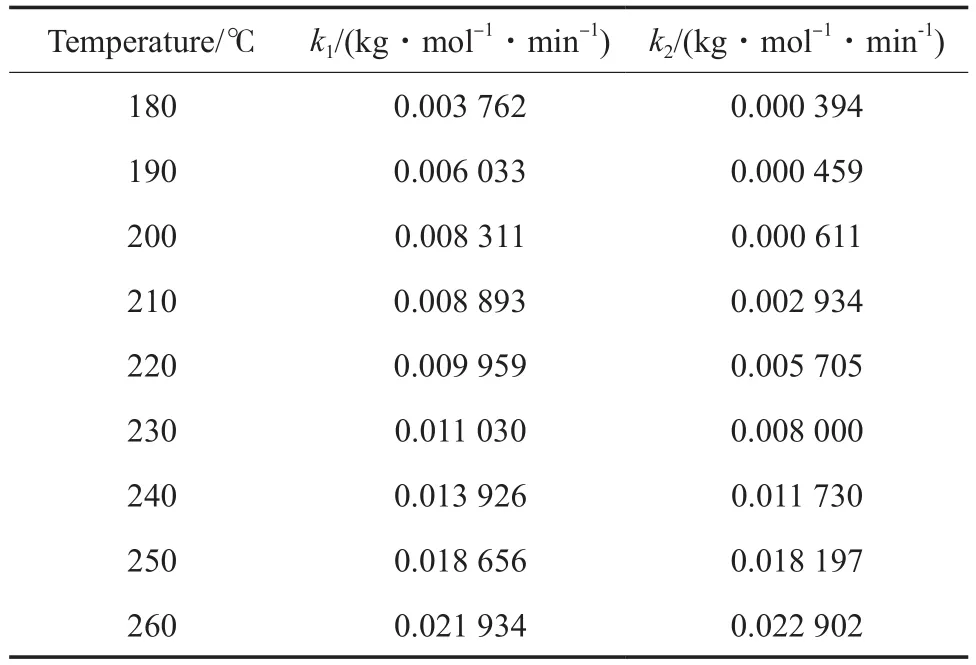
表1 不同反应温度下的k1和自缩聚反应速率常数(k2)Table 1 Rate constant of small molecule condensation reaction(k1)and self-polycondensing reaction(k2) at different temperatures
按照AB型自缩聚的统计理论[12],反应动力学方程可表示为式(9),将其积分得到式(10)。

考虑到生成高分子量聚合物的自缩聚主要发生在反应后期,以较长反应时间下的(1/(1-P)-1)对反应时间做图,结果见图3。由图3可看出,所有直线的R2均大于0.980,由直线的斜率求得不同温度下的k2(见表1)。由Arrhenius方程计算得到该聚合反应的活化能为115.0 kJ/mol,指前因子为5.73×109kg/(mol·min)。聚合反应活化能与文献报道值 95 kJ/mol[13],123 kJ/mol[7],134 kJ/mol[8]的平均值接近。

图3 不同温度下1/(1-P)-1与反应时间的关系Fig.3 Relationship between 1/(1-P)-1 and reaction time at different temperatures.
从图3还可以看出,180,190,200 ℃下的1/(1-P)-1接近0,说明低温下自缩聚反应程度P较低,所以PPS聚合反应温度一般高于200 ℃较好,这一结论与文献[14]中实验结果一致。另外,小分子缩合反应的活化能明显小于自缩聚反应活化能,这也表明低温时小分子缩合反应相对容易发生。
2.3 PPS反应过程放热强度分析
为确定两个反应单体的缩合反应热,利用Benson基团贡献法[15]计算PPS理想气体(假想态)的标准摩尔生成焓、标准熵及不同温度下的摩尔恒压热容,并根据Joback法和Watson公式[16]求出汽化热和熔化热,进而求得缩合产物生成焓;其他物质的热力学数据取自文献[17]。具体数据见表2。估算得到的不同温度下小分子缩合标准摩尔反应焓见表3。由表3可知,180~260℃范围标准摩尔反应焓平均值(ΔH—)为-549.6 kJ/mol,是典型的放热反应。
由于缩聚反应热一般较小,为10~25 kJ/mol[18],因此反应以小分子缩合反应为主,对单位时间、单位重量物料放热量进行了计算,见式(11)。

式中,Q/W为放热强度,kJ/(kg·min);为小分子缩合反应速率,mol/(kg·min)。
不同温度下,Q/W随反应时间的变化曲线见图4。
表2 各组分的恒压摩尔热容(Cp m)与标准摩尔生成焓(Δf)Table 2 Cp m and Δf of each component
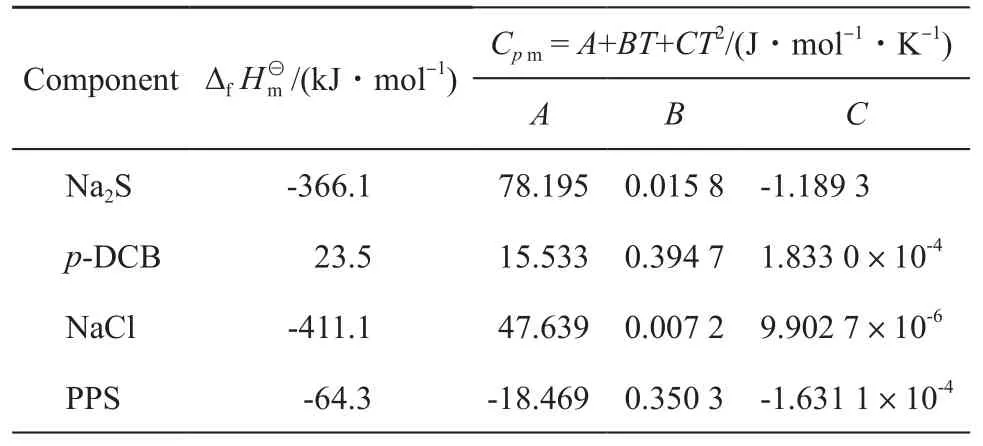
表2 各组分的恒压摩尔热容(Cp m)与标准摩尔生成焓(Δf)Table 2 Cp m and Δf of each component
Cp m:constant pressure molar heat capacity;T:temperature;A,B,C:model parameters;p-DCB:p-dichlorobenzene;PPS:polyphenylene sulfide;Δf Hm:standard molar enthalpy of formation.
Cp m = A+BT+CT2/(J·mol-1·K-1)A B C Na2S -366.1 78.195 0.015 8 -1.189 3 p-DCB 23.5 15.533 0.394 7 1.833 0×10-4 NaCl -411.1 47.639 0.007 2 9.902 7×10-6 PPS -64.3 -18.469 0.350 3 -1.631 1×10-4 ComponentΔf Hm /(kJ·mol-1)
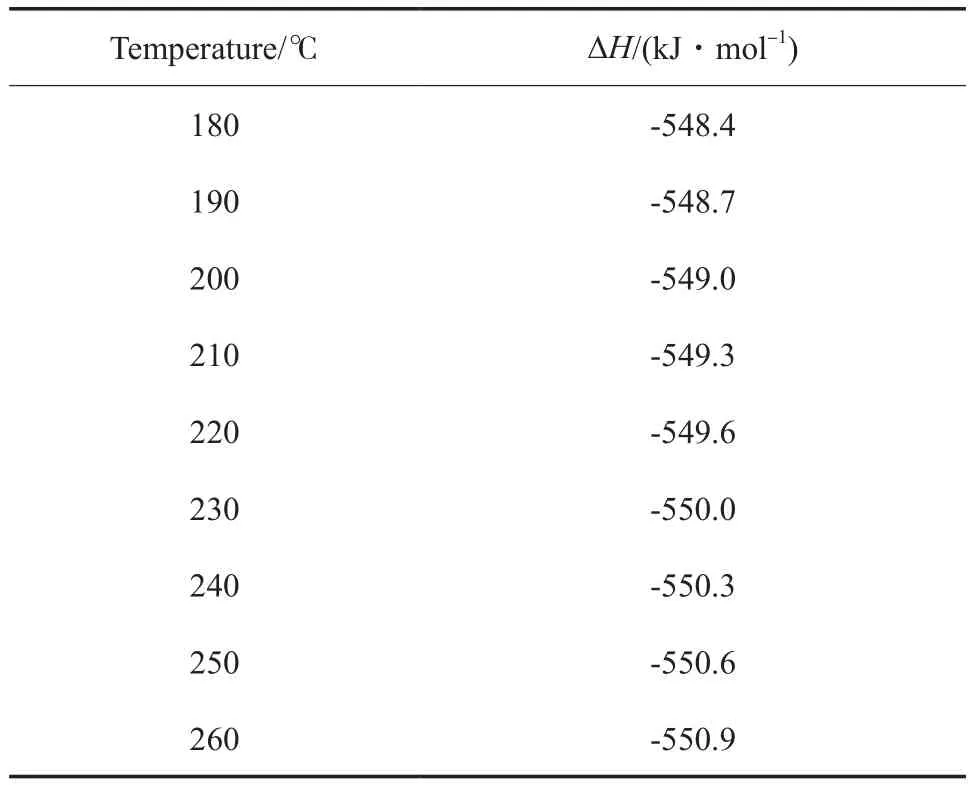
表3 不同温度下小分子缩合反应的标准摩尔反应焓Table 3 Standard molar reaction enthalpy(ΔH) of small molecule condensation at different temperatures

图4 不同温度下Q/W与反应时间的关系Fig.4 Heat release intensity(Q/W ) change with reaction time at different temperatures.
从图4可看出,在反应前期,主要集中在1 h之内,放热强度大;反应2 h之后放热强度明显减弱。特别当反应温度升高时,小分子缩合反应速率快,反应前期放热强度很大,如果移热不及时容易造成反应体系温度的飙升,因此间歇生产过程前期反应温度最好控制在200 ℃以下,当小分子缩合反应达到一定程度后,体系温度再逐渐升高将会有利于反应热移出和过程温度控制。
图5为一个逐步升温间歇反应过程的放热强度随时间的变化曲线。从图5可看出,先 在190 ℃下反应1 h,然后温度升至220 ℃,反应3 h,最后升高温度至260 ℃,反应3 h,单体转化率和自缩聚反应程度分别达到95.2%和91.8%,且整个过程放热强度相对较平稳。

图5 间歇过程Q/W,x,P与反应时间的关系Fig.5 Q/W,x ,P change with reaction time in the batch production process with step temperature rising.
3 结论
1)PPS合成反应可表示为A2B2型小分子缩合反应和AB型自缩聚反应的串联,Na2S单体转化率代表了小分子缩合反应程度,氯化钠生成率代表小分子缩合反应和自缩聚反应的综合反应程度;260 ℃下反应5 h单体转化率和自缩聚反应程度可达90%以上。
2)小分子缩合反应符合二级反应动力学规律,反应活化能为39.2 kJ/mol;基于AB型自缩聚的统计理论建立了自缩聚反应动力学,反应活化能为115.0 kJ/mol;低温下PPS合成反应以小分子缩合反应为主。
3)采用基团贡献法估算得到单体小分子缩合反应标准摩尔反应焓平均值为-549.6 kJ/mol,为典型放热反应,由于高温下反应前期放热强度大,间歇工业生产过程采用逐步升温的操作方式有利于体系反应热的平稳移出。

