17β-雌二醇对N-甲基-N-亚硝脲诱导大鼠视网膜损伤的保护效应
朱春晖,朱若晨,熊业城,陈 涛,俞小瑞,4*
(1西安交通大学医学部基础医学院生物化学与分子生物学系,西安 710061;2陕西省牙颌疾病临床研究中心;3西安交通大学口腔医院牙周科;4西安交通大学医学部环境与基因相关疾病教育部重点实验室;*通讯作者,E-mail:xiaoruiy@xjtu.edu.cn)
神经退行性疾病是一类严重危害人类健康和影响生活质量的疾病,临床常见疾病包括:阿尔茨海默症、视网膜色素变性和老年性黄斑变性等。神经退行性疾病共同表现为非典型性蛋白的合成障碍、线粒体功能紊乱以及细胞凋亡的出现[1]。视网膜是由胚胎时期神经外胚叶构成的视杯发育分化而来,与大脑的起源相同。作为中枢神经系统的外延,视网膜也被称为外周脑,因此视网膜也可作为研究中枢神经系统疾病机制与治疗的重要突破口[2]。
近年来,越来越多的研究发现,雌激素在人体中具有抑制神经细胞凋亡,发挥神经保护作用的重要功能[3]。绝经妇女的雌激素水平降低,神经退行性疾病的发病率明显增高[4]。雌激素替代疗法已经成为防治该类疾病的有效手段[5]。当前,有关雌激素在中枢神经系统中的作用在神经科学领域备受关注[6]。17β-雌二醇(17β-estradiol,βE2)是体内最丰富、最有效的雌激素,本课题组前期在过氧化氢诱导的细胞和光损伤诱导的动物两个水平,都观察到βE2对大鼠视网膜感光细胞的神经保护作用[7,8]。N-甲基-N-亚硝脲(N-methyl-N-nitrosourea,MNU)是理想的诱导视网膜退行性变的化学诱导剂,可特异性诱导视网膜感光细胞的凋亡[9]。然而,βE2对MNU诱导的视网膜感光细胞凋亡的保护作用值得我们进一步探讨。因此,本研究建立MNU诱导SD大鼠视网膜变性模型,探索βE2对感光细胞凋亡和氧化损伤的影响,为βE2在视网膜退行性疾病的临床治疗提供实验参考和理论依据。
1 材料和方法
1.1 实验动物分组及处理
取35日龄雌性SPF级SD大鼠72只,体质量(150±10)g,由西安交通大学医学部动物实验中心提供,许可证号:SCXK(陕)2007-001。24只35日龄SD雌性大鼠随机分为对照(control)和MNU组(每组12只)。为进一步观察βE2对MNU诱导大鼠视网膜损伤的保护作用,大鼠随机分为生理盐水(saline)-MNU组和βE2-MNU组(每组12只)。上述4组大鼠给药后1 d各取6只利用TUNEL检测视网膜凋亡细胞,给药后7 d另取6只大鼠利用苏木精-伊红(HE)染色和视网膜电图(ERG)检测视网膜形态和功能。最后,为了揭示βE2对视网膜的保护作用和抗氧化的关系,大鼠随机分为saline组,βE2组,saline-MNU组和βE2-MNU组(每组6只),各组药物处理后1 d使用试剂盒检测视网膜组织丙二醛(MDA)含量、抑制羟自由基能力及总抗氧化能力(T-AOC)。所有大鼠行卵巢摘除术后2周进行如下处理:MNU组经腹腔注射45 mg/kg MNU[9];saline组和βE2组分别经玻璃体腔注射4 μl saline或βE2(100 μmol/L);saline-MNU组经腹腔注射45 mg/kg MNU后立即经玻璃体腔注射4 μl生理盐水;βE2-MNU组经腹腔注射45 mg/kg MNU后立即经玻璃体腔注射4 μl浓度为100 μmol/L的βE2;未做处理的同天数大鼠设置为control。
1.2 实验试剂
盐酸塞拉嗪(吉林方正公司);TUNEL试剂盒(武汉博士德公司);水合氯醛、酒精、二甲苯、苏木素、伊红(西安试剂厂);βE2、MNU、多聚甲醛(美国,Sigma公司);复方托吡卡胺滴眼液、盐酸奥布卡因(日本,参天制药有限公司);BCA蛋白定量试剂盒、A018羟自由基测定试剂盒、A003-1丙二醛测定试剂盒、A015-1总抗氧化能力测定试剂盒(南京建成科技有限公司)。
1.3 TUNEL技术检测视网膜组织细胞凋亡
大鼠药物处理后1 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,取眼球后颈椎脱臼处死。眼球置于4%多聚甲醛中过夜,后经酒精梯度脱水,石蜡包埋。使用组织切片机获得5 μm厚组织切片,贴片于多聚赖氨酸修饰的载玻片,65 ℃烘箱烤干。参照TUNEL试剂盒说明书,染色前将视网膜组织切片置于60 ℃烘箱中20 min,随后经二甲苯透明和酒精脱蜡。PBS漂洗后滴加20 μg/ml蛋白酶K,37 ℃作用10 min,随后加入含有3%过氧化氢的甲醇封闭液室温作用10 min。TdT酶反应液作用于组织切片,室温避光37 ℃反应60 min后加入适量Steptativedin-HRP工作液,室温避光37 ℃反应60 min。随后使用DAB显色,镜下观察,出现理想深度的显色时,立即使用PBS漂洗3次,苏木素复染。2%盐酸分色,伊红染数秒钟。酒精脱水,石碳酸速过,二甲苯透明后树脂封片,充分干燥后镜下观察TUNEL阳性的凋亡细胞被染色为深棕色。
1.4 视网膜组织匀浆的制备及蛋白浓度测定
大鼠药物处理后1 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,用镊子将大鼠眼睑撑开,突出眼球,然后用刀片将角膜横向划开,取出的视网膜组织放入高压处理过的EP管中,迅速将EP管放入液氮中,大鼠随后经颈椎脱臼处死。待所有视网膜组织取材完毕后,秤重,加入预冷的9倍体积生理盐水,将组织充分剪碎,研磨,制备10%组织匀浆。随后,4 ℃离心机离心,3 000 r/min,离心10 min,吸取上清,进一步使用BCA蛋白定量试剂盒检测视网膜中蛋白含量,为后续检测视网膜组织匀浆中MDA、抑制羟自由基能力及T-AOC做准备。
1.5 MDA的测定
大鼠药物处理后1 d,取组织匀浆,按照MDA试剂盒说明书进行试剂配制和检测,分光光度仪于532 nm处测定各管OD值,使用说明书提供的公式计算样品中MDA含量:MDA(nmol/mg)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准管浓度÷蛋白含量(mg/ml)。其中,标准管浓度为10 nmol/ml。
1.6 抑制羟自由基能力检测
大鼠药物处理后1 d,取组织匀浆,按照羟自由基试剂盒说明书进行试剂配制和检测,分光光度仪于532 nm处测定各管OD值,利用说明书提供的公式计算组织抑制羟自由基的能力:抑制羟自由基能力(U/ml)=(对照管OD值-测定管OD值)/(标准管OD值-空白管OD值)×标准管浓度÷蛋白含量(mg/ml)。其中,标准管浓度为8.824 mmol/L。
1.7 T-AOC的测定
大鼠药物处理后1 d,取组织匀浆,按照T-AOC试剂盒说明书进行试剂配制和检测,分光光度仪于520 nm处测定各管OD值,并利用说明书提供的公式计算组织中T-AOC:T-AOC(U/mg)=(测定管OD值-对照管OD值)×(反应液总体积/取样量)÷0.3÷蛋白含量(mg/ml)。
1.8 视网膜电图(electroretinogram,ERG)检测视网膜功能
大鼠单次给药后7 d,大鼠暗适应24 h后,将30 μl盐酸塞拉嗪溶于10%水合氯醛中,配成大鼠ERG专用麻醉剂,按照3.5 ml/kg的剂量麻醉大鼠,并用复方托吡卡胺滴眼液散瞳。待大鼠进入深麻醉状态时,在其眼球表面滴加盐酸奥布卡因滴眼液,表面麻醉。大鼠平趴于动物平台上,左侧颊部插入参考电极,尾部皮下插入接地电极,记录电极放置于左眼角膜中央,力度以刚刚接触角膜为宜。在角膜和电极间滴加一滴生理盐水,调节双眼阻抗系数稳定小于3%。所有以上操作在微弱红光下进行,测试时使用强度为0.011 cd*s/m2的单次白色闪光刺激大鼠,闪光刺激间隔1 min,按顺序记录视杆细胞反应(Rod-ERG)和最大混合反应(Max-ERG)。
1.9 苏木素伊红染色(hematoxylin and eosin staining,HE)观察视网膜组织结构
大鼠单次给药后7 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,取眼球后颈椎脱臼处死。眼球置于4%多聚甲醛中过夜,后经酒精梯度脱水,石蜡包埋,使用组织切片机获得5 μm厚组织切片,65 ℃烘箱烤干。将载有组织切片的载玻片放入二甲苯脱蜡,随后置于不同梯度酒精进行复性,苏木素、伊红染色,树脂封片进行HE染色,镜下观察视网膜组织结构。
1.10 统计学分析

2 结果
2.1 MNU诱导SD大鼠感光细胞的凋亡
本研究首先使用TUNEL、HE和ERG技术检测腹腔注射45 mg/kg MNU对大鼠视网膜感光细胞凋亡、视网膜结构和功能的影响。TUNEL结果显示,与control组相比,MNU组视网膜外核层(outer nuclear layer,ONL)出现了大量的凋亡细胞(棕色细胞);HE结果显示,MNU组大鼠视网膜的ONL和内核层(inner nuclear layer,INL)与control组相比均出现了细胞数量的减少,视网膜组织结构紊乱,色素上皮细胞迁移至原本ONL的位置;ERG结果显示,control组Rod-ERG(a波均值74.56±12.77,b波均值189.96±18.8),Max-ERG(a波均值78.37±16.54,b波均值174.00±15.37),而MNU组出现了熄灭型电生理的表现,检测不出来Rod-ERG和Max-ERG的值(见图1)。本实验使用MNU在SD大鼠中成功构建了感光细胞凋亡模型,为后续实验提供模型基础。
2.2 βE2保护大鼠视网膜免受MNU诱导的损伤
为了观察βE2是否对MNU诱导大鼠视网膜损伤具有保护作用,本研究继续使用TUNEL、HE和ERG检测进行评估。TUNEL结果显示,与saline-MNU组相比,βE2-MNU组大鼠视网膜ONL中的凋亡细胞数明显减少(棕色细胞);HE染色结果显示saline-MNU组ONL、INL发生融合,而βE2-MNU组虽然ONL的结构发生了一定紊乱,但是结构基本完整,ONL、INL的界限还依稀可见;ERG结果显示,βE2-MNU组与saline-MNU组相比,Rod-ERG和Max-ERG反应a、b波均有明显的恢复(见图2)。

ONL:外核层;INL:内核层;GCL:神经节细胞层;Rod-ERG:视杆细胞反应视网膜电图;Max-ERG:最大混合反应视网膜电图图2 βE2抑制视网膜细胞凋亡、保护视网膜结构与功能Figure 2 βE2 inhibits retinal cell apoptosis, and protects retinal structure and its function
2.3 βE2抵抗视网膜的氧化损伤
为了进一步揭示βE2对视网膜的保护作用是否和抗氧化有关,我们在各组药物处理后1 d检测了MDA、抑制羟自由基能力和T-AOC。各组大鼠药物处理后1 d,与saline组相比,saline-MNU组视网膜组织内MDA的含量显著增加,差异有统计学意义(P<0.05);与saline-MNU组相比,βE2-MNU组玻璃体腔注射βE2后视网膜中的MDA含量明显降低,差异有统计学意义(P<0.05,见图3)。
各组大鼠药物处理后1 d,与saline组相比,saline-MNU组视网膜组织抑制羟自由基的能力显著减弱,差异有统计学意义(P<0.05)。与saline-MNU组相比,βE2-MNU组视网膜组织抑制羟自由基的能力显著增强,差异有统计学意义(P<0.05,见图4)。
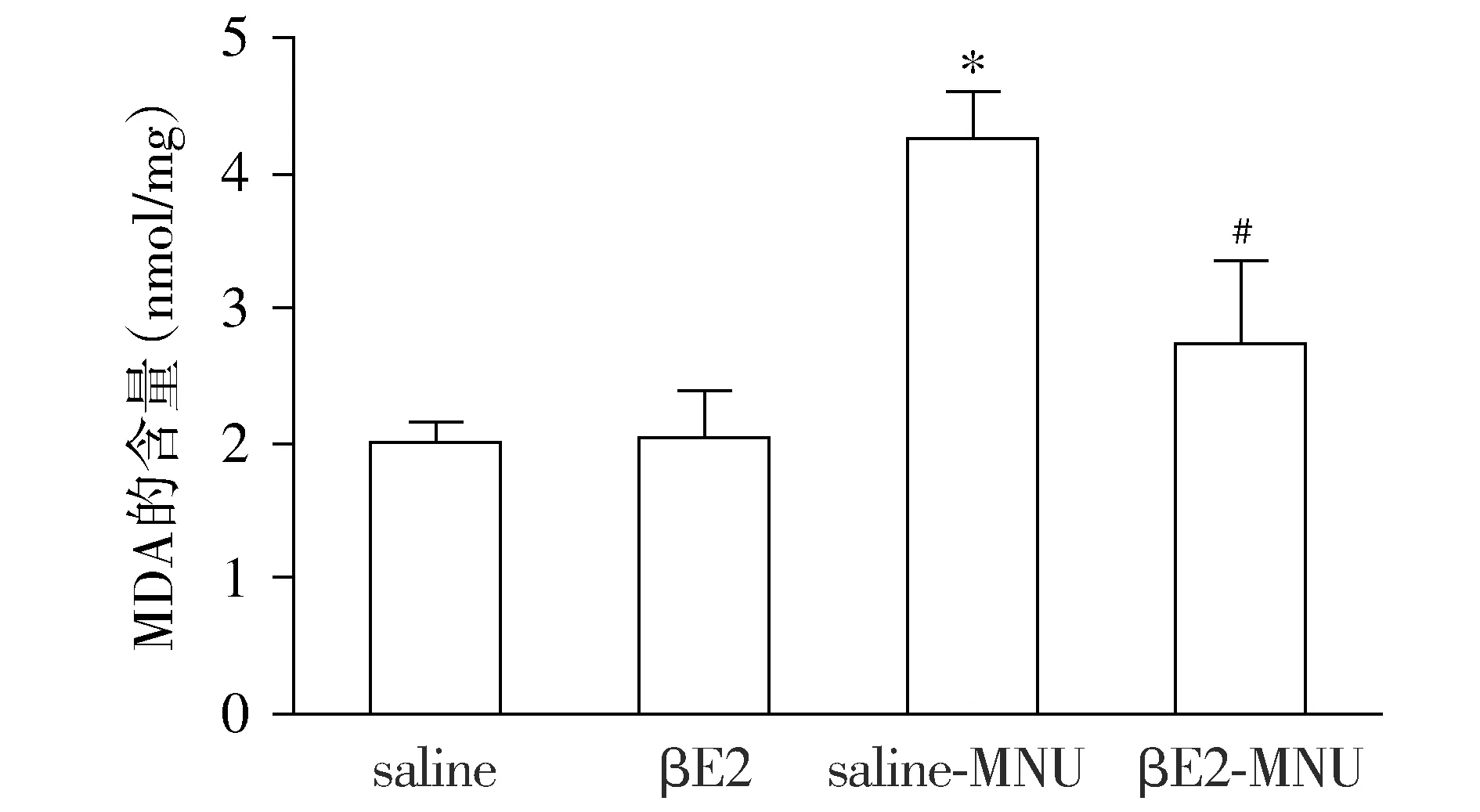
与saline组相比,*P<0.05;与saline-MNU组相比,#P<0.05图3 大鼠处理后1 d βE2减少视网膜组织中MDA的含量Figure 3 Inhibitory effect of βE2 on MDA content in the retinal tissue at day 1 after treatment

与saline组相比,*P<0.05;与saline-MNU组相比,#P<0.05图4 大鼠药物处理后1 d βE2增强视网膜组织抑制羟自由基能力Figure 4 Effect of βE2 on hydroxyl radicals in the retinal tissue at day 1 after treatment
各组大鼠药物处理1天后,与saline组相比,saline-MNU组视网膜组织T-AOC的能力显著减弱,差异有统计学意义(P<0.05)。与saline-MNU组相比,βE2-MNU组视网膜组织T-AOC的能力显著增强,差异有统计学意义(P<0.05,见图5)。

与saline组相比,*P<0.05;与saline-MNU组相比,#P<0.05图5 大鼠药物处理后1 d βE2增强视网膜组织T-AOCFigure 5 Effect of βE2 on T-AOC capacity in the retinal tissue at day 1 after treatment
3 讨论
视网膜退行性疾病以细胞凋亡为主要病理特征,然而,由于人类视网膜退行性疾病病因复杂,临床缺乏有效的治疗手段,因而构建视网膜退行性疾病动物模型来研究该类疾病的致病机制,寻找有效的治疗方法,显得十分重要。MNU作为一种烷化剂,通过使感光细胞DNA甲基化引发DNA突变,最终导致感光细胞凋亡。MNU诱导的大鼠视网膜感光细胞凋亡模型,与视网膜退行性疾病特征类似,且具有一次腹腔给药、建模时间短、重复性好、经济实用、便于操作等优点[10]。在本研究中,45 mg/kg的MNU经腹腔注射SD大鼠1 d后出现视网膜感光细胞凋亡,7 d后视网膜结构紊乱、功能下调,成功构建了MNU诱导的感光细胞凋亡模型,为后续实验研究奠定良好的模型基础。
大量的研究表明雌激素具有抑制神经细胞凋亡的作用。本课题组前期在光损伤诱导的感光细胞凋亡动物模型中,观察到βE2具有抗凋亡保护视网膜感光细胞的作用[7,8]。为了探究βE2是否也能抵抗MNU诱导的视网膜感光细胞凋亡,发挥神经保护作用,我们在MNU诱导的视网膜感光细胞凋亡模型中,通过玻璃体腔注射βE2与注射saline相比,注射βE2后大鼠ERG的a、b波明显恢复,ONL细胞丢失明显改善,感光细胞的凋亡显著减少,这些结果表明βE2具有抑制MNU诱导视网膜损伤的作用。MDA的含量常常反映机体内脂质过氧化的程度,间接反映细胞损伤的程度。羟基自由基是一种破坏能力极强的氧化剂,DNA受到羟自由基的攻击后,会发生碱基的损伤、核酸断裂等严重的氧化损伤,因此选择体内抑制羟自由基能力作为检测指标。同时,机体存在多种抗氧化物质,以便清除体内ROS,阻止氧化应激的产生,因此,检测组织内T-AOC具有重要的生物学意义。为了揭示βE2是否通过抗氧化机制发挥其抑制MNU诱导视网膜损伤的作用,我们首先检测了MNU腹腔给药后视网膜组织中MDA的含量及抗羟自由基能力和T-AOC能力,发现MNU处理后视网膜组织中MDA的含量显著上升,而抑制羟自由基能力和T-AOC能力均显著下降,说明视网膜组织处于氧化应激状态。而当玻璃体腔注射βE2后可以明显逆转上述指标,表明βE2具有提高视网膜组织抗氧化能力,降低氧化应激反应,实现抵抗MNU诱导大鼠感光细胞凋亡的神经保护作用。
雌激素发挥抗氧化作用的分子机制目前认为主要有两种途径:①雌激素分子本身具有抗氧化的性质,这是由于类固醇分子的A环C3位上存在的羟基,可以直接清除机体的自由基。研究发现人工合成雌激素的同型异质体ZYC-5,虽然缺乏激活经典雌激素受体(estrogen receptor,ER)的活性,却能通过它的自由基清除功能保护皮质神经元,对抗N-甲基-D-天冬氨酸诱导的坏死及NMDA受体拮抗剂诱导的坏死和凋亡[11];②雌激素能提高神经细胞内抗氧化酶的活性,提高自由基清除速率、减少脂质过氧化物产物的堆积,从而减少细胞凋亡的发生[12]。在本研究中,βE2发挥抗氧化作用的分子机制可能也存在上述两种途径,但这还需要进一步研究证实。
βE2发挥抗凋亡神经保护作用的信号通路主要通过经典的基因组途径和非基因组途径。在经典基因组途径中,βE2与靶细胞细胞质中的ER结合,引起受体构象变化,导致二聚化,受体易位至细胞核与DNA上ER原件结合,从而定位或靠近靶基因启动子,启动下游基因表达[13]。在βE2介导的非基因组通路中,βE2与细胞膜上的受体结合,快速激活多条信号通路,调控下游蛋白,发挥抗凋亡保护神经细胞的作用[14]。βE2可同时启动基因组和非基因组机制,完成多种生理功能[15]。本研究中βE2能有效抑制MNU引起的视网膜结构和功能损伤,抑制视网膜细胞的凋亡,然而,具体通过经典或非经典途径发挥效用,还需要进一步研究。
综上所述,本研究应用MNU诱导SD大鼠视网膜感光细胞凋亡,并以此作为建立研究视网膜退行性疾病的动物模型。通过玻璃体腔注射βE2,观察βE2在MNU诱导感光细胞凋亡动物模型中的神经保护作用,初步探讨βE2保护作用的机制可能与βE2降低MDA含量,抗羟自由基能力和T-AOC的上升有关。然而,雌激素神经保护作用的分子机制尚需更深入的研究,最终为雌激素在神经退行性疾病中的临床应用提供理论依据与指导。

