碱性鞘磷脂酶抑制炎症性肠病的研究
王 旭,王凌琪,张 萍
哈尔滨医科大学大庆校区医学检验与技术学院,黑龙江 大庆 163319
碱性鞘磷脂酶(alkaline sphingomyelinase,alk-SMase)是一种肠道黏膜中表达的细胞外酶,在人肝脏中也有表达。该酶与酸性或中性鞘磷脂酶在结构上无相似之处,它属于核苷酸焦磷酸酶/磷酸二酯酶(nucleotide pyrophosphatase/phosphodiesterase,NPP)家族成员,故又被称为NPP7[1]。同其他鞘磷脂酶相比,alk-SMase活性具有组织表达特异性、胆汁盐依赖性及胰酶消化抵抗性等特性,因此,得以在肠道中一直保持稳定的活性,成为肠道中负责消化水解鞘磷脂(sphingomyelin,SM)的关键酶。近年来,随着研究的不断深入,alk-SMase不仅在水解饮食中的SM发挥功能,还可以参与肠道外源性胆固醇的吸收[2],抑制结肠肿瘤和炎症的发生、发展[3-4]。目前,已经证实了肠道alk-SMase是肠道的一个保护因子。本文概述了alk-SMase通过参与磷脂分子的代谢抵抗炎症性肠病(inflammatory bowel disease,IBD)的研究,并提出了进一步研究alk-SMase在肠道疾病中重要功能的必要性。
1 alk-SMase参与肠道内磷脂代谢
alk-SMase具有磷脂酶C的活性,可以水解肠道中包括SM、卵磷脂(phosphatidylcholine,PC)、溶血卵磷脂(lyso-phosphatidylcholine,lyso-PC)、血小板活化因子(platelet activating factor,PAF)等多种磷脂分子,切下它们的活性基团——磷酸胆碱。通过计算机同源建模研究和晶体结构研究可以看到,alk-SMase蛋白的活性中心形成一个特定的口袋和一条狭长的凹槽结构,底物分子的磷酸胆碱头基团和疏水尾部结构恰好与这个结构相吻合,其中SM的结合亲和力强于其他底物分子,因此,alk-SMase对于不同的磷脂分子的水解活性也不同[5]。
1.1 alk-SMase参与SM的代谢人体肠道内SM主要来源于饮食、脱落的肠黏膜细胞和胆汁。alk-SMase将肠道内SM水解生成神经酰胺(ceramide,Cer)和磷酸胆碱,Cer进而生成鞘氨醇(sphingosine,Sph)、鞘氨醇-1-磷酸(Sphingosine 1-phosphate,S1P),这一系列神经鞘脂类活性分子参与肠道细胞的生长、凋亡和分化。许多物种肠道中的alk-SMase在空肠中含量及活性均最高,而结肠中降低,所以SM的消化过程通常从空肠中段开始,而在结肠中消化不完全,导致粪便中仍有约40%的SM未被水解。在alk-SMase敲除小鼠中,约有90%被摄入的SM不能被消化而是累积在结肠中[6],证实了肠道中alk-SMase是负责消化SM的关键酶。人类与其他物种不同,在人胆汁中也有alk-SMase蛋白且具有活性,这些酶蛋白由肝脏合成并运输到胆囊,随胆汁排入十二指肠,因此,人类的SM消化过程从十二指肠就开始了,比其他物种对SM的消化更完全,约81%摄入的SM可以被消化。SM被更有效水解而生成Cer对于抑制结肠癌的发生非常重要[7]。
1.2 alk-SMase参与PC及lyso-PC的代谢除水解肠道中的SM,alk-SMase在肠道中还参与其他磷脂分子的水解。PC是肠道内主要的磷脂分子,研究表明,充足的PC可以竞争alk-SMase的酶活性中心从而抑制alk-SMase对SM的水解活性。然而alk-SMase对于PC的水解作用其实很弱,PC的水解主要是由胰腺分泌的磷脂酶A2来完成,当小肠上段大部分PC被水解后,小肠中alk-SMase对SM的水解作用逐渐增强[8]。因此alk-SMase对SM消化在小肠中段最强。近年来,研究发现alk-SMase还能水解PC的下游产物lyso-PC生成单酰基甘油和磷酸胆碱,从而减少了溶血磷脂酸(lysophosphatidic acid,LPA)的生成。LPA是由具有磷脂酶D活性的NPP2(又称Autotaxin,ATX)水解lyso-PC生成的[9],LPA与G蛋白偶联受体结合后,通过多种信号传导途径成为重要的信使,具有很强的致炎和致癌性[10]。在许多慢性IBD患者中,均已检测到ATX和LPA的水平升高,证实了ATX表达和LPA信号在慢性炎症疾病发病机制中的作用[9],而alk-SMase与ATX竞争底物lyso-PC,从而减少其产物LPA的生成,在一定程度上抑制了炎症的反应进程。
1.3 alk-SMase灭活PAF血小板活化因子(platelet activating factor,PAF)是alk-SMase的又一个底物分子,alk-SMase的磷脂酶C活性能将PAF分子的磷酸胆碱基团切割下来而使PAF失活。PAF是由炎症细胞、血小板和内皮细胞释放的内源性活性磷脂,参与调节免疫应答。研究表明,PAF是一个有效的促炎介质,通过与G蛋白偶联受体——PAF受体(PAFR)结合触发一系列的细胞内信号级联反应,参与血管生成、血栓形成、癌变和转移,在溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)等慢性IBD的结肠黏膜,PAF/PAFR在肠道上皮细胞的表达上调[11],但其促炎作用的分子机制尚不完全清楚。然而,一些饮食中的PAF抑制剂,已被发现可以抑制PAF的生理活动,从而防止肠道炎症和癌症的发生[12]。
2 磷脂代谢在IBD中的重要作用
IBD是一种常见的消化道疾病,包括CD和UC,其病理过程是通过介导白细胞浸润和大量促炎性细胞因子生成导致的肠道损伤过程。SM和其他磷脂参与控制细胞活动和促炎细胞因子的释放过程,在调节各种免疫细胞功能和各种炎症反应中具有重要的免疫功能。
2.1 alk-SMase水解产物Cer在IBD中的研究Cer作为细胞信号传导的第二信使被生物学多个领域广泛关注。Cer是一种具有生物活性的鞘脂类物质,支持细胞膜的结构,介导真核细胞中大量的细胞信号传导事件。Cer诱导了MAPK的激活,激活免疫细胞和触发细胞凋亡,促进IBD的炎症反应进程[13]。通过神经酰胺合成酶(CerS)研究结肠炎模型时,CerS2基因敲除(knock out,KO)小鼠基因表达缺失造成肠黏膜上皮连接黏附分子A和紧密连接蛋白ZO-1的表达下降,导致不稳定的肠上皮屏障导致肠道通透性增加,提示CerS2对结肠炎有保护作用[14]。而CerS6在结肠炎中具有相同的作用,CerS6丢失会加剧炎症[15]。因此,还需要进一步的研究来阐明Cer在结肠炎中的作用。
2.2 alk-SMase水解产物S1P在IBD中的研究鞘脂类信号分子S1P是一种促炎性的鞘脂分子,通过激活G蛋白偶联受体家族,即鞘磷脂-1-磷酸受体(S1PRs),参与多种细胞过程的调节。S1P/S1PR1轴被认为是淋巴细胞从淋巴结迁移的关键调节因子。通过阻断S1P与 S1PR的相互作用,可以有效减轻不同模型结肠炎的严重程度和病理改变。使用S1PR1拮抗剂也可以阻止淋巴细胞进入炎症组织,降低结肠炎症反应。因此,阻断S1P/S1PRs轴是控制IBD中异常白细胞向黏膜迁移的一种新的治疗方法。目前,研究人员应用S1P受体的调节剂对IBD治疗的临床试验正在进行[16]。另一方面,催化S1P生成的鞘氨醇激酶(SK)在UC患者的黏膜表达升高,研究人员通过抑制SK1而减少S1P生成,可降低结肠炎COX-2表达和中性粒细胞浸润[17-18]。因此,进一步研究IBD中S1P生物合成、转化率和受体信号的动态变化具有重要的生物学和临床意义。
2.3 脂质组学分析alk-SMase代谢相关磷脂分子在IBD中的研究IBD肠道黏膜的脂质组学分析显示,细胞膜中类固醇、磷脂等活性脂质分子的组成、分布和代谢与肠道炎症发生、发展密切相关,这些黏膜细胞中的促炎和抗炎活性磷脂类分子的失衡分布是IBD的重要特征[19]。在诱导IBD实验中,肠道黏膜的脂质组学分析已证实脂类分子Cer、SM和PC的含量发生显著变化。另外,最新研究在UC患者结肠组织26种脂质分子的分析中,其中鞘脂类分子在肠道黏膜中的变化最为显著,并且Cer的水平随着IBD的严重程度逐步升高[20]。炎症因子IL-1刺激Cer在肠上皮细胞中的积累,而Cer能通过激活免疫细胞和触发细胞凋亡,促进IBD炎症反应的进程。此外,PC在炎症过程中被磷脂酶A2水解,多不饱和脂肪酸被释放出来,代谢后生成促炎和抗炎的生物活性调节分子失衡,引发IBD的病理过程[21]。因此,肠道黏膜脂质分布是IBD中免疫功能和炎症反应的另一个关键因素。
3 alk-SMase在IBD中的研究进展
alk-SMase最初被人们认知只是其消化肠道中的SM的功能,近30年来,SM被水解生成Cer等一系列鞘脂类活性分子,在结肠肿瘤的研究中引起人们对alk-SMase的重视。随着Duan课题组对alk-SMase的深入研究,发现该酶在细胞增殖、结肠感染、胆管疾病、胆固醇吸收等诸多方面均存在潜在功能。
3.1 alk-SMase在IBD中的活性变化众所周知,慢性的结肠炎症会导致结肠肿瘤的发生和发展。最初,Hertervig等[22]在人散发性结肠腺瘤、结直肠癌、家族性腺瘤性息肉等患者组织的活检标本中发现alk-SMase活性较邻近组织或正常组织活性显著下降,且随着疾病的严重程度从腺瘤到腺癌呈渐进性降低的趋势。在结直肠癌患者的粪便活检样本中,与正常个体相比alk-SMase活性也显著降低。结肠癌患者结肠黏膜alk-SMase活性降低70%~90%。后续研究又对慢性结肠炎患者进行了alk-SMase活性检测,发现与正常人相比其活性显著下降25%。这些研究结果均提示了alk-SMase在IBD中的重要作用[1]。
3.2 alk-SMase在IBD中的功能研究Andersson等[23]研究了alk-SMase对大鼠结肠炎的作用,实验中用酵母菌表达的重组alk-SMase蛋白治疗DSS诱导的大鼠结肠炎模型,可显著降低炎症评分,在一定程度上保护了结肠上皮的炎症反应进程。动物实验中,益生菌、高膳食纤维饮食和高SM饮食均能通过提高alk-SMase的活性和表达抑制结肠肿瘤和炎症的发生。这些研究均显示了该酶在治疗结肠肿瘤和IBD中的潜在应用价值。KO小鼠证实了alk-SMase活性及表达缺失后,小肠和结肠Cer水平下降,S1P水平升高。在DSS/AOM诱导的结肠炎相关的结肠肿瘤模型中,alk-SMase KO小鼠的结肠肿瘤发生率增加了4.5倍,肿瘤大小增加了1.8倍,粪便中PAF水平明显升高[24]。在DSS诱导的结肠炎模型中,alk-SMase KO小鼠的疾病活动指数显著增加,炎性细胞浸润及上皮损伤程度均更为严重,炎症反应较野生型小鼠更加剧烈[3]。这些研究直接证实了alk-SMase的抗癌特性与其抗炎作用。
3.3 alk-SMase抗IBD的机制研究关于alk-SMase的抗IBD机制研究尚不明确。我们利用alk-SMase KO小鼠进行DSS诱导结肠炎模型的研究中,alk-SMase缺失的KO小鼠炎症反应更加剧烈,肠道黏膜中LPA随诱炎的时间呈大幅度的递增趋势。LPA这一变化与KO小鼠小肠和结肠中ATX表达增加相一致,证明alk-SMase可以通过竞争底物lyso-PC生成LPA的作用来调节ATX的表达,从而减少LPA对肠道炎症的促进作用。另外,PAF也在诱导炎症后4 d显著增加[3]。Duan课题组的研究表明,alk-SMase从PAF切割磷酸胆碱部分,并抑制PAF诱导的MAPK活化及细胞因子从结肠癌细胞释放,阻断了细胞的趋化性[1]。KO小鼠在DSS诱导炎症早期PAF增加提示PAF可能是炎症反应的触发因素。以上研究证实,alk-SMase抗炎作用是通过水解lyso-PC减少LPA形成及灭活PAF的途径实现的,其他机制还需进一步调查。
4 展望
近年来,alk-SMase逐渐引起了广泛关注。本文阐述了肠道中该酶通过水解SM、PAF、lyso-PC等磷脂分子,生成抗凋亡分子Cer、降低促炎因子SIP、PAF和LPA等途径参与抑制IBD的发生、发展过程(见图1)。我们认为,alk-SMase的磷脂酶C活性是其灭活磷脂分子的关键所在,它和磷脂酶D水解作用的区别就在于是否将磷酸基团留在底物磷脂分子上,这也决定了其水解产物是否具有促炎活性,从而引发或加重炎症的进程。前期的很多研究为alk-SMase在结肠中的抗癌和抗炎作用提供有力证据,但其机制探讨还不够深入,alk-SMase的表达及活性受到哪些因子的调控,与其他磷脂酶活性如何被调节直接决定了肠道内磷脂分子的代谢。同时,在阐明的几条信号传导途径间是否形成复杂的交叉通讯也是我们需要进一步探讨的方向。
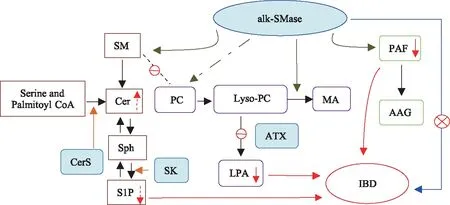
图1 alk-SMase通过参与磷脂分子代谢抑制IBD概况Fig 1 alK-SMase inhibits IBD by participating in phospholipid molecular metabolism
另外研究已被证实饮食中的鞘脂类分子通过抑制肠道脂质吸收、改变来影响炎症相关的慢性疾病肠道菌群,激活抗炎核受体,中和反应炎症刺激对肠道的作用[25],那么alk-SMase是否影响免疫感受细胞和肠道细菌的功能,也值得我们关注。
综上所述,alk-SMase在肠道中的保护功能是可以肯定的,进一步探讨其在肠道中的潜在功能及其机制十分必要。那么,alk-SMase在结肠肿瘤和炎症中的活性下降,提示我们是否可以将结肠黏膜或粪便中alk-SMase的活性作为诊断、预后和常规筛查的生物学标志物。另一方面,是否可以将其作为慢性UC和结肠癌的化学预防和化疗药物治疗的靶点。随着人们对alk-SMase生物学效应认识的提高,其在肠道和其他系统中的重要作用必将会被逐一发掘。

