不同浓度米诺环素对人胶质瘤细胞增殖、自噬、凋亡的影响及其机制
韩利民,严婉约,李巧巧,李科,刘丽,赵海龙△
脑胶质瘤是最常见的颅内原发性肿瘤,在我国发病率约为3.2/10 万,约占中枢神经系统原发性肿瘤的24.7%[1]。目前胶质瘤的标准治疗方案主要是以手术切除为主,同步进行放化疗等综合治疗,但效果有限,患者的总生存期未明显延长[2]。米诺环素是第二代四环素类抗生素,它能与转运RNA(tRNA)结合从而达到抑菌效果。近年来研究发现米诺环素除了自身抗炎作用外,还有干扰肿瘤微环境[3]、心脏保护[4]、神经保护[5]等作用,并能通过提高自噬、抑制细胞外基质降解蛋白酶等途径抑制胶质瘤的生长[6-7]。本课题组前期研究证实高浓度米诺环素(50~200 μmol/L)能诱导胶质瘤细胞自噬和凋亡[8],但对于此过程中自噬和凋亡发生的具体机制尚不清楚。为验证较低浓度的米诺环素是否具有同样作用,本研究分别采用5和10 μmol/L的米诺环素处理人胶质瘤细胞U87 和LN229,并进一步探究其具体作用机制。
1 材料与方法
1.1 主要材料 米诺环素购自MCE 公司。DMEM/F12 培养基、胎牛血清购自Gibco 公司;台盼蓝染色液、MTT 染色液购自碧云天生物技术公司;SYBR 荧光定量试剂盒购自Invitrogen公司;RNA提取和逆转录试剂盒购自Premega公司;Lipofectamine 2000转染试剂盒购自Thermo公司。兔源沉默信息调节因子2相关酶1(SIRT1)抗体、哺乳动物雷帕霉素靶蛋白(mTOR)抗体、B 淋巴细胞瘤-2(Bcl-2)抗体、剪切活化后的含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved-Caspase-3)抗体、磷酸化p70 核糖体蛋白S6 激酶(苏氨酸389 位点)[phospho-p70 S6 Kinase,p-p70s6k(Thr389)]抗体、p70 核糖体蛋白S6 激酶(p70s6k)抗体、自噬基因相关蛋白5(Atg5)抗体、微管相关蛋白l 轻链3B 亚基(LC3B)抗体、信号传导及转录激活蛋白3(STAT3)抗体均购自英国Abcam 公司,磷酸化AMP 依赖的蛋白激酶α亚基(苏氨酸172位点)[phospho-adenosine 5-monophosphate-activated protein kinase-alpha,p-AMPKα(Thr172)]抗体、AMP 依赖的蛋白激酶 α 亚基(AMPKα)抗体购自Cell Signaling Technology 公司。β肌动蛋白(β-actin)抗体购自武汉三鹰生物技术有限公司。辣根过氧化物酶标记山羊抗兔二抗、山羊源抗兔荧光二抗分别购自KPL公司和Life Technologies。pLKO.1-puro质粒购自北京中源合聚生物科技有限公司,293FT由遵义医科大学生命科学研究院馈赠。
1.2 不同浓度米诺环素处理后U87 和LN229 细胞增殖和凋亡相关指标的检测
1.2.1 细胞培养及分组 U87和LN229细胞株由遵义医科大学病理生理学教研室常规保存。2种细胞培养于含10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素的DMEM/F12培养基中,置于5%CO2、37 ℃环境中常规传代培养,每1~2 d观察生长情况。细胞分组:2 种胶质瘤细胞分别按米诺环素处理浓度分为3组:对照组(米诺环素0 μmol/L,以DMSO代替),5 μmol/L米诺环素组和10 μmol/L米诺环素组。各组细胞均在接种24 h后,分别加入相应浓度米诺环素培养72 h。
1.2.2 MTT 法检测细胞增殖能力 取对数生长期的3 组细胞,胰酶消化后,按1×104个/mL 重悬细胞,200 μL/孔接种于96孔板。培养24、48和72 h后添加MTT 溶液(20 μL/孔),继续培养4 h,酶标仪读取各组细胞560 nm 处的光密度(OD)值,以观察细胞增殖能力变化。
1.2.3 免疫荧光染色检测LC3B 的表达 取对数生长期的3组细胞,在含细胞爬片的12孔板上调整细胞密度为1×105/mL。培养72 h 后依次进行固定(4%多聚甲醛)、通透(室温下0.3%TritonX 100 处理5 min)、封闭(5%BSA 处理2 h),加入一抗兔源LC3B(1∶1 000 稀释)4 ℃后过夜处理,接着加入山羊源抗兔荧光二抗(1∶5 000稀释)并在室温下孵育2 h,然后用Hoechst33342染色液进行染色,15 min后用PBS漂洗干净,最后在激光共聚焦显微镜下观察爬片。
1.2.4 Western blot 检测自噬和凋亡相关蛋白的表达 米诺环素处理72 h后收集各组细胞并提取总蛋白,BCA法测定蛋白浓度后各组以30 μg 上样量进行10%SDS-PAGE 电泳、湿转PVDF 膜,然后常温下使用5%BSA 封闭1 h,添加SIRT1、mTOR、Bcl-2、Cleaved-Caspase-3、p-p70s6k、p70s6k、Atg5、LC3B、STAT3、p-AMPKα、AMPKα、β-actin一抗(均为1∶1 000稀释)于4 ℃孵育过夜,次日TBST 震荡洗涤3 次后与辣根过氧化物酶标记山羊抗兔二抗(1∶10 000 稀释)孵育1 h,TBST洗涤3次后进行ECL化学发光显影,所有蛋白条带灰度值均使用Image J 进行对比,以β-actin作为内参蛋白。
1.3 shRNA 干扰SIRT1 表达后观察米诺环素对U87 和LN229细胞自噬相关分子表达的影响
1.3.1 SIRT1-shRNA 载体构建 在GenBank 中查找SIRT1基因的mRNA 序列(GenBank 登录号:NM_001142498.1),利用Sigma 在线软件设计2 对干扰序列(表1)。SIRT1-shRNA引物由华大公司合成,将合成的正反义Oligo DNA经过变性、退火后形成shRNA 模板,与pLKO.1-puro 质粒载体连接,最后经筛选、酶切鉴定后再经华大公司测序。

Tab.1 Sequences of SIRT1 interference表1 SIRT1干扰序列
1.3.2 慢病毒包装和转染 消化、计数293FT 细胞,并将细胞稀释在慢病毒培养基中。在6孔板中加入DNA-脂质体复合物、慢病毒培养基、293FT细胞悬液,轻轻混匀后37 ℃培养过夜。次日换液,加入慢病毒培养基2 mL继续培养48 h。将待转染的细胞(U87、LN229)用不含抗生素培养基培养,收集293FT细胞产生的病毒上清液,向待转染的细胞中加入1 mL慢病毒培养基和1 mL 病毒上清液,最后用抗性药物筛选稳定细胞株。选择SIRT1 表达干扰效果较好的稳定细胞株进行重新接种,24 h后分别加入相应浓度米诺环素培养至72 h。细胞分为4组:Control组、shSIRT1组、shSIRT1+5 μmol/L米诺环素组和 shSIRT1+10 μmol/L 米诺环素组,其中 Control 组转染靶向GFP的shRNA质粒并加入等量DMSO作为对照。
1.3.3 qPCR 检测shRNA 干扰后SIRT1的表达 分别收集分组处理72 h后的U87和LN229细胞,进行细胞裂解后根据说明书提取总RNA,逆转录为cDNA 后进行qPCR 检测。反应条件:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火延伸30 s,40个循环,同时收集荧光信号,以β-actin为内参。每组重复操作 3 次,SIRT1 和 β-actin 的 mRNA 表达量采用 2-ΔΔCt法计算,具体序列见表2。
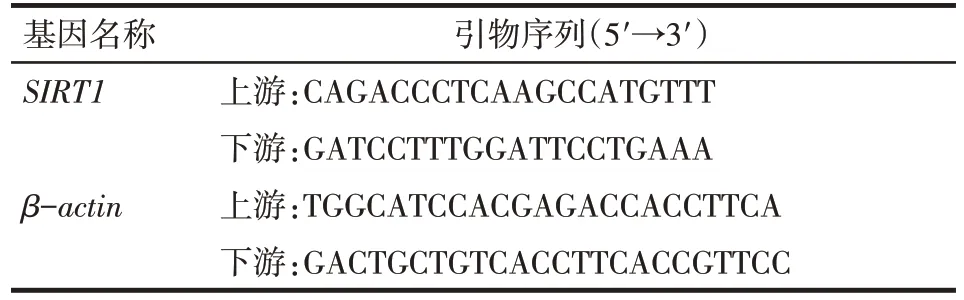
Tab.2 Sequences of the primers in qPCR表2 qPCR引物序列
1.3.4 Western blot 检测SIRT1敲低后细胞自噬相关蛋白的表达 细胞收集、蛋白提取、电泳、转膜、抗体孵育、指标分析等步骤同1.2.4。
1.4 统计学方法 采用SPSS 18.0 软件进行统计学分析,计量资料以均数±标准差()表示,多组间均数比较用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度米诺环素对胶质瘤细胞增殖能力的影响 MTT 结果显示,与对照组相比,5 μmol/L 和10 μmol/L 米诺环素处理后 U87 在 48 h 增殖水平显著下降(P<0.05),而LN229在72 h增殖水平显著下降(P<0.05),见图1。

Fig.1 Proliferation of U87 and LN229 cells treated with different concentrations of minocycline within 72 h图1 不同浓度米诺环素处理后U87和LN229细胞72 h内增殖情况
2.2 不同浓度米诺环素对U87 和LN229 细胞自噬水平的影响 免疫荧光染色结果显示,与对照组相比,5 μmol/L和10 μmol/L米诺环素组细胞自噬标记蛋白LC3B 荧光斑点比例明显增多(P<0.01),并呈剂量依赖性升高,见图2、表3。Western blot 结果显示,与对照组相比,5 μmol/L 和10 μmol/L 米诺环素组自噬抑制蛋白mTOR 明显减少,而自噬蛋白Atg5明显增加,且伴有AMPKα磷酸化水平和SIRT1表达水平显著增加(P<0.01),见图3、表4。
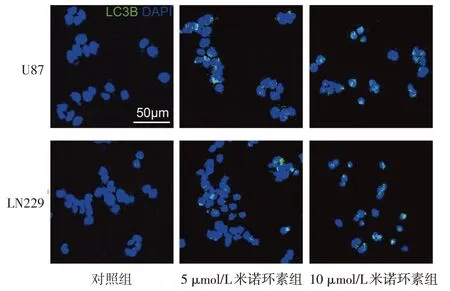
Fig.2 Immunofluorescence assayresults(LC3B)in U87 and LN229 cells treated with different concentrations of minocycline图2 不同浓度米诺环素处理后U87和LN229细胞胞浆内自噬标记蛋白LC3B显影情况
2.3 不同浓度米诺环素对U87 和LN229 细胞凋亡相关蛋白表达的影响 Western blot 结果显示,与对照组相比,5 μmol/L 米诺环素处理后仅LN229 细胞Cleaved Caspase-3 表达下降(P<0.05),其他蛋白表达未见明显变化(P>0.05),而10 μmol/L 米诺环素处理后,2 种细胞中 p-p70s6k 和 Bcl-2 表达明显减少,Cleaved Caspase-3 蛋白明显增加(P<0.05),见图4、表5。
Tab.3 Quantification of LC3B punctae in U87 and LN229 cells after treatment with different concentrations of minocycline表3 3组不同浓度米诺环素处理后的LC3B斑点数/细胞数变化 (n=3,)

Tab.3 Quantification of LC3B punctae in U87 and LN229 cells after treatment with different concentrations of minocycline表3 3组不同浓度米诺环素处理后的LC3B斑点数/细胞数变化 (n=3,)
**P<0.01;a与对照组相比,b与5 μmol/L米诺环素组相比,P<0.05
组别对照组5 μmol/L米诺环素组10 μmol/L米诺环素组F LC3B(%)U87 0.19±0.17 44.67±7.51a 71.33±5.86ab 128.173**LN229 0.83±0.76 36.00±11.00a 51.67±6.51ab 37.209**

Fig.3 Western blot results of autophagy-associated proteins in U87 and LN229 cells treated with different concentrations of minocycline图3 不同浓度米诺环素处理后U87和LN229细胞自噬相关蛋白的表达变化

Fig.4 Western blot results of apoptotic proteins in U87 and LN229 cells treated with different concentrations of minocycline图4 U87和LN229细胞在不同浓度的米诺环素处理后凋亡相关蛋白水平的变化
2.4 SIRT1敲低后米诺环素对U87和LN229细胞自噬水平的影响 本研究构建的2 种靶向SIRT1 的shRNA载体(shSIRT1-1,shSIRT1-2),通过慢病毒转染 U87 和 LN229 细胞后,经 qPCR 和 Western blot 确认shSIRT-1 的敲低效果相对较好(图5),故选取shSIRT1-1 转染的U87 和LN229 细胞进行下一步实验。SIRT1 表达敲低后,shSIRT1 组 mTOR 和 LC3B表达水平较对照组明显下降;而经过米诺环素处理后,mTOR 的表达出现明显升高,而LC3B 表达水平仅部分恢复,见图6、表6。
Tab.4 The expression levels of autophagy-associated proteins inU87 and LN229 cells after treatment with different concentrations of minocycline表4 3组不同浓度米诺环素处理后的U87和LN229细胞自噬相关蛋白水平变化 (n=3,)

Tab.4 The expression levels of autophagy-associated proteins inU87 and LN229 cells after treatment with different concentrations of minocycline表4 3组不同浓度米诺环素处理后的U87和LN229细胞自噬相关蛋白水平变化 (n=3,)
**P<0.01;a与对照组相比,b与5 μmol/L米诺环素组相比,P<0.05
组别对照组5 μmol/L米诺环素组10 μmol/L米诺环素组F U87 p-AMPKα 1.00±0.03 2.48±0.55a 2.88±0.24a 24.608**AMPKα 1.00±0.07 0.95±0.08 1.00±0.12 0.368 SIRT1 1.00±0.05 3.73±0.25a 3.46±0.19a 201.476**mTOR 1.00±0.10 0.25±0.03a 0.03±0.02ab 189.305**Atg5 1.00±0.01 4.55±0.35a 5.88±0.19ab 361.924**组别对照组5 μmol/L米诺环素组10 μmol/L米诺环素组F LN229 p-AMPKα 1.00±0.06 5.99±0.20a 3.54±0.31a 392.806**AMPKα 1.00±0.08 0.99±0.04 0.87±0.04 2.687 SIRT1 1.00±0.01 3.24±0.32a 3.20±0.22a 96.815**mTOR 1.00±0.05 0.72±0.13a 0.12±0.04ab 91.879**Atg5 1.00±0.03 1.88±0.12a 2.70±0.34ab 49.022**
Tab.5 The expression levels of apoptotic proteins in U87 and LN229 cells after treatment with minocycline表5 不同浓度米诺环素处理后的U87和LN229细胞凋亡相关蛋白水平变化 ()
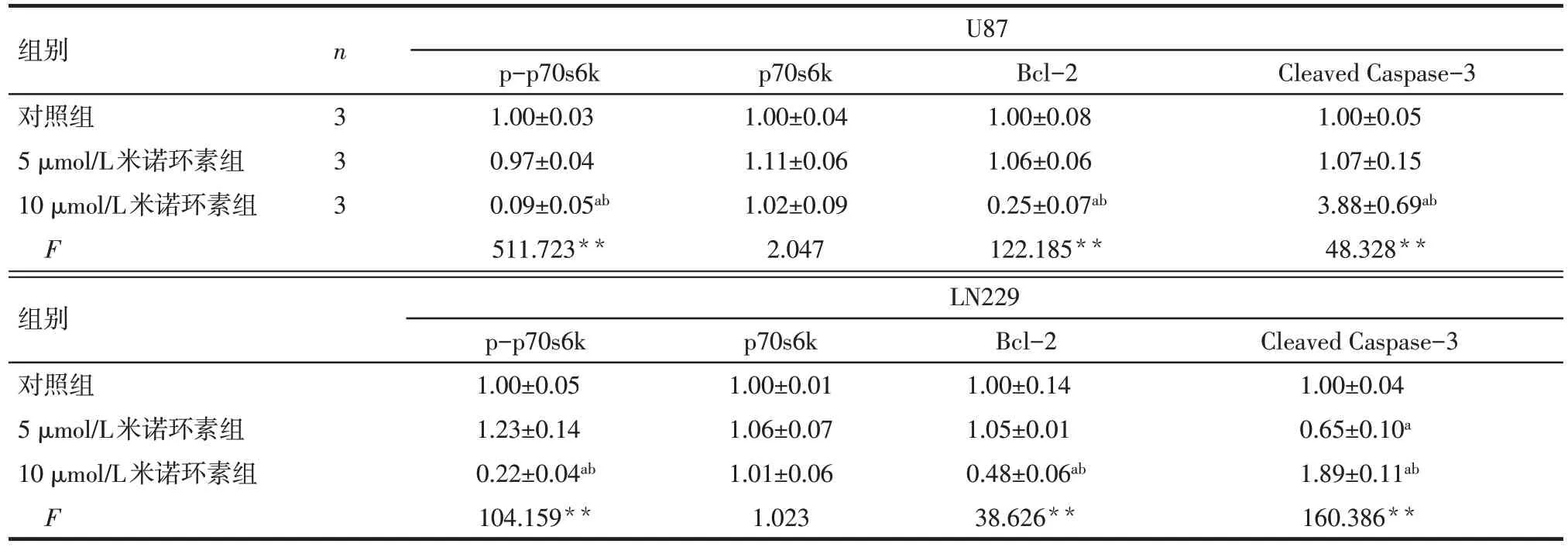
Tab.5 The expression levels of apoptotic proteins in U87 and LN229 cells after treatment with minocycline表5 不同浓度米诺环素处理后的U87和LN229细胞凋亡相关蛋白水平变化 ()
**P<0.01;a与对照组相比,b与5 μmol/L米诺环素组相比,P<0.05
组别对照组5 μmol/L米诺环素组10 μmol/L米诺环素组F n 333 U87 p-p70s6k 1.00±0.03 0.97±0.04 0.09±0.05ab 511.723**p70s6k 1.00±0.04 1.11±0.06 1.02±0.09 2.047 Bcl-2 1.00±0.08 1.06±0.06 0.25±0.07ab 122.185**Cleaved Caspase-3 1.00±0.05 1.07±0.15 3.88±0.69ab 48.328**组别对照组5 μmol/L米诺环素组10 μmol/L米诺环素组F LN229 p-p70s6k 1.00±0.05 1.23±0.14 0.22±0.04ab 104.159**p70s6k 1.00±0.01 1.06±0.07 1.01±0.06 1.023 Bcl-2 1.00±0.14 1.05±0.01 0.48±0.06ab 38.626**Cleaved Caspase-3 1.00±0.04 0.65±0.10a 1.89±0.11ab 160.386**

Fig.5 Western blot results of SIRT1 after shSIRT1-1 or shSIRT1-2 interfering with U87 and LN229 cells图5 shSIRT1-1、shSIRT1-2干扰U87和LN229细胞后SIRT1的蛋白水平变化

Fig.6 Western blot results of autophagy-associated proteins in shSIRT1 transfected U87 and LN229 cells treated with different concentrations of minocycline图6 shSIRT1转染的U87和LN229细胞在不同浓度米诺环素处理后自噬相关蛋白水平变化
Tab.6 The expression levels of autophagy-associated proteins in shSIRT1 transfected U87 and LN229 cells treated with different concentrations of minocycline表6 shSIRT1转染各组的U87和LN229细胞在不同浓度米诺环素处理后自噬相关蛋白水平变化(n=3,)

Tab.6 The expression levels of autophagy-associated proteins in shSIRT1 transfected U87 and LN229 cells treated with different concentrations of minocycline表6 shSIRT1转染各组的U87和LN229细胞在不同浓度米诺环素处理后自噬相关蛋白水平变化(n=3,)
**P<0.01;a 与对照组相比,b 与 shSIRT1 组相比,c 与 shSIRT1+5μmol/L米诺环素组相比,P<0.05
组别对照组shSIRT1组shSIRT1+5 μmol/L米诺环素组shSIRT1+10 μmol/L米诺环素组F U87 SIRT1 1.00±0.06 0.60±0.02a 0.16±0.05ab mTOR 1.00±0.10 0.70±0.07a 1.80±0.25ab LC3B 1.00±0.05 0.02±0.01a 0.23±0.05ab 0.02±0.02abc 3.08±0.38abc 0.30±0.02ab 348.214**63.046**427.207**组别对照组shSIRT1组shSIRT1+5 μmol/L米诺环素组shSIRT1+10 μmol/L米诺环素组F LN229 SIRT1 1.00±0.07 0.35±0.06a 0.06±0.02ab mTOR 1.00±0.09 0.46±0.05a 1.77±0.13ab LC3B 1.00±0.02 0.06±0.02a 0.05±0.02a 0.66±0.12abc 85.861**1.82±0.06ab 164.777**1.85±0.10abc 801.987**
3 讨论
胶质瘤是一种中枢神经系统的恶性肿瘤,具有高病死率、易复发的特点,单纯手术、放化疗治疗后效果欠佳。尽管近年来部分研究者提出基因治疗、免疫治疗、分子靶向治疗等方式,但实际效果并不显著,因此探索新的治疗策略仍有必要。米诺环素作为一种半合成的抗生素,因其抗菌谱广且能跨越血脑屏障,曾被广泛用于寻常型痤疮和一些性传播疾病治疗;但随着研究的深入,米诺环素的其他非抑菌作用也逐渐被发现[5,9-10]。近几年的研究证实米诺环素能抑制多种肿瘤的生长,其通过抑制AKT/mTOR/p70S6k/4E-BP1 信号通路引起缺氧诱导因子(HIF)-1α下调并抑制卵巢癌的生长[11],还能通过下调MKK1/2-ERK1/2 介导Rad51 表达进而抑制非小细胞肺癌的生长[12]。而目前米诺环素对胶质瘤作用的研究相对较少,Liu等[7]的研究表明米诺环素通过诱导自噬抑制胶质瘤的生长。本课题组前期研究结果也显示50~200 μmol/L 米诺环素均能抑制人类胶质瘤U87 和LN229 细胞的生长和增殖,并伴有两种胶质瘤细胞的凋亡和自噬水平均明显升高[8],因此推测其原因可能与细胞凋亡和自噬有关。
细胞自噬和凋亡均能引起细胞发生程序性死亡(programmed cell death,PCD)从而抑制肿瘤细胞的生长,这也是放化疗方案治疗胶质瘤的作用机制之一。细胞凋亡常被认为是Ⅰ型PCD,其包含有外源性死亡受体途径和内源性线粒体两大途径,其中Caspase-3 是该过程中关键酶和主要效应因子。本研究发现10 μmol/L 米诺环素组中2 种胶质瘤细胞中活化形式的Caspase-3蛋白表达显著升高,这表明细胞凋亡参与了抑制胶质瘤细胞生长的过程,但5 μmol/L 米诺环素组并未发生明显的细胞凋亡,分析原因可能与SIRT1一定程度上抑制凋亡相关信号通路或其他机制有关。细胞自噬也称为Ⅱ型PCD,适度的自噬通过降解被破坏的细胞器促进营养物质被细胞重新利用,进而保护细胞,但过度的自噬反而会导致细胞发生自噬性死亡。本研究发现5 μmol/L和10 μmol/L米诺环素组中LC3B和Atg5的表达水平均较对照组明显升高,提示细胞自噬同样参与了抑制胶质瘤细胞的生长。在此基础上,本研究还进一步揭示了米诺环素诱导胶质瘤细胞自噬与AMPK/SIRT1 通路有关,而诱导胶质瘤细胞凋亡与p70s6k/Bcl-2通路有关。此外,本研究还发现在shSIRT1干扰降低SIRT1 表达水平后,米诺环素同时处理U87和LN229 细胞,两种细胞中mTOR 蛋白水平明显升高,但U87 细胞中LC3B 蛋白变化不显著,而LN229细胞中LC3B 蛋白有增加趋势。这预示米诺环素除通过SIRT1/mTOR 信号通路调控自噬之外,可能还存在其他途径作用于自噬相关通路。笔者将在后续实验对上述问题进行进一步探讨。

