枯草芽孢杆菌高产角蛋白酶发酵条件优化
冒鑫哲,彭政,周冠宇,堵国成,张娟
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)3(江南大学 协同创新中心,江苏 无锡,214122)4(糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
角蛋白是羽毛、羊毛、角、头发、指甲、蹄的主要成分[1],其结构中包含大量高度交联的二酶硫键,不易被普通蛋白酶降解[2]。全球禽业每年产生几百万吨羽毛废弃物,畜牧业还以皮革、毛发和马蹄等形式产生数百万吨角蛋白废弃物[3],这些废弃物不仅浪费蛋白质资源,也造成空气、土壤和水的污染。角蛋白酶是一类特殊的蛋白水解酶,具有特异性降解不溶性角蛋白的能力[4],主要由细菌、真菌和放线菌产生[5-6],具有降解不溶性蛋白的特性,可用于羽毛降解。角蛋白酶在饲料[7-8]、肥料[9]、洗涤剂[10]、皮革[11-12]、纺织[13]、化妆品行业[14]和医疗[15]等领域有着广泛的应用前景。
目前,针对角蛋白酶发酵优化的研究,主要集中在野生菌的筛选、发酵培养基成分和发酵条件的优化[16],最常见的产角蛋白酶的菌是细菌,具有发酵周期短、酶活性高、生产安全性好等优点,具有良好应用前景[17-20]。廖朝勇等[18]在枯草芽孢杆菌WB600中构建角蛋白酶重组菌WB600-K,通过单因素试验及正交试验进行发酵优化,酶活性达到56.9 U/mL,较优化前提高49.74%;蒋彪等[19]通过筛选获得一株产角蛋白酶菌株,鉴定为芽孢杆菌,利用单因素优化,酶活性达到337.6 U/mL,是优化前的1.26倍。TIWARY等[20]通过单因素和响应面试验进行培养基优化,产角蛋白酶菌株酶活性达到1 962 U/mL,酶活性提高8倍。
角蛋白酶性能突出,在工业化应用中潜力巨大,但目前能够实现角蛋白酶高效生产的例子较少[21]。课题组前期研究中,成功构建了1株能够高效生产角蛋白酶的枯草芽孢杆菌工程菌WB600-p43-ker,角蛋白酶基因来源为地衣芽孢杆菌。本研究对产角蛋白酶菌株WB600-p43-ker发酵培养基成分以及发酵培养条件进行优化,提高发酵水平,降低发酵成本,为工业化生产提供帮助。
1 材料与方法
1.1 实验材料
1.1.1 菌株及质粒
质粒pP43NMK、宿主菌枯草芽孢杆菌(Bacillussubtilis) WB600由本实验室保藏;枯草芽孢杆菌工程菌WB600-p43-ker为本实验室构建。
1.1.2 培养基
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。(固体培养基加20 g/L琼脂),121 ℃灭菌15 min。
发酵培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,Na2HPO4·12H2O 6,KH2PO43,MgSO4·7H2O 0.3,121 ℃灭菌15 min。
1.2 仪器与设备
ZQZY-VAF振荡培养箱,上海知楚仪器有限公司;恒温培养箱,上海跃进医疗器械有限公司;5418高速离心机,德国Eppendorf公司;T&J-Atype台式玻璃生物反应器,迪必尔生物工程有限公司;UVmini-1280紫外分光光度计,岛津公司。
1.3 实验方法
1.3.1 菌株培养方法
菌株活化:取保存于-80 ℃的甘油菌1支于LB固体培养基上划线,37 ℃培养14~16 h。
一级种子液培养:从平板上挑取单菌落接种于3 mL LB培养基中,37 ℃、220 r/min培养过夜。
二级种子液培养:250 mL三角瓶装50 mL LB培养基,将一级种子液按体积分数2%接种量接入LB培养基中,37 ℃、220 r/min培养4~6 h。
摇瓶发酵培养:250 mL三角瓶装50 mL发酵培养基,将二级种子液按体积分数5%接种量转接至发酵培养基中,37 ℃、220 r/min培养24 h,测定发酵液酶活力。
1.3.2 角蛋白酶酶活力测定方法
粗酶液制备:将发酵获得的菌液于4 ℃、7 000 r/min离心5 min。
酶反应:向1.5 mL离心管中加入150 μL Gly-NaOH溶液(pH 10)、100 μL 25 g/L可溶性角蛋白和50 μL角蛋白酶溶液,混合均匀,于60 ℃中反应20 min;加入200 μL 0.5 mol/L三氯乙酸溶液终止反应,12 000 r/min离心2 min。对照组为加入酶液前加入200 μL三氯乙酸溶液。
显色反应:取200 μL上清液加入到1 mL 50 g/L Na2CO3溶液中,加入200 μL福林酚试剂,混合均匀,50 ℃显色10 min,使用分光光度计测定波长660 nm下的吸光度。
酶活力定义:1 U为吸光度在波长660 nm下升高0.001单位[22]。
1.3.3 单因素试验
1) 培养基碳源优化:以初始培养基为基础,分别使用葡萄糖、半乳糖、甘油、蔗糖、麦芽糖、糊精和淀粉为碳源,添加质量浓度为20 g/L,摇瓶培养24 h,测定发酵液酶活力;添加不同质量浓度的蔗糖(10、15、20、25、30、35、40 g/L),摇瓶培养24 h,测定发酵液酶活力。
2) 培养基氮源优化:在现有优化的基础上,分别使用蛋白胨、酵母浸膏、麸皮、豆粕、玉米浆粉、(NH4)2SO4和NH4Cl为氮源,添加质量浓度为30 g/L,摇瓶培养24 h,测定发酵液酶活力;分别添加不同质量浓度豆粕(20、25、30、35、40、45、50 g/L)测定发酵液酶活力。在已经确定1种氮源的基础上,添加第二氮源(NH4)2SO4、NH4Cl、玉米浆粉、蛋白胨、酵母浸膏,添加质量浓度为10 g/L,摇瓶培养24 h,测定发酵液酶活力;分别添加不同质量浓度酵母浸膏(1、5、10、15、20、25、30 g/L),摇瓶培养24 h,测定发酵液酶活力。
3) 培养基金属离子优化:在现有优化基础上,在培养基中添加K+、Na+、Mn2+、Zn2+、Fe2+、Ca2+、Mg2+,添加质量浓度为0.3 g/L,摇瓶培养24 h,测定发酵液酶活力;分别添加不同质量浓度MgSO4·7H2O(0.1、0.3、0.5、1、1.5 g/L),摇瓶培养24 h,测定发酵液酶活力。
5) 培养基初始pH优化:在现有优化基础上,改变发酵培养基的初始pH(6、6.5、7、7.5、8、8.5、9、9.5、10),摇瓶培养24 h,测定发酵液酶活力。
6) 培养基接种量优化:在现有优化基础上,将种子液以不同接种量(体积分数1%、3%、5%、7%、9%)接入发酵培养基中,摇瓶培养24 h,测定发酵液酶活力。
7) 培养温度优化:在现有优化基础上,调整培养发酵温度(30、32、35、37、40 ℃),摇瓶培养24 h,测定发酵液酶活力。
1.3.4 响应面试验
1) Plackett-Burman试验设计:将单因素试验的8个因素作为试验的因素,以角蛋白酶酶活力(Y)为响应值,利用Minitab 19软件进行n=12的Plackett-Burman(PB)试验设计。PB试验设计的各因素与水平如表1所示。

表1 Plackett-Burman设计因素与水平Table 1 Factors and levels of the Plackett-Burman design
2) Box-Behnken中心组合试验:采用Box-Behnken中心组合试验进行实验条件优化,以酵母浸膏(A)、pH(B)、温度(C)为变量,以角蛋白酶酶活力(Y)为响应值设计3因素3水平试验,试验方案中的各因素和水平如表2所示。

表2 响应面试验因素与水平Table 2 Factors and levels of response surface experiments
1.3.5 发酵罐放大实验
使用优化后的培养基及发酵条件对菌株进行3 L发酵罐试验。装液量1.5 L,按体积分数5%接种量转接二级种子至发酵罐中,初始条件为温度37 ℃、pH 7.68、通气量1.5 L/min。控制发酵过程中pH 7、温度37 ℃、溶氧25%~30%;由于实验室前期验证了补料葡萄糖或蔗糖对产酶无显著影响,故发酵时使用便于检测的葡萄糖进行补料,按照发酵时间9~16 h以30 mL/h、26~30 h以25 mL/h恒速补料,葡萄糖质量浓度为720 g/L;发酵10 h后以0.5 mL/h速度补料消泡剂。发酵过程中定时取样测定菌体浓度和角蛋白酶酶活力。
2 结果与分析
2.1 单因素试验结果
2.1.1 最佳碳源的确定
选用价格低廉的7种碳源进行培养基碳源优化,结果如图1所示。当碳源为蔗糖时,酶活力最高,麦芽糖和糊精次之,甘油最低。当培养基中的蔗糖质量浓度30 g/L时,酶活力最高,但进一步提高蔗糖质量浓度酶活力下降。有文献报道,蔗糖质量浓度过高导致渗透压增大,影响菌株的生长与产酶[23]。因此,选择质量浓度30 g/L蔗糖作为发酵培养基的碳源。

a-碳源种类对发酵产角蛋白酶的影响; b-蔗糖添加量对发酵产角蛋白酶的影响图1 碳源对发酵产角蛋白酶的影响Fig.1 Effects of single cabon source on the production of keratinase
2.1.2 最佳氮源的确定
选用价格低廉的8种氮源进行氮源优化,结果如图2所示。有机氮源作为唯一氮源的效果明显优于无机氮源。当使用豆粕作为氮源时,酶活力最高。当培养基中豆粕质量浓度40 g/L时,酶活力最高,继续提高豆粕质量浓度,酶活力无明显变化。由于不同来源的氮源对菌体生长和产酶促进作用不同,当使用复合氮源时,对产酶有进一步的促进作用[23,24],故向发酵培养基中添加第二氮源,探究其对产酶的影响。

a-氮源种类对发酵产角蛋白酶的影响; b-豆粕添加量对发酵产角蛋白酶的影响图2 氮源对发酵产角蛋白酶的影响Fig.2 Effects of nitrogen source on the production of keratinase
培养基中添加第二氮源结果如图3所示。添加酵母浸膏促进产酶的效果最好,蛋白胨次之,而(NH4)2SO4、NH4Cl和玉米浆粉对产酶有抑制作用。当培养基中酵母浸膏质量浓度为5 g/L时,酶活力最高。因此,选择质量浓度40 g/L豆粕和质量浓度5 g/L酵母浸膏作为发酵培养基的氮源。

a-氮源种类对发酵产角蛋白酶的影响;b-酵母浸膏添加量对发酵产角蛋白酶的影响图3 第二氮源对发酵产角蛋白酶的影响Fig.3 Effects of the second nitrogen source on the production of keratinase
2.1.3 最佳金属离子的确定
不同金属离子对产酶的影响如图4所示。其中,添加Mg2+时,酶活力最高。可能原因是Mg2+促进菌体的生长代谢,进而促进角蛋白酶的合成和分泌[25]。当培养基中MgSO4·7H2O质量浓度为0.3 g/L时,酶活力最高。因此,选择质量浓度0.3 g/L MgSO4·7H2O作为发酵培养基的最佳金属离子。
2.1.4 最佳磷酸盐质量浓度的确定
磷酸盐对产酶影响如图5所示。低质量浓度磷酸盐对产酶抑制较明显,磷酸盐质量浓度4.5 g/L后,酶活力最高,继续提高磷酸盐质量浓度,酶活力无明显变化。当磷酸盐质量浓度达到22.5 g/L时,酶活力下降。为降低发酵成本,确定产酶最佳磷酸盐质量浓度为4.5 g/L即Na2HPO4·12H2O质量浓度为 3 g/L,KH2PO4质量浓度为1.5 g/L。

a-金属离子种类对发酵产角蛋白酶的影响; b-MgSO4·7H2O添加量对发酵产角蛋白酶的影响图4 金属离子对发酵产角蛋白酶的影响Fig.4 Effects of metal ions on the production of keratinase

图5 磷酸盐质量浓度对发酵产角蛋白酶的影响Fig.5 Effects of phosphate concentration on the production of keratinase
2.1.5 最佳初始pH的确定
初始pH对产酶的影响如图6所示。培养基初始pH在7~8时,酶活力最高;初始pH<7时,对产酶抑制较大;初始pH在8.5~10时,酶活力降低,与酸性环境相比,菌株对碱性环境的耐受性较强。因此,确定初始pH 7.5为发酵产酶最适初始pH。

图6 pH对发酵产角蛋白酶的影响Fig.6 Effects of pH on the production of keratinase
2.1.6 最佳接种量的确定
接种量对产酶的影响如图7所示。当接种量为体积分数1%~5%时,酶活力随着接种量的增加而增加;接种量为体积分数5%时,酶活力最高。因此,确定接种量体积分数5%为发酵产酶最佳接种量。

图7 接种量对发酵产角蛋白酶的影响Fig.7 Effects of inoculum on the production of keratinase
2.1.7 最佳发酵温度的确定
温度对产酶的影响如图8所示。随着温度的升高,发酵酶活力呈现先提升后降低的趋势。在温度37 ℃时,酶活力最高。因此,确定37 ℃为发酵产酶最佳温度。

图8 温度对发酵产角蛋白酶的影响Fig.8 Effects of temperature on the production of keratinase
2.2 Plackett-Burman试验设计
在单因素试验的基础上,用Minitab 19软件设计Plackett-Burman(n=12)试验。选取单因素试验中的8个因素进行显著性考察,试验结果见表3。由表4方差分析结果可知,X3、X6和X8,即酵母浸膏、pH和温度在进行F检验后,P<0.05,因此以上3因素均为显著因素,选定并进行下一步优化试验。

表3 Plackett-Burman试验结果Table 3 Results of Plackett-Burman experiments

表4 Plackett-Burman试验方差分析Table 4 The variance of the Plackett-Burman experiments
2.3 响应面设计与分析
2.3.1 Box-Behnken试验设计与结果分析
将酵母浸膏(A)、pH(B)、接种量(C)作为变量,以角蛋白酶酶活力(Y)为响应值,进行响应面试验设计,试验结果见表5。利用Design-Expert 8.0软件试验结果进行分析,得到回归方程为:
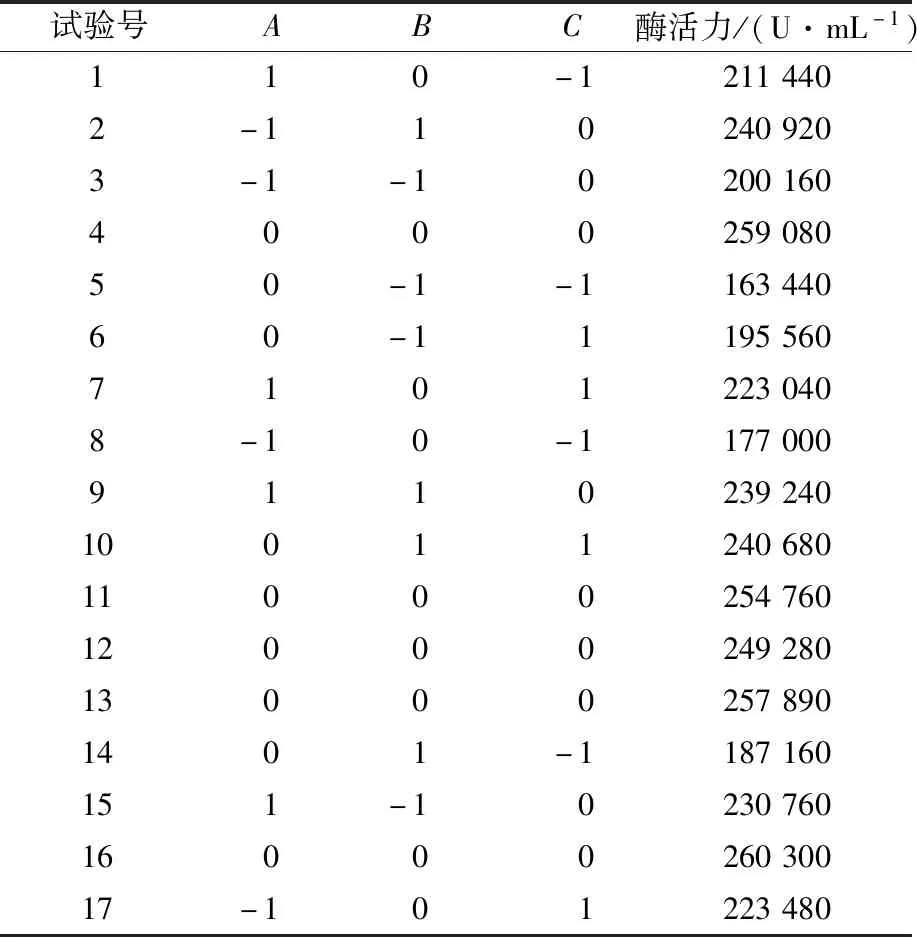
表5 Box-Behenken试验结果Table 5 Results of Box-Behenken design experiments
Y=256 300+7 865A+14 760B+17 965C-8 070AB-8 720AC+5 350BC-8 231A2-20 261B2-36 291C2。


表6 Box-Behenken试验方差分析Table 6 The variance of Box-Behenken design experiments
2.3.2 模型预测与验证实验
利用Design-Expert 8.0软件,分析3种显著性因素酵母浸膏、pH、温度的响应面和等高线。预测得到发酵培养基最佳工艺参数为酵母浸膏质量浓度5.72 g/L,pH 7.68,温度37.69 ℃,理论最高酶活力可达到261 711 U/mL。为验证模型的准确性及重复性,利用上述最佳工艺参数进行3次平行验证,测定角蛋白酶的平均酶活力为(260 480±1 430) U/mL,实际值与理论值较为接近,说明采用响应面法优化能够很好地预测枯草芽孢杆菌产角蛋白酶的实际情况。
2.4 发酵罐放大产角蛋白酶试验
为使优化后的结果能够更好地指导工业生产,对该结果进行3 L发酵罐发酵放大试验,发酵曲线如图9所示。由图9可知,角蛋白酶酶活力和菌体生长曲线基本一致。当菌株发酵培养进入对数中期后,发酵酶活力迅速提高,角蛋白酶被大量表达。当发酵时间达到26 h时,酶活力达到最大值,为704 400 U/mL,发酵罐发酵水平高于摇瓶发酵水平,可能是发酵罐培养比揺瓶培养具有更稳定的pH及溶氧条件。酶活力峰值过后菌体浓度和酶活力同时开始下降,推测由于菌株生长进入衰亡期,菌体自溶导致酶活力下降。

图9 菌株发酵产角蛋白酶曲线Fig.9 Fermentation curve on the production of keratinase
3 结论
本研究在单因素试验的基础上,利用Plackett-Burman设计筛选出酵母浸膏、pH、温度3个显著因素,利用Box-Behnken中心组合设计确定最优的角蛋白酶菌株发酵条件。确定了优化的发酵培养基为30 g/L蔗糖、40 g/L豆粕、5.72 g/L 酵母浸膏、3 g/L Na2HPO4,1.5 g/L KH2PO4,0.3 g/L MgSO4;优化的培养条件为培养温度37.69 ℃,接种量体积分数5%,pH 7.68。在此优化条件下,菌株摇瓶发酵酶活力为260 480 U/mL,较优化前酶活力提高4.26倍,3 L发酵罐发酵26 h酶活力达到最大值704 400 U/mL,超过文献报道的最高水平,优化后发酵原料成本较优化前降低了96%。本研究显著提高了产酶水平并降低了生产成本,为工业上生产角蛋白酶提供参考。

