甘蔗PsbS亚基应答甘蔗花叶病毒侵染及其与6K2蛋白的互作研究
张 海 刘淑娴 杨宗桃 王 彤 程光远 商贺阳 徐景升
甘蔗PsbS亚基应答甘蔗花叶病毒侵染及其与6K2蛋白的互作研究
张 海 刘淑娴 杨宗桃 王 彤 程光远 商贺阳 徐景升*
福建农林大学国家甘蔗工程技术研究中心 / 农业农村部福建甘蔗生物学与遗传育种重点实验室 / 教育部作物遗传育种与综合利用重点实验室, 福建福州 350002
非光化学猝灭(non-photochemical quenching, NPQ)是高等植物主要的光保护调节机制, 光合系统II (Photosystem II, PSII)的PsbS亚基在NPQ起关键作用。甘蔗(spp. hybrid)中PSII PsbS亚基应答甘蔗花叶病毒(, SCMV)的侵染尚未见报道。本课题组在前期研究中克隆了甘蔗的PsbS亚基编码基因, 命名为, 该基因开放读码框(open reading frame, ORF)长度为798 bp, 编码长度为265个氨基酸的蛋白。生物信息学分析表明, ScPsbS为稳定的疏水性蛋白, 具有叶绿体定位信号, 有4个跨膜结构域; 具有典型的PsbS亚基结构域。系统进化树分析表明, ScPsbS在单子叶、双子叶以及单子叶的C3和C4植物中存在明显的分化。亚细胞定位分析表明, ScPsbS定位于叶绿体且与SCMV-6K2部分共定位于叶绿体。双分子荧光互补(bimolecular fluorescence complementation, BiFC)试验进一步证实了ScPsbS与SCMV-6K2互作。实时荧光定量PCR分析发现,基因的表达具有明显的组织特异性, 在成熟叶片中相对表达量最高, 未成熟叶片和初衰叶中次之, 茎和根中几乎不表达; SCMV侵染对基因表达影响显著,基因在侵染早期显著上调, 侵染后期没有明显的差异。
甘蔗; PsbS亚基; 甘蔗花叶病毒; 6K2; 光保护
甘蔗(spp. hybrid)是我国重要的糖料作物, 我国食糖约90%来自甘蔗[1-2]。同时, 甘蔗还是重要生物质能源作物[3-5]。甘蔗花叶病是发生最普遍、危害最严重的一类病毒病性病害, 严重影响甘蔗产量和品质[6-8]。甘蔗花叶病的病原主要有甘蔗花叶病毒(, SCMV)、高粱花叶病毒(, SrMV)和甘蔗条纹花叶病毒(SCSMV) 3种[9-10], 均为马铃薯Y病毒科(Potyviridae)病毒[7,11-19]。SCMV和SrMV属于马铃薯Y病毒属()[20-21], SCSMV是该科新属, 即禾病毒属()[22-24]。近年来, 我国蔗区SrMV和SCSMV的检出率呈上升趋势[23,25], 但是SCMV依然是主要病原, 且在全世界普遍发生, 威胁甘蔗产业[14,26-28]。
SCMV、SrMV和SCSMV的基因组由约为10,000 nt的单链正义RNA组成, 编码2个多聚蛋白, 最终水解成11个成熟蛋白, 分别为P1、HC-Pro、P3、P3N-PIPO、6K1、CI、6K2、VPg、NIa-Pro、NIb和CP[29-35]。其中, 6K2蛋白在马铃薯Y病毒科病毒侵染中具有重要作用, 参与病毒的复制和胞间移动[32,35-38]。该蛋白以衣被蛋白I (coatomer protein complex I, COPI)和COPII依赖方式形成[39-41]诱导内质网(endoplasmic reticulum, ER)形成复制囊泡[41-43], 将病毒RNA、蛋白以及病毒复制所需的一些宿主蛋白包裹其中[44-46]。这些囊泡在细胞内沿着微丝移动[41], 并通过6K2与CI互作到达胞间连丝(plasmodesmata, PD), 然后通过PD进入未感染的相邻细胞[47], 或通过早期分泌途径沿着微丝达到叶绿体, 与叶绿体外膜融合, 进行病毒基因组高效复制[48]。病毒侵染造成叶绿素减少[49-51], 光合电子传递速率和同化效率降低[52-53], 甚至破坏叶绿体结构[49,54], 严重影响植物的光合作用[27,49,55]。病毒侵染也影响植物的非光化学猝灭(non-photochemical quenching, NPQ)[49,51,55], 但其潜在的分子机制尚不清楚。NPQ是植物在长期进化过程中发展的一种光保护机制, 植物藉此将过剩光能转化为热能耗散, 以减少过强光照的损伤[56-63]。光合系统II (Photosystem II, PSII)的PsbS亚基在NPQ起关键作用, 在缺失该基因的拟南芥突变体中, 光捕获和光合作用未受影响, 但是NPQ严重受抑[62,64]。进一步研究表明, 过量光照导致PsbS质子化, 进而诱导一系列生理生化反应如叶黄素循环、LHCII的磷酸化以及LHCII在PSI和PSII间的迁移, 调节激发能在2个光合系统上的合理分配, 以保护光合膜免遭受强光危害[63,65-69]; 同时, PsbS还可以通过与LHCII三聚体蛋白直接互作来增强过剩光能的猝灭从而保护光合膜[70]。
在前期研究工作中, 我们以SCMV编码的6K2蛋白为诱饵, 利用酵母双杂交(yeast two hybrid, Y2H)技术从甘蔗ROC22叶片的 cDNA 酵母文库中筛选并克隆了甘蔗的PsbS编码基因, 命名为(GenBank登录号为MN167889), 并利用Y2H验证了ScPsbS与SCMV-6K2的互作[71]。的开放读码框(open reading frame, ORF)长度为798 bp, 编码长度为 265 aa的蛋白。在本研究中, 我们对ScPsbS进行了深入的生物信息学分析, 利用定量PCR技术分析了组织特异性与应答SCMV侵染的表达模式, 利用双分子荧光互补(bimolecular fluorescent complimentary, BiFC)技术进一步验证了ScPsbS与SCMV-6K2 的互作关系, 并对其在SCMV侵染中的作用做了探讨。本研究为阐明病毒影响植物NPQ的分子机制及甘蔗抗花叶病育种提供了基础数据和实验依据。
1 材料与方法
1.1 材料及处理方法
SCMV-FZ1病毒株系[72]、甘蔗品种和本氏烟()由福建农林大学农业农村部福建甘蔗生物学与遗传育种重点实验室提供。本氏烟用于亚细胞定位和BiFC实验, 在光周期为16 h光照/8 h暗, 光照强度为130 μmol m–2s–1, 温度为22℃和空气湿度为60%的条件下培养。参照翟玉山等[73]的方法, 研究目的基因应答SCMV侵染的表达模式。采用腋芽快繁技术培养组培苗, 培养条件为光强200 μmol m–2s–1, 光周期16 h光照/8 h暗, 温度28℃, 空气湿度60%。待组培苗长至15~25 cm、出现4~5片完全展开的叶片时, 摩擦接种SCMV, 设置3个重复, 每个重复3株, 在光培养期间的第1小时后接种, 使用磷酸缓冲液(pH 7.0)摩擦接种对照植株, 取接种部位, 使用-CP基因特异引物(表1)检测接种是否成功。分别在接种后0 h、4 h、8 h、12 h、1 d、3 d、5 d、7 d取样。从福建农林大学隔离网室中选取长势一致的伸长期甘蔗品种健康植株, 于早上9点取未成熟叶心叶、成熟叶片正一叶(甘蔗植株由上到下第一个有可见肥厚带的叶片)、初衰叶片正七叶、未成熟节间第三节间、完成形态建成的第八节间和根, 用于基因的组织特异性表达实验, 设3个生物学重复, 每个生物学重复设置3株。取样后用液氮速冻, 置−80℃冰箱保存备用。

表1 本研究使用的引物
1.2 ScPsbS蛋白的生物信息学分析
利用ProtParam (http://expasy.org/tools/protparam. html)预测ScPsbS蛋白的一级结构、理化性质; 利用GOR4 (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. pl?page=npsa_gor4.html)、SignalP 5.0 (http://www.cbs. dtu.dk/services/SignalP/)和TMHMM 2.0 (http://www. cbs.dtu.dk/services/TMHMM/)分别预测分析ScPsbS的二级结构、信号肽和跨膜特性; 利用SWISS- MODEL (https://www.swissmodel.Expasy.org/)进行蛋白三维建模分析; 通过NCBI中的CDD (conserved domain database)数据库(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)预测ScPsbS蛋白保守结构域; 通过ChloroP (http://www.cbs.dtu.dk/services/ ChloroP/)预测分析ScPsbS蛋白的转运肽; 用Blastp在线工具查找ScPsbS的同源氨基酸序列, 使用DNAman 8.0进行氨基酸序列比对分析, 使用ClustalX和MEGA 6.0的ML (maximum likelihood, LG+G)法构建系统进化树。
1.3 RNA提取和cDNA合成
ProtParam分析表明, ScPsbS蛋白的分子量为27.81 kD, 等电点为9.07; 不稳定系数为28.47, 为稳定蛋白; 脂溶指数为100.53, 总平均亲水性是0.238, 可能是疏水性蛋白。GOR4预测表明, ScPsbS中无规则卷曲所占的比例最高, 为47.17%; 其次是α螺旋, 占42.64%; 延伸链所占比例是10.19%; 无β-折叠结构。SignalP 5.0分析表明, ScPsbS蛋白不含信号肽, 是非分泌蛋白。跨膜结构域预测结果表明, ScPsbS具有4个跨膜结构域。将ScPsbS蛋白序列提交SWISS-MODEL, 以蛋白质数据库中的菠菜PsbS (SMTL ID: 4ri2.1)A链晶体分子[76]为模板, 对ScPsbS、玉米()的ZmPsbS (NP_0011 05228.2)、水稻()的OsPsbS (XP_ 015621169.1)和拟南芥()的AtPsbS (NP_973971.1)进行同源建模结构预测。由于PsbS亚基是以二聚体执行其生物学功能的[76], 因此结构预测以二聚体的形式体现。预测结果表明, ScPsbS、玉米ZmPsbS、水稻OsPsbS、拟南芥AtPsbS与模板菠菜PsbS蛋白的氨基酸序列一致性分别为83.89%、84.36%、85.31%和88.21%,空间结构类似(图1)。
利用Gateway技术, 将基因构建到pEarleygate-202-YC和pEarleygate-201-YN载体中, 获得ScPsbSYC和YN-ScPsbS载体。用目的片段, 以黄色荧光蛋白(yellow fluorescence protein, YFP)为标记, 构建ScPsbS蛋白的亚细胞定位载体ScPsbS-YFP。所有构建的载体都经过上海生工生物工程有限公司测序验证。亚细胞定位载体SCMV-6K2-CFP以及用于BiFC实验的SCMV-6K2-YN和SCMV-6K2-YC均来自本课题组前期研究工作[71]。
1.4 载体构建
(5)全球范围内,自动驾驶技术研究方向主要集中在环境感知、决策控制系统和全球定位系统这三大方面,这也是自动驾驶技术的三大核心技术。
1.5 ScPsbS的亚细胞定位
参照Cheng等[32]的方法, 将含有植物表达载体ScPsbS-YFP的农杆菌GV3101以及等比例混合的含有植物表达载体SCMV-6K2-CFP和ScPsbS-YFP的农杆菌GV3101分别注射到健康的本氏烟叶片, 48 h后在激光共聚焦显微镜(Leica TCS SP5II)下观察本氏烟叶片表皮细胞中SCMV-6K2蛋白的定位以及ScPsbS蛋白和SCMV-6K2蛋白的共定位。CFP的激发波长为442 nm, 采集波长为450~500 nm; GFP的激发波长为514 nm, 采集波长为530~590 nm; 叶绿素自荧光的激发光波长为552 nm, 采集波长为 650~680 nm。图像采用数字采集, 使用LSM 2.6.3软件处理。
可视化是BIM技术在项目信息管理中应用的基本特征。具体而言,在BIM技术应用过程中,建筑工程的数字化立体模型得以有效建立,其使得传统二维图纸指导工程实践的信息管理模式发生转变;现代信息管理体系下,三维模型的应用使得建筑工程内容信息更加直观,其在可视化的条件下,充分保证了工程项目信息管理的质量,确保了信息决策的高效和精确。
1.6 BiFC验证ScPsbS与SCMV-6K2的互作
参照朱海龙等[74]的方法将含有ScPsbS-YC和SCMV-6K2-YN, ScPsbS-YN和SCMV-6K2-YC的农杆菌GV3101等比例混合, 分别注射入健康的本氏烟叶片中。在正常条件下培养2~3 d后在激光共聚焦显微镜(Leica TCS SP5II)下观察照相。YFP的激发光波长为514 nm, 捕获波长为530~590 nm。图像采用数字采集, 并用LSM 2.6.3软件处理。
1.7 ScPsbS的RT-qPCR表达分析
以小立碗藓()的PsbS蛋白序列作为外源序列, 使用ClustalX和MEGA 7.0的ML (maximum likelihood, LG+G)法构建系统进化树, 分析ScPsbS蛋白与其他物种PsbS蛋白的进化关系。结果表明, 双子叶植物番茄()、烟草()、拟南芥()、葡萄()、三叶杨()、大豆()、苜蓿()形成群I; 单子叶植物甘蔗、高粱、玉米、谷子、狗尾草()、黍、柳枝稷()、水稻、二穗短柄草、短柄草()、小麦、大麦()形成群II, 同时单子叶中的C3植物和C4植物分别形成亚群II-1和II-2 (图4)。这表明, 在遗传进化上PsbS蛋白在单子叶植物和双子叶植物之间, 以及在单子叶中的C3植物和C4植物之间存在明显分化。
2 结果与分析
2.1 ScPsbS蛋白的生物信息学分析
将采集的样品在液氮中研磨成粉末, 采用TRIzol (Invotrigen, USA)试剂按照其说明书提取样品总RNA, 使用1.0%琼脂糖凝胶电泳检测RNA质量。利用反转录试剂盒(艾科瑞, 中国), 参照其说明书, 将RNA反转录成cDNA。
BiFC试验结果表明, 共注射的YN-6K2和ScPsbS-YC, YN-ScPsbS和6K2-YC组合都分别产生黄色荧光信号(图6), 说明ScPsbS与SCMV-6K2互作, 与我们前期Y2H试验结果一致[71], 进一步证明了ScPsbS与SCMV-6K2互作。
2.2 ScPsbS蛋白的氨基酸序列同源性分析和系统进化树分析
通过NCBI 网站的Blastp和Phytozome网站的Proteome Blastp搜索不同物种的PsbS同源序列, 结果显示, ScPsbS蛋白与高粱(, XP_ 002456704.1)、玉米、谷子(, XP_004970 722.1)、黍(, XP_025818476.1)、二穗短柄草(, XP_003564 708.1)、小麦(, CDM85166.1)和水稻的PsbS相似性分别为98%、95%、84%、89%、81%、80%和79%。其在PsbS结构域的氨基酸序列高度保守, 而在N端的转运肽由于物种的不同而表现出差异, 且C3和C4植物有明显的差异(图3)。
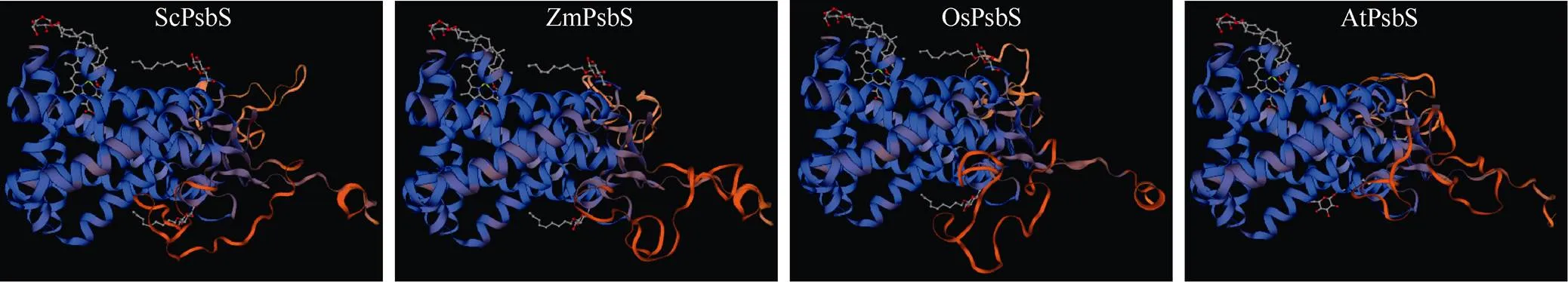
图1 基于SWISS-MODEL的ScPsbS、ZmPsbS、OsPsbS和AtPsbS蛋白三维建模
ZmPsbS (NP_001105228.2): 玉米的PsbS亚基; OsPsbS (XP_ 015621169.1): 水稻的PsbS亚基; AtPsbS (NP_973971.1): 拟南芥的PsbS亚基。
ZmPsbS (NP_001105228.2) is from; OsPsbS (XP_ 015621169.1) is from; AtPsbS (NP_973971.1) is from.

图2 ScPsbS基因的核苷酸序列及其编码的氨基酸序列



图3 甘蔗ScPsbS与其他单子叶植物PsbS蛋白的氨基酸序列比对
高粱: SbPsbS (XP_002456704.1); 玉米: ZmPsbS (NP_ 001105228.2); 黍: PhPsbS (XP_025818476.1); 谷子: SiPsbS (XP_ 004970722.1); 水稻: OsPsbS (XP_015621169.1); 二穗短柄草: BdPsbS (XP_003564708.1); 小麦: TaPsbS (CDM85166.1)。
: SbPsbS (XP_002456704.1);: ZmPsbS (NP_001105228.2);: PhPsbS (XP_025818476.1);: SiPsbS (XP_004970722.1);: OsPsbS (XP_015621169.1);: BdPsbS (XP_ 003564708.1);: TaPsbS (CDM85166.1).
根据基因的ORF序列, 设计特异性实时荧光定量PCR引物, 以供试材料的cDNA为模板, 以基因和基因(表1)为内参基因[75], 利用SYBR Green PCR Master Mix Kit (Roche, 日本)试剂盒, 参照其说明书配制反应体系。在7500型实时荧光定量PCR仪(ABI, USA)上完成PCR扩增, 反应程序为50℃ 2 min; 95℃ 10 min; 95℃ 15 s; 60℃ 1 min, 40个循环。每个样品设置3次重复, 以DEPC处理的无菌水作为空白对照, 采用2–ΔΔCt算法进行基因表达水平分析, 使用统计软件SPSS 12.0对基因表达差异进行显著性分析。
其次,还可以看出《纽约时报》中的心理过程和行为过程都多于《中国日报》;而物质过程和关系过程《中国日报》多于《纽约时报》。这反映出中国记者在报道“一带一路”使更多的强调中国与其他国家的合作关系;而美国记者则多用一些表达情感的词汇来暗示他们对中国“一带一路”的看法,且多用没有行为目标的行为过程,反映出他们对此战略的不重视与漠不关心。

图4 ScPsbS与其他物种PsbS蛋白的系统进化树分析
2.3 ScPsbS的亚细胞定位
以健康植株为材料, 研究基因在不同组织表达的特异性, 荧光定量PCR结果表明,基因在不同组织中的表达具有显著差异(图7): 在正一叶中相对表达量最高, 正七叶和心叶次之, 茎和根中表达量极低。正一叶是完全展开的光合作用最旺盛的叶片, 正七叶为初衰叶, 心叶基本是分生组织, 茎和根中则基本无光合作用, 因此的表达与其所在组织的光合能力呈正相关。
2.4 ScPsbS与SCMV-6K2的互作验证
保守结构域分析表明,编码的蛋白包含2个PsbS保守结构域, 分别在88~132、192~249位(图2), 确定属于基因家族。PsbS蛋白由核基因编码, 其N端具有转运肽, 靶向叶绿体内囊体腔, 进入叶绿体后在保守结构域AXA (X为任意氨基酸)后切割[77-78]。使用ChloroP对ScPsbS进行转运肽预测分析表明, ScPsbS蛋白N端的66 aa片段为转运肽, 其64~66位氨基酸为AAA (图2)。
在本实验中仍然存在一定的局限性。输血患者减少的比例差异无统计学意义。虽然氨甲环酸组的患者比对照组接受输血的人数少,但是差异无统计学意义,这可能与样本量较少有关。其次,术中失血量的评估,并未将手术衣、铺巾上的失血算入,这可能导致误差。而氨甲环酸药物的使用剂量仍然是基于大部分脊柱外科推荐剂量使用,而具体氨甲环酸在肿瘤手术中的最佳剂量仍然需要大量的不同实验去验证。最后,两组患者术后的引流量的比较差异无统计学意义,可能与术后未使用氨甲环酸,患者血液中氨甲环酸浓度下降,而未发挥药物作用有关。
2.5 ScPsbS基因的组织特异性表达及应答SCMV侵染的表达模式
亚细胞定位试验表明, ScPsbS-YFP的黄色荧光信号与叶绿体的荧光信号重合(图5-A), 表明ScPsbS定位于叶绿体, 与拟南芥PsbS的叶绿体定位结果一致[64,79]。Y2H表明ScPsbS与SCMV-6K2互作[65], 因此本研究探讨了ScPsbS和SCMV-6K2的共同定位情况。结果表明, ScPsbS-YFP的黄色荧光信号与6K2-CFP的青色荧光蛋白信号重合, 部分共定位信号与叶绿体荧光信号重合, 且这些叶绿体均分布在细胞膜周围(图5-B)。
以SCMV-FZ1接种的叶片为材料[73], 研究SCMV侵染对基因表达的影响。使用SCMV-CP基因特异引物(表1)检测SCMV接种甘蔗, 扩增出目的片段, 表明接种成功。荧光定量PCR结果表明, SCMV侵染对基因表达影响显著, 与对照相比,基因在侵染早期显著上调, 然后下调至略高于对照的水平, 但是差异不显著(图8)。

图5 ScPsbS-YFP在本氏烟表皮细胞中的定位
A: ScPsbS-YFP亚细胞定位; B: ScPsbS-YFP和6K2-CFP亚细胞共定位。白色箭头表示叶绿体, 标尺= 25 μm。
A: subcellular localization of ScPsbS-YFP; B: subcellular colocalization of ScPsbS-YFP with 6K2-CFP. White arrows indicate the chloroplasts; bar = 25 μm.

图6 BiFC检测ScPsbS与SCMV-6K2的互作
A: YC融合于ScPsbS的C末端, YN融合于SCMV-6K2的N末端; B: YN融合于ScPsbS的N末端, YC融合于SCMV-6K2的C末端。将YN-6K2和ScPsbS-YC(A), YN-ScPsbS和6K2-YC(B)分别共注射到本氏烟叶片中进行瞬时表达, 48 h后激光共聚焦观察。标尺= 25 μm。
A: the C-terminal half of YFP was fused to the C-terminal of ScPsbS to generate ScPsbS-YC, while the N-terminal half of YFP was fused to the N-terminla of SCMV-6K2 to generate YN-6K2; B: the N-terminal half of YFP was fused to the N-terminal of ScPsbS to generate YN- ScPsbS, while the C-terminal half of YFP was fused to the C-terminal of SCMV-6K2 to generate 6K2-YC. Plasmids combination of YN-6K2 plus ScPsbS-YC (A), YN-ScPsbS plus SCMV-6K2-YC (B) were individually co-injected intoleaves for transient expression. The fluorescent signal was monitored by confocal microscopy at 48 h after infiltration; bar = 25 μm.
3 讨论
甘蔗是生长于热带亚热带的C4植物, 具有很高的光合效能[80]。甘蔗在光照强度最高的中午时段, 存在光抑制现象[81], 但是对净光合效率影响不大[82], 主要是因为甘蔗具有较强的光呼吸和光抑制自我保护能力, 相应地, 其NPQ也在中午出现峰值[80]。在甘蔗伸长期, 正一叶是光合作用最旺盛的叶片[81]。本研究对的组织特异性表达分析(图7)也表明,的表达可能与其所在组织的光合能力相关。由于PsbS是植物NPQ的关键因子[62,64,67,70], 因此推测这种相关源自以NPQ为主的光保护。

图7 ScPsbS基因在甘蔗不同组织中的表达模式
误差线为每组处理的标准误差(= 3)。LR: 心叶; +1 L: 正一叶; +7 L: 正七叶; +3 I: 第三节间; +8 I: 第八节间; R: 根。
The error bars represent the standard error of each treatment group (= 3). LR: leaf roll; +1 L: +1 leaf; +7 L: +7 leaf; +3 I: +3 internode; +8 I: +8 Internode; R: root.

图8 ScPsbS基因应答SCMV侵染的表达模式
误差线为每组处理的标准误差(= 3)。
The error bars represent the standard error of each treatment group (= 3).
植物病毒基因组简单, 必须与寄主因子互作才能在寄主体内建立系统性侵染[82-83]。本课题组在前期研究中, 利用Y2H验证了SCMV-6K2与ScPsbS的互作[71], 本研究利用BiFC技术进一步证明了它们的互作(图 6)。SCMV-6K2定位于内质网和叶绿体[71], ScPsbS定位于叶绿体(图5-A), SCMV-6K2与ScPsbS的部分共定位信号出现在叶绿体上(图5-B)。叶绿体是马铃薯Y病毒属病毒高效复制的场所, 比如芜菁花叶病毒(, TuMV)利用6K2与Syp71互作[48], 烟草脉带花叶病毒(, TVBMV)利用6K2与NbPsbO1互作[84], 促进病毒基因组复制。因此, 我们推测SCMV可能利用6K2与ScPsbS互作, 使SCMV的复制复合体定位于叶绿体, 有利于SCMV基因组的高效复制。供试材料极易感染甘蔗花叶病,在SCMV侵染早期表达显著上调(图8), 一方面有助于SCMV在寄主体内建立系统性侵染, 另一方面则是寄主对SCMV侵染的抗性反应。甘蔗花叶病的主要症状是出现花叶、植株矮小、产量和品质下降等, 主要是因为SCMV侵染导致叶绿素减少[50]、叶绿体破坏[85], 进而光合作用受损。在SCMV侵染后期,表达量迅速下降(图8)至略高于对照, 但无显著性差异。Lei等[55]对黄瓜花叶病毒(, CMV)侵染烟草的研究表明, 在侵染后的第8天和第12天, 感病叶片与健康叶片相比, NPQ略高但无显著差异, 推测是烟草应对CMV侵染的抗逆反应[49]。ScPsbS与SCMV-6K2互作于细胞膜上(图6), 改变了ScPsbS的叶绿体定位, 因此可能抑制NPQ, 使甘蔗的光合作用失去保护, 加剧叶绿体的损伤, 导致叶片黄化, 进而吸引蚜虫等昆虫载体传播病毒[14,86-90]。
一是扩宽了农产品的销售途径。“互联网+农产品”销售模式在传统销售模式的基础上,突破了场地和时间的局限,拉近了生产方和消费方的距离,帮助农产品市场营销主体更好地认识市场需求、市场价格趋向以及竞争者的信息,推动了市场营销向精细化、专业化、个性化方向发展。
目前,由于可编程逻辑控制器已相对比较成熟,使其在生产的过程当中普遍替代了机电控制。通过应用可编程逻辑控制器,能够使电气化生产过程当中所具有的优点得到更加充分的体现,利用此方式能够有效确保整个电气系统始终保持正常运行的状态。与此同时,可编程逻辑控制器不仅可以达到供电体互相转换的目的,还可以让电气工程的相关项目体系更加稳定,以此提高电气及其自动化控制的效率。
4 结论
基因在成熟叶片中表达量最高, 在SCMV侵染早期上调表达。ScPsbS蛋白定位于叶绿体, 可与SCMV-6K2共定位于叶绿体。ScPsbS蛋白与SCMV-6K2互作于细胞膜。
[1] 翁卓, 黄寒. 中国制糖产业竞争力对比与政策建议—基于对巴西、印度、泰国考察的比较. 甘蔗糖业, 2015, (4): 65–72.Weng Z, Huang H. Comparative analysis on China’s sugar industry competitiveness: based on the comparison of Brazil, India and Thailand Sugar Industry., 2015, (4): 65–72 (in Chinese with English abstract).
[2] 刘晓雪, 王新超. 2017/18榨季中国食糖生产形势分析与2018/19榨季展望.农业展望,2018, 14(11): 40–46. Liu X X, Wang X C. Domestic sugar production situation in 2017/18 crushing season and its prospect for 2018/19 crushing season., 2018, 14(11): 40–46 (in Chinese with English abstract).
[3] 刘燕群, 李玉萍, 梁伟红, 宋启道, 秦小立, 叶露. 国外甘蔗产业发展现状. 世界农业, 2015, (8): 147–152. Liu Y Q, Li Y P, Liang H W, Song Q D, Qin X L, Ye L. Current status and development of the abroad sugarcane industry., 2015, (8): 147–152 (in Chinese with English abstract).
[4] 王明强, 李文凤, 黄应昆, 王晓燕, 卢文洁, 罗志明. 我国大陆蔗区发生的甘蔗病毒病及防控对策. 中国糖料,2010, (4): 55–58. Wang M Q, Li Y P, Huang Y K, Wang X Y, Lu W J, Luo Z M. Occurrence and controlling strategies on sugarcane viral diseases in Chinese mainland., 2010, (4): 55–58 (in Chinese with English abstract).
[5] 周晚秋, 娄春, 何子林, 傅峻涛. 巴西生物燃料技术现状与发展.中外能源, 2017, 22(6): 24–31. Zhou W Q, Lou C, He Z L, Fu J T. Status quo and development of Brazilian biofuel technologies., 2017, 22(6): 24–31 (in Chinese with English abstract).
[6] 周丰静, 黄诚华, 李正文, 商显坤, 黄伟华, 潘雪红, 魏吉利, 林善海. 广西蔗区甘蔗花叶病病毒种群分析. 南方农业学报, 2015, 46: 609–613. Zhou F J, Huang C H, Li Z W, Shang X S, Huang W H, Pan X H, Wei J L, Lin S H. Analysis of the virus population causingdisease in sugarcane growing area of Guangxi., 2015, 46: 609–613 (in Chinese with English abstract).
[7] Ling H, Huang N, Wu Q, Su Y, Peng Q, Ahmed W, Gao S, Su W, Que Y, Xu L. Transcriptional insights into theinteraction.,2018, 11: 163–176.
[8] 周国辉, 许东林, 沈万宽. 甘蔗重要病害研究及防治策略. 甘蔗糖业, 2005, (1): 11–16. Zhou G H, Xu D L, Shen W K. On sugarcane major diseases and their controlling., 2005, (1): 11–16 (in Chinese with English abstract).
[9] Shukla D D, Frenkel M J, McKern N M, Ward C W, Jilka J, Tosic M, Ford R E. Confirmation that thesubgroup consists of four distinct potyviruses by using peptide profiles of coat proteins., 1992, 5: 363–373.
[10] Shukla D D, Tosic M, Jilka J, Ford R E, Toler R W, Langham M A C.Taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal., 1989, 79: 223–229.
[11] 梁姗姗, 罗群, 陈如凯, 高三基. 引起甘蔗花叶病的病原分子生物学进展. 植物保护学报,2017, 44: 363–370. Liang S S, Luo Q, Chen R K, Gao S J. Advances in researches on molecular biology of viruses causing sugarcane mosaic., 2017, 44: 363–370 (in Chinese with English abstract).
[12] 李文凤, 单红丽, 张荣跃, 王晓燕, 罗志明, 尹炯, 仓晓燕, 李婕, 黄应昆. 我国新育成甘蔗品种(系)对甘蔗线条花叶病毒和高粱花叶病毒的抗性评价. 植物病理学报,2018, 48: 389–394. Li W F, Shan H L, Zhang R Y, Wang X Y, Luo Z M, Yin J, Cang X Y, Li J, Huang Y K. Screening for resistance toandin new elite sugarcane varieties/clones from China., 2018, 48: 389–394 (in Chinese with English abstract).
[13] 冯小艳, 王文治, 沈林波, 冯翠莲, 张树珍. 甘蔗线条花叶病毒研究进展. 生物技术通报, 2017, 33(7): 22–28. Feng X Y, Wang W Z, Shen L B, Feng C L, Zhang S Z. Research advances on., 2017, 33(7): 22–28 (in Chinese with English abstract).
[14] Wu L, Zu X, Wang S, Chen Y.-long history but still a threat to industry., 2012, 42: 74–78.
[15] Xu D L, Park J W, Mirkov T E, Zhou G H. Viruses causing mosaic disease in sugarcane and their genetic diversity in southern China., 2008, 153: 1031–1039.
[16] 郑艳茹, 翟玉山, 邓宇晴, 成伟, 程光远, 杨永庆, 徐景升. 甘蔗花叶病毒(SCMV)种群结构分析. 福建农林大学学报(自然科学版), 2016, 45(2): 135–140. Zheng Y R, Zhai Y S, Deng Y Q, Cheng W, Cheng G Y, Yang Y Q, Xu J S. The population structure of(SCMV).(Nat Sci Edn), 2016, 45(2): 135–140 (in Chinese with English abstract).
[17] 翟玉山, 彭磊, 杨永庆, 邓宇晴, 程光远, 郑艳茹, 徐景升. 甘蔗条纹花叶病毒 HC-Pro、P3N-PIPO、CP 和 VPg基因酵母双杂交诱饵表达载体的构建及自激活检测. 华北农学报, 2016, 31(1): 83–89. Zhai Y S, Peng L, Yang Y Q, Deng Y Q, Cheng G Y, Zheng Y R, Xu J S. Construction and self-activated detection of the baits of HC-Pro, P3N-PIPO, CP and VPg fromfor yeast two hybrid system., 2016, 31(1): 83–89 (in Chinese with English abstract).
[18] Dong M, Cheng G Y, Peng L, Xu Q, Yang Y Q, Xu J S. Transcriptome analysis of sugarcane response to the infection by(SCSMV)., 2017, 10: 45–55.
[19] Zhai Y S, Deng Y Q, Cheng G Y, Peng L, Zheng Y R, Yang Y, Xu J S. Sugarcane elongin C is involved in infection by sugarcane mosaic disease pathogens., 2015, 466: 312–318.
[20] Hall J S, Adams B, Parsons T J, French R, Lane L C, Jensen S G. Molecular cloning, sequencing, and phylogenetic relationships of a new potyvirus:, and a reevaluation of the classification of the., 1998, 10: 323–332.
[21] Ward C W, Shukla D D. Taxonomy of potyviruses: current problems and some solutions.,1991, 32: 269–296.
[22] Putra L K, Kristini A, Achadian E M, Damayanti T A.in indonesia: distribution, characterisation, yield losses and management approaches.,2014, 16: 392–399.
[23] Li W F, He Z, Li S F, Huang Y K, Zhang Z X, Jiang D M, Wang X Y, Luo Z M. Molecular characterization of a new strain of(SCSMV)., 2011, 156: 2101–2104.
[24] Xu D L, Zhou G H, Xie Y J, Mock R, Li R. Complete nucleotide sequence and taxonomy of, member of a novel genus in the family., 2010, 40: 432–439.
[25] 李文凤, 丁铭, 方琦, 黄应昆, 张仲凯, 董家红, 苏晓霞, 李婷婷. 云南甘蔗花叶病病原的初步鉴定.中国糖料, 2006, (2): 8–11. Li W F, Ding M, Fang Q, Huang Y K, Zhang Z K, Dong J H, Su X X, Li T T. Evaluation of similarity-difference analysis for sugarcane varieties., 2006, (2): 8–11 (in Chinese with English abstract).
[26] Filloux D, Fernandez E, Comstock J C, Mollov D, Roumagnac P, Rott P. Viral metagenomic-based screening of sugarcane from florida reveals occurrence of six sugarcane-infecting viruses and high prevalence of.,2018, 102: 2317–2323.
[27] Akbar S, Yao W, Yu K, Qin L, Ruan M, Powell CA, Chen B, Zhang M. Photosynthetic characterization and expression profiles of sugarcane infected by(SCMV).,2020 doi: 10.1007/s11120-019- 00706-w.
[28] Yahaya A, Dangora D B, Kumar P L, Alegbejo M D, Gregg L, Alabi O J. Prevalence and genome characterization of field isolates of(SCMV) in Nigeria., 2019, 103: 818–824.
[29] Bernardi F. Potyvirus proteins: a wealth of functions., 2001, 74: 157–175.
[30] Olspert A, Carr J P, Firth A E. Mutational analysis of thetranscriptional slippage site utilized for expression of the P3N-PIPO and P1N-PISPO proteins.,2016, 44: 7618–7629.
[31] Olspert A, Chung B Y, Atkins J F, Carr J P, Firth A E. Transcriptional slippage in the positive-sense RNA virus family.,2015, 16: 995–1004.
[32] Cheng G Y, Dong M, Xu Q, Peng L, Yang Z T, Wei T Y, Xu J S. Dissecting the molecular mechanism of the subcellular localization and cell-to-cell movement of theP3N-PIPO., 2017, 7: 9868. doi: 10.1038/ s41598-017-10497-6.
[33] Riechmann J L, Laín S, García J A. Highlights and prospects of potyvirus molecular biology.,1992, 73: 1–16.
[34] Chung B Y, Miller W A, Atkins J F, Firth A E. An overlapping essential gene in the.,2008, 105: 5897–5902.
[35] Cheng G Y, Yang Z T, Zhang H, Zhang J S, Xu J S. Remorin interacting with PCaP1 impairsintercellular movement but is antagonised by VPg.,2019,225: 2122–2139.
[36] Cabanillas D, Jiang J, Movahed N, Germain H, Yamaji Y, Zheng H, Laliberté J.uses the SNARE protein VTI11 in an unconventional route for replication vesicle trafficking.,2018, 30: 2594–2615.
[37] Movahed N, Patarroyo C, Sun J, Vali H, Laliberté J F, Zheng H. Cytoplasmic inclusion ofserves as a docking point for the intercellular movement of viral replication vesicles.,2017, 175: 1732–1744.
[38] Movahed N, Sun J, Vali H, Laliberté J, Zheng H. A host ER fusogen is recruited byfor maturation of viral replication vesicles.,2019, 179: 507–518.
[39] Wei T, Wang A. Biogenesis of cytoplasmic membranous vesicles for plantreplication occurs at endoplasmic reticulum exit sites in a COPI- and COPII-dependent manner.,2008, 82: 12252–12264.
[40] Jiang J, Patarroyo C, Garcia Cabanillas D, Zheng H, Laliberté J F. The vesicle-forming 6K2 protein ofinteracts with the COPII coatomer Sec24a for viral systemic infection.,2015, 89: 6695–6710.
[41] Cotton S, Grangeon R, Thivierge K, Mathieu I, Ide C, Wei T, Wang A, Laliberté J.RNA replication complex vesicles are mobile, align with microfilaments, and are each derived from a single viral genome., 2009, 83: 10460–10471.
[42] Nicolas O, Laliberté J. The complete nucleotide sequence of turnip mosaic potyvirusRNA., 1992, 73: 2785–2793.
[43] Beauchemin C, Laliberté J F. The poly(A) binding protein is internalized in virus-induced vesicles or redistributed to the nucleolus duringinfection.,2007, 81: 10905–10913.
[44] Beauchemin C, Boutet N, Laliberté J F. Visualization of the interaction between the precursors of VPg, the viral protein linked to the genome of, and the translation eukaryotic initiation factor iso 4E in Planta.,2007, 81: 775–782.
[45] Dufresne P J, Thivierge K, Cotton S, Beauchemin C, Ide C, Ubalijoro E, Laliberté J F, Fortin M G. Heat shock 70 protein interaction withRNA-dependent RNA polymerase within virus-induced membrane vesicles.,2008, 374: 217–227.
[46] Laliberté J F, Zheng H. Viral manipulation of plant host membranes.,2014, 1: 237–259.
[47] Grangeon R, Jiang J, Wan J, Agbeci M, Zheng H, Laliberté J F. 6K2-induced vesicles can move cell to cell duringinfection.,2013, 4: 351.
[48] Wei T, Zhang C, Hou X, Sanfaçon H, Wang A. The SNARE protein Syp71 is essential forinfection by mediating fusion of virus-induced vesicles with chloroplasts., 2013, 9: e1003378.
[49] Balachandran S, Hurry V M, Kelley S E, Osmond C B, Robinson S A, Rohozinski J, Sims D A. Concepts of plant biotic stress. Some insights into the stress physiology of virus- infected plants, from the perspective of photosynthesis., 1997, 100: 203–213.
[50] 刘家勇, 赵培方, 赵俊, 崔洁, 陈学宽, 夏红明, 杨昆, 吴才文. 甘蔗花叶病对甘蔗叶片叶绿素含量的影响. 中国糖料, 2011, (4): 7–9. Liu J Y, Zhao P F, Zhao J, Cui J, Chen X K, Xia H M, Yang K, Wu C W. Effect ofon chlorophyll content of sugarcane leaves., 2011, (4): 7–9 (in Chinese with English abstract).
[51] Farooq T, Liu D, Zhou X, Yang Q. Tomato yellow leaf curl China virus impairs photosynthesis in the infectedwith βC1 as an aggravating factor., 2019, 35: 521–529.
[52] Funayama S, Hikosaka K, Yahara T. Effects of virus infection and growth irradiance on fitness components and photosynthetic properties of Eupatorium makinoi (Compositae)., 1997, 84: 823–829.
[53] Song X S, Wang Y J, Mao W H, Shi K, Zhou Y H, Nogues S, Yu J Q. Effects ofinfection on electron transport and antioxidant system in chloroplasts and mitochondria of cucumber and tomato leaves., 2009, 135: 246–257.
[54] Xu J S, Deng Y Q, Cheng G Y, Zhai Y S, Peng L, Dong M, Xu Q, Yang Y Q.infection of model plantsand., 2019, 18: 2294–2301.
[55] Lei R, Jiang H, Hu F, Yan J, Zhu S. Chlorophyll fluorescence lifetime imaging provides new insight into the chlorosis induced by plant virus infection., 2017, 36: 327–341.
[56] Moller I, Jensen P, Hansson A. Oxidative modifications to cellular components in plants.,2007, 58: 459–481.
[57] Li Z, Wakao S, Fischer B B, Niyogi K K. Sensing and responding to excess light., 2009, 60: 239–260.
[58] Pospísil P, Arató A, Krieger-Liszkay A, Rutherford A W. Hydroxyl radical generation by photosystem II., 2004, 43: 6783–6792.
[59] Niyogi K K, Truong B T. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis., 2013, 16: 307–314.
[60] Holt N E, Fleming G R, Niyogi K K. Toward an understanding of the mechanism of nonphotochemical quenching in green plants., 2004, 43: 8281–8289.
[61] Takahashi S, Badger M R. Photoprotection in plants: a new light on photosystem II damage., 2011, 16: 53–60.
[62] Li X P, Björkman O, Shih C, Grossman A R, Rosenquist M, Jansson S, Niyogi K K. A pigment-binding protein essential for regulation of photosynthetic light harvesting.,2000, 403: 391–395.
[63] Li X P, Gilmore A M, Caffarri S, Bassi R, Golan T, Kramer D, Niyogi K K. Regulation of photosynthetic light harvesting involves intrathylakoid lumen pH sensing by the PsbS protein., 2004, 279: 22866–22874.
[64] Correagalvis V, Poschmann G, Melzer M, Kai S, Jahns P. PsbS interactions involved in the activation of energy dissipation in., 2016, 2: 15225.
[65] Niyogi K K, Li X P, Rosenberg V, Jung H S. Is PsbS the site of non-photochemical quenching in photosynthesis?, 2005, 56: 375–382.
[66] Johnson M P, Ruban A V.plants lacking PsbS protein possess photoprotective energy dissipation., 2010, 61: 283–289.
[67] Ruban A V, Johnson M P. Xanthophylls as modulators of membrane protein function., 2010, 504: 78–85.
[68] Allen J F. Botany. State transitions: a question of balance.,2003, 299: 1530–1532.
[69] 孙瑞雪, 杨春虹. 光系统II的结构与功能以及光合膜对环境因素的响应机制.生物物理学报, 2012, 28: 537–548. Sun R X, Yang C H. Structure and function of photosystem II and the environmental response of photosynthetic membrane., 2012, 28: 537–548 (in Chinese with English abstract).
[70] Gerotto C, Franchin C, Arrigoni G, Morosinotto T.identification of photosystem II light harvesting complexes interacting with PHOTOSYSTEM II SUBUNIT S., 2015, 168: 1747–1761.
[71] Zhang H, Cheng G Y, Yang Z T, Wang T, Xu J S. Identification of sugarcane host factors interacting with the 6K2 protein of the.,2019, 20: 3867.
[72] 邓宇晴, 杨永庆, 翟玉山, 程光远, 彭磊, 郑艳茹, 林彦铨, 徐景升. 甘蔗花叶病毒福州分离物全基因组克隆及种群分析. 植物病理学报, 2016, 46: 775–782. Deng Y Q, Yang Y Q, Zhai Y S, Cheng G Y, Peng L, Zheng Y R, Lin Y Q, Xu J S. Genome cloning of twoisolates from Fuzhou and phylogenetic analysis of SCMV., 2016, 46: 775–782 (in Chinese with English abstract).
[73] 翟玉山, 赵贺, 张海, 邓宇晴, 程光远, 杨宗桃, 王彤, 彭磊, 徐倩, 董萌, 徐景升. 甘蔗NAD(P)H脱氢酶复合体O亚基基因克隆及其甘蔗花叶病毒VPg互作研究. 作物学报, 2019, 10: 1478–1487. Zhai Y S, Zhao H, Zhang H, Deng Y Q, Cheng G Y, Yang Z T, Wang T, Peng L, Dong M, Xu J S. Cloning of NAD(P)H complex O subunit gene and its interaction with VPg of., 2019, 10: 1478–1487 (in Chinese with English abstract).
[74] 朱海龙, 程光远, 彭磊, 柴哲, 郭晋隆, 许莉萍, 徐景升. 甘蔗条纹花叶病毒P3蛋白与甘蔗Rubisco大亚基互作的研究. 西北植物学报, 2014, 34: 676–681. Zhu H L, Cheng G Y, Peng L, Chai Z, Guo J L, Xu L P, Xu J S. Interaction betweenP3 and rubisco large subunit from sugarcane., 2014, 34: 676–681 (in Chinese with English abstract).
[75] Guo J, Ling H, Wu Q, Xu L, Que Y. The choice of reference genes for assessing gene expression in sugarcane under salinity and drought stresses., 2014, 4: 7042.
[76] Fan M, Li M, Liu Z, Cao P, Pan X, Zhang H, Zhao X, Zhang J, Chang W. Crystal structures of the PsbS protein essential for photoprotection in plants., 2015, 22: 729–735.
[77] Funk C, SchrödChenger W P, Green B R, Renger G, Andersson B. The intrinsic 22 kDa protein is a chlorophyll-binding subunit of photosystem II., 1994, 342: 261–266.
[78] Wedell N, Klein R, Ljungberg U, Andersson B, Herrmann R G. The single-copy genecodes for a phylogenetically intriguing 22 kDa polypeptide of photosystem II., 1992, 314: 61–66.
[79] Daskalakis V, Papadatos S. The photosystem II subunit S under stress., 2017, 113: 2364–2372.
[80] Zhang M Q, Cheng R K, Luo J, Lu J L, Xu J S. Analyses for inheritance and combining ability of photochemical activities measured by chlorophyll fluorescence in the segregating generation of sugarcane., 2000, 65: 31–39.
[81] 罗俊, 张华, 陈由强, 徐景升, 林彦铨, 陈如凯. 能源甘蔗不同叶位叶片形态、光合气体交换及其与产量关系. 应用与环境生物学报, 2006, 12: 754–760. Luo J, Zhang H, Chen Y Q, Xu J S, Lin Y Q, Chen R K. Relationship of energy sugarcane leaf form s and gas exchange with its yield., 2006, 12: 754–760 (in Chinese with English abstract).
[82] 王勤南, 许环映, 陈俊吕, 刘壮, 常海龙, 周峰, 金玉峰, 胡后祥, 符成, 刘少谋. 甘蔗叶片叶绿素荧光参数日变化研究.热带农业科学, 2014, 34(10): 24–27.Wang Q N, Xu H Y, Chen J L, Liu Z, Chang H L, Zhou F, Jin Y F, Hu H X, Fu C, Liu S M. Diurnal variation of chlorophyll fluorescence parameters of sugarcane leaf., 2014, 34(10): 24–27 (in Chinese with English abstract).
[83] 张木清, 吕建林. 甘蔗光合速度的日变化及其对光温的响应. 福建农业大学学报(自然科学版), 1998, 27: 397–401. Zhang M Q, Lyu J L. Diurnal variation of photosynthetic rate in sugarcane and its responses to light and temperature.(Nat Sci Edn), 1998, 27: 397–401 (in Chinese with English abstract).
[84] Wang A. Dissecting the molecular network of virus-plant interactions: the complex roles of host factors., 2015, 53: 45–66.
[85] Wittmann S, Chatel H, Fortin M G, Laliberté J F. Interaction of the viral protein genome linked of turnip mosaic potyvirus with the translational eukaryotic initiation factor (iso) 4E ofusing the yeast two-hybrid system., 1997, 234: 84–92.
[86] Geng C, Yan Z Y, Cheng D J, Liu J, Tian Y P, Zhu C X, Wang H Y, Li X D.6K2 protein Hijacks NbPsbO1 for virus replication., 2017, 7: 43455.
[87] Fraile A, Garcíaarenal F, Carr J P, Loebenstein G. The coevolution of plants and viruses: resistance and pathogenicity., 2010, 76: 1–32.
[88] Ng J C K, Perry K L. Transmission of plant viruses by aphid vectors., 2004, 5: 505–511.
[89] Nault L R. Arthropod transmission of plant viruses: a new synthesis., 1997, 90: 521–541.
[90] Salvaudon L, Mescher M C. Outcomes of co-infection by two potyviruses: implications for the evolution of manipulative strategies., 2013, 280: 20122959.
Sugarcane PsbS subunit response toinfection and its interaction with 6K2 protein
ZHANG Hai, LIU Shu-Xian, YANG Zong-Tao, WANG Tong, CHENG Guang-Yuan, SHANG He-Yang, and XU Jing-Sheng*
Sugarcane Research & Development Center, China Agricultural Technology System, Fujian Agriculture and Forestry University / Key Laboratory of Sugarcane Biology and Genetic Breeding, Ministry of Agriculture and Rural Affairs / Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops, Fuzhou 350002, Fujian, China
Non-photochemical quenching (NPQ) is the main mechanism of photoprotective regulation in higher plants. The PsbS subunit of Photosystem II (PSII) plays a key role in NPQ. The involvement of PSII PsbS subunit in(SCMV) infection of sugarcane (spp. hybrid) has not been reported. In the previous research, we cloned the coding sequence of the PsbS subunit from sugarcane and designated it as.had an open reading frame (ORF) length of 798 bp and encoded a protein of 265 aa. Bioinformatics analysis showed that ScPsbS was a stable hydrophobic protein with chloroplast localization signals and four transmembrane domains. The ScPsbS protein possesses a typical domain of PsbS protein. Phylogenetic tree analysis showed that ScPsbS was divergent between monocotyledons and dicotyledons, or C3plants and C4plants. Subcellular localization analysis showed that ScPsbS was located in chloroplasts and partially colocalized with SCMV-6k2 in chloroplasts. The interaction of ScPsbS with the SCMV-6K2 was further confirmed by bimolecular fluorescence complementation assays (BiFC).gene showed obvious tissue specificity in sugarcane tested by real-time quantitative PCR analysis.gene had highest expression in mature leaves, followed by immature leaves and leaves beginning to senesce, and hardly expressed in stems and roots. The expressionofgene was significantly affected by SCMV infection, with significant upregulation in the early stage of SCMV infection, and no significant affection in the later stage of SCMV infection.
sugarcane; PsbS subunit;; 6K2, light protection
10.3724/SP.J.1006.2020.04030
本研究由国家自然科学基金项目(31971991)和福建农林大学科技创新基金项目(CXZX2018026)资助。
This study was supported by the National Natural Science Foundation of China (31971991) and the Science and Technology Innovation Project of Fujian Agriculture and Forestry University (CXZX2018026).
徐景升, E-mail: xujingsheng@126.com
E-mail: zhanghai940410@163.com
2020-02-10;
2020-04-15;
2020-04-27.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200427.0836.008.html

