山羊副流感病毒3型NP蛋白的截短表达及间接ELISA方法的建立
陈金龙,黄兴军,郝胜楠,张德普,王金良,沈志强*
(1.山东省滨州畜牧兽医研究院,山东 滨州 256600;2.山东绿都生物科技有限公司,山东 滨州 256600;3.山东省惠民县畜牧兽医局,山东 惠民 251700;4.山东省东营市河口区畜牧业发展服务中心,山东 东营 257000;5.滨州学院,山东 滨州 256600)
我国是养羊大国,羊肉产量居世界首位,随着养殖规模的不断扩大,因疫病造成的经济损失越发明显。羊副流感病毒3型(caprine parainfluenza virus type 3,CPIV3)是引起山羊、绵羊上呼吸道感染的核心病原之一,同牛副流感病毒3型(bovine parainfluenza virus type 3,BPIV3)一样均属于副黏病毒[1-2]。CPIV3一年四季均可引发羊发病,多发生于早春、晚秋和寒冷的冬季,特别是气温突然降低的时候更容易发病。病毒的主要传播方式是呼吸道传播,也可以通过粪便、乳汁等接触传播;主要症状表现为鼻塞、流涕、咳嗽、发热、羊全身无力,免疫力强的羊常可以自愈,免疫力弱的羊往往会死于继发的肺部感染[3-5]。近年来,CPIV3在我国羊群中的发病率较高,由于没有可用于预防疾病发生的疫苗,常常引起抵抗力较弱羊的大量死亡,给养殖户带来了巨大的经济损失。
CPIV3包括核衣壳蛋白(NP)、磷蛋白(P)、血凝素-神经氨酸酶蛋白(HN)、基质蛋白(M)、融合蛋白(F)、大分子结构蛋白(L)等6个结构蛋白[6];其中,NP蛋白是CPIV3粒子中含量最多的蛋白,基因全长约1 545 bp,编码约515个氨基酸,该蛋白具有很好的免疫原性[7-9]。本试验截短表达了CPIV3的NP蛋白并建立了CPIV3的ELISA抗体检测方法,旨在用于CPIV3血清学的流行病学调查,为预防控制该病的流行发生提供数据支持和物质保障。
1 材料与方法
1.1 菌株、细胞、质粒及主要试剂大肠杆菌DH5α和BL21感受态细胞购自北京全式金生物技术有限公司;pET28a(+)原核表达质粒由本实验室保存;RNA提取试剂盒、DAB底物显色液、IPTG、DL2000 DNA Marker、质粒小量提取试剂盒、DNA片段回收试剂盒为北京百泰克公司产品;一步法RT-PCR扩增试剂、T4DNA Ligase、BamHⅠ、XhoⅠ 限制性快切酶为大连宝生物公司产品;His-Trap标签蛋白层析柱购自GE公司;CPIV3阴、阳性血清、羊传染性脓疱、山羊痘病毒、小反刍兽疫、羊口蹄疫阳性血清由本实验室鉴定保存;待检血清为山东及周边等地区6个羊养殖区送检样品。
1.2 CPIV3 NP截短基因扩增参照NCBI中CPIV3基因序列(GenBank登录号:NC_028362.1),经DNAstar软件分析后选取807 bp大小的DNA片段,使用Primer 6.0软件设计2条引物。CPIV-F:5′-CGCGGATCCTCATTTGATACATTCAGT-G-3′;CPIV-R:5′-CGGCCTCGAGG-ATAGTGTTAAAGAAGGAA-3′。扩增片段约807 bp,分别在上、下游引物5′端引入BamHⅠ、XhoⅠ酶切位点(下划线)。使用RNA提取试剂盒提取病毒总RNA后,按如下体系加样:2×RT-PCR buffer 12.5 μL,酶混合液1 μL,引物CPIV-F/R各0.5 μL,RNA模板2 μL,灭菌水8.5 μL。扩增程序如下:50℃ 30 min,94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环;72℃延伸5 min,10℃终止。PCR产物经1.0%琼脂糖凝胶电泳鉴定,并经胶回收试剂盒回收后备用。
1.3 pET28a(+)/NP原核表达载体的构建BamHⅠ、XhoⅠ双酶切1.2中PCR产物回收片段及pET28a(+)原核表达载体,经再次回收、连接、转化筛选后最终获得重组表达质粒,命名为pET28a(+)/NP。经鉴定后的阳性克隆送通用生物系统(安徽)有限公司测序。
1.4 NP截短基因的诱导表达及鉴定将测序正确的pET28a(+)/NP重组载体转化至BL21大肠杆菌感受态细胞中,37℃、180 r/min培养至D600 nm为1.0左右,加入终浓度为1.0 mmoL/L的IPTG后在相同条件下继续培养5 h,对诱导后的重组工程菌进行SDS-PAGE分析鉴定。
将NP蛋白稀释到10 mg/L,每个硝酸纤维素膜圈内滴入20 μL(约1 μg蛋白),置于37℃至硝酸纤维素膜彻底干燥固定,经5%的BSA封闭30 min后, TBST洗膜3次,每次5 min;取出NC膜放置于干净的平皿上,在每个压圈中间分别滴加20 μL CPIV3阳性血清及阴性血清(1∶50稀释),作用5 min 后用TBST洗膜4次,每次5 min;取出NC膜将整条NC膜放于1∶5 000倍稀释的兔抗山羊IgG-HPR中作用5 min,dot-ELISA试验分析融合表达蛋白的反应原性。
1.5 间接ELISA抗体检测方法的建立
1.5.1抗原包被浓度及一抗稀释度的确定 以纯化的截短NP基因融合蛋白包被酶标板,CPIV3阴阳性血清抗体作为检测抗体进行ELISA检测。蛋白以100 μL/孔,按照16.0,8.0,4.0,2.0,1.0,0.5 mg/L 6个梯度在37℃下包被1 h,CPIV3阳性、阴性血清分别以l∶10,l∶20,l∶40,l∶80,l∶160,1∶320倍稀释作为一抗,利用正交试验设定方阵滴定,确定蛋白最佳包被量及一抗的最佳浓度。依据是阳性血清D450 nm值(P)>1.0,阴性血清D450 nm值(N)<0.2,选取P/N值最大的组合来确定最佳蛋白包被量及一抗的最佳稀释倍数。
1.5.2封闭液及封闭时间的确定 基于1.5.1条件下,分别用15%的牛血清、猪血清、马血清、鸡血清在37℃下封闭 30,60,90,120 min进行方阵滴定试验,确定最佳封闭液及封闭时间。
1.5.3酶标抗体浓度及反应时间的确定 在确定好的以上条件下,HRP标记兔抗羊IgG抗体分别以1∶2 000,l∶4 000,1∶6 000,1∶8 000倍稀释后滴加100 μL/孔,37℃条件下分别反应15,30,45,60 min,按照1.5.1中依据确定酶标抗体的工作浓度及反应时间。
1.5.4显色时间的确定 在确定好的以上条件下,于37℃条件下显色时间分别为4,6,8,10,12,15 min,按照1.5.1中依据确定最佳的显色时间。
1.6 特异性测试用该方法分别对羊传染性脓疱、山羊痘病毒、小反刍兽疫、羊口蹄疫阳性血清进行检测,同时设CPIV3阴阳性对照血清,以此评价该检测方法的特异性。
1.7 敏感性测试将CPIV3阳性血清梯度稀释并做4个重复,初始梯度为1∶40,倍比稀释到1∶10 240,用建立的ELISA检测方法进行检测,测定D450 nm值,确定检出抗体阳性最低稀释倍数。
1.8 重复性测试采用优化的间接ELISA方法条件,使用同一批包被的平板在不同的时间对3份CPIV3抗体阳性血清,1份阴性血清,进行3次重复测试,进行批内重复性试验。制备3批ELISA平板分别对同一血清进行批间重复性测试,收集数据,并进行统计学分析。
1.9 临床羊血清样本检测应用该方法对送检的6个地区共计745份临床血清进行检测,调查CPIV3抗体阳性率。
2 结果
2.1 CPIV3 NP基因扩增及重组质粒的构建经PCR扩增出约807 bp的片段,与预期相符(图1)。回收后NP基因片段连接至pET28a(+)原核表达质粒,pET28a(+)/NP经BamHⅠ、XhoⅠ双酶切后可见约807 bp的目的条带(图2),DNA序列测序进一步证实重组质粒构建成功,无碱基突变和缺失。
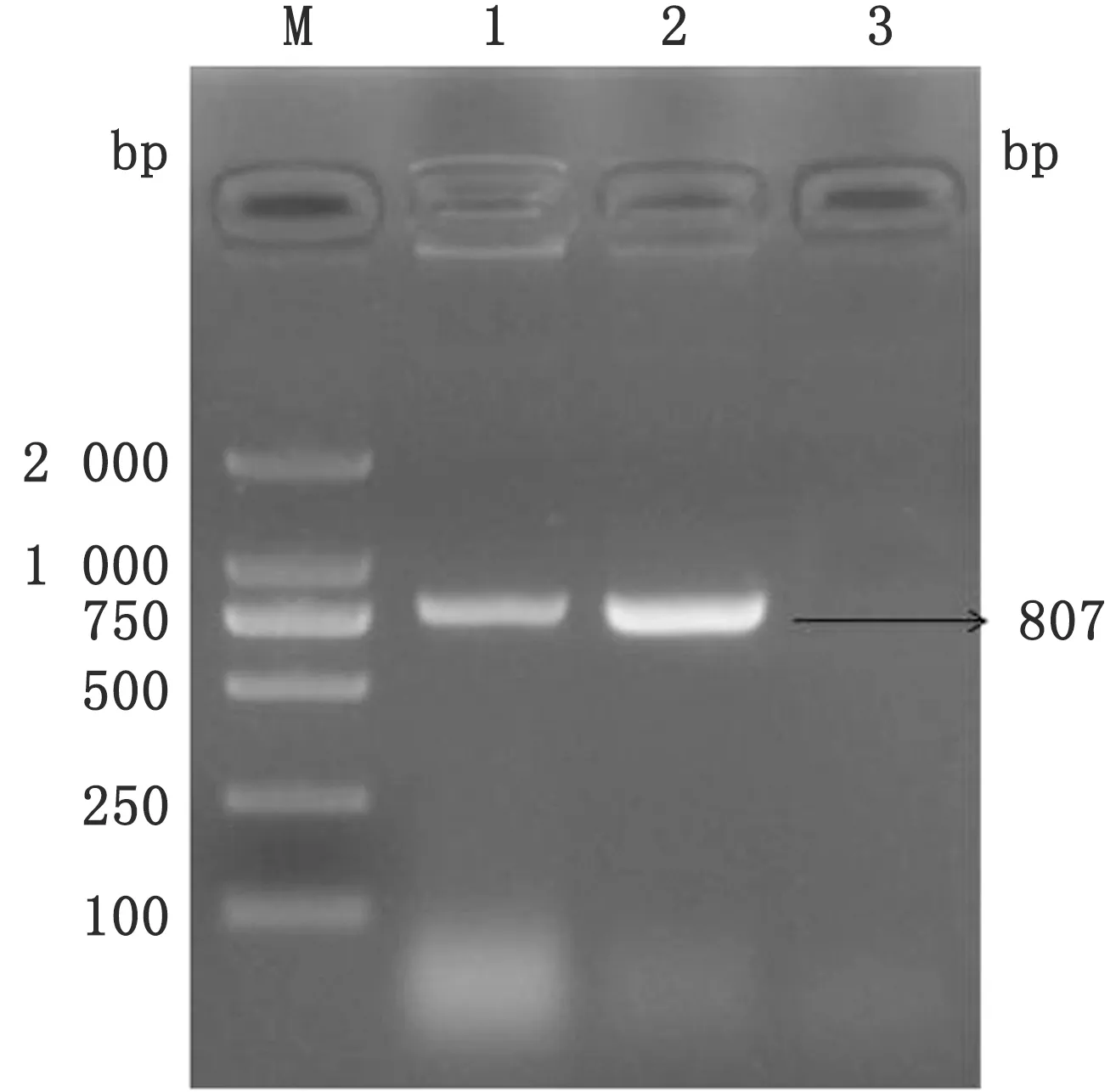
图1 截短NP基因的PCR扩增结果 M.DL2000 DNA Marker;1,2.截短NP基因的扩增产物;3.阴性对照
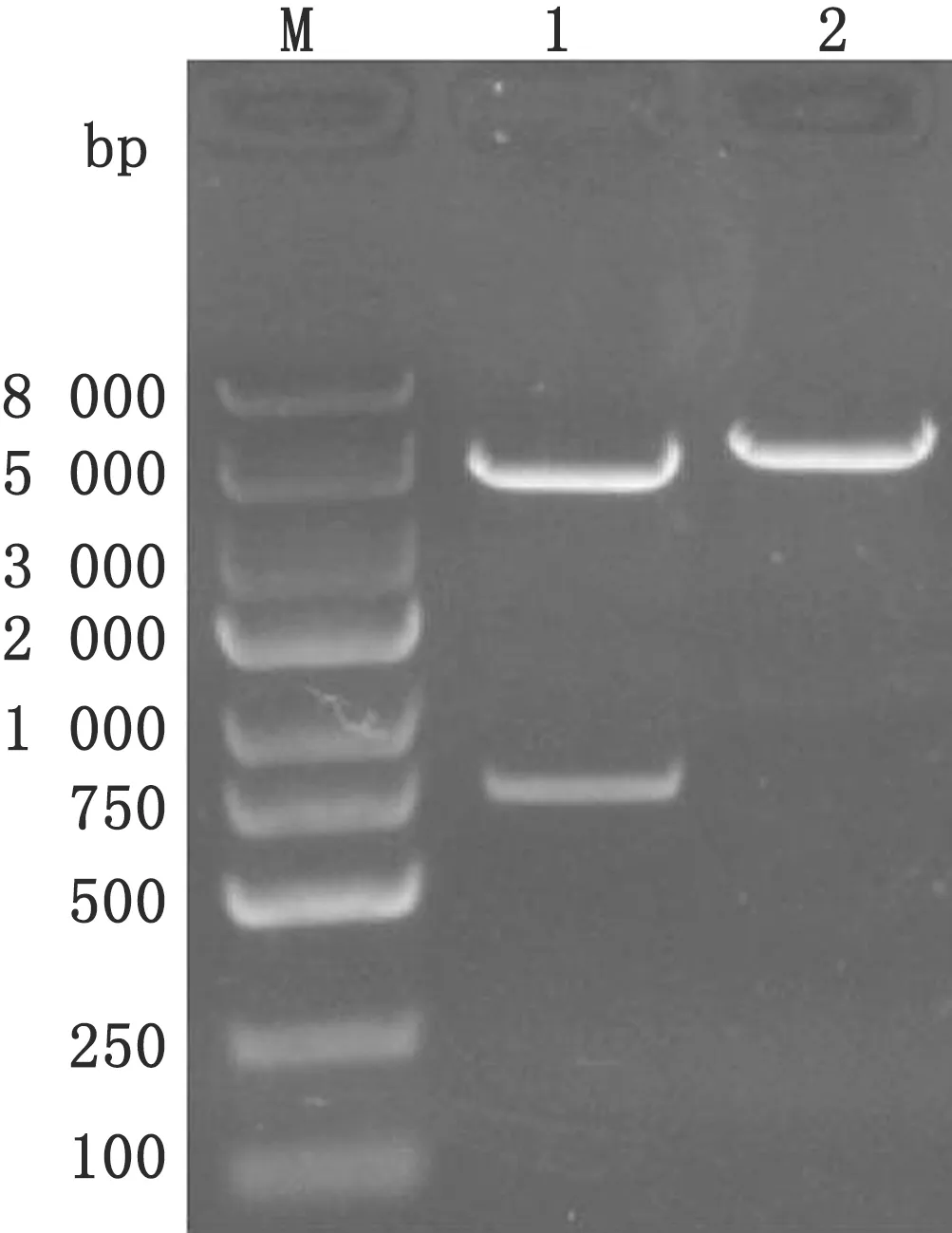
图2 pET28a(+)/NP重组质粒的酶切鉴定 M.DL2000 DNA Marker;1.BamHⅠ、XhoⅠ 双酶切鉴定;2.BamHⅠ单酶切鉴定
2.2 pET28a(+)/NP诱导表达及鉴定重组质粒pET28a(+)/NP转化大肠杆菌BL21(DE3)感受态细胞后,经终浓度为 1 mmol/L IPTG在37℃下诱导表达5 h后,SDS-PAGE电泳显示在约39 000处出现目的条带,与预期大小相符;基因获得有效表达,表达蛋白主要以包涵体形式存在;通过 His-Trap亲和层析纯化的方法,成功纯化到NP蛋白,纯化蛋白经BCA法测定质量浓度为1.2 g/L。dot-ELISA结果表明该蛋白具有良好反应原性(图3)。

图3 重组蛋白NP的表达电泳及dot-ELISA鉴定 M.蛋白质Marker;1.诱导前重组菌;2.诱导后重组菌;3.诱导后上清;4.诱导后沉淀;5.纯化NP蛋白;6.NP蛋白的dot-ELISA鉴定(A,B.NP蛋白与CPIV3阳性血清作用;C,D.NP蛋白与CPIV3阴性血清作用)
2.3 抗体间接ELISA检测方法最优条件的确定经方阵试验优化后,确定间接ELISA方法条件详见表1。
2.5 特异性测试用该方法分别对羊传染性脓疱、山羊痘病毒、小反刍兽疫、羊口蹄疫阳性血清进行检测,同时设CPIV3阴阳性对照血清,其D450 nm值均在0.310以内,该检测方法具有良好的特异性。
2.6 敏感性测试用建立的ELISA检测方法对已知CPIV3阳性血清进行检测,当血清稀释到1∶5 120 时抗体检测仍为阳性,表明该方法具有较高的敏感性。
2.7 重复性测试批内重复性试验表明该检测方法的变异系数(CV)为3.24%~6.65%,批间变异系数为3.45%~9.87%,表明该方法具有较好的重复性(表2)。

表1 抗体间接ELISA检测方法的反应条件

表2 重复性试验结果 D450 nm
2.8 临床羊血清样本检测应用该方法对6个地区送检的共计745份临床血清进行检测,共检出108份阳性,检出率为14.50%(表3)。
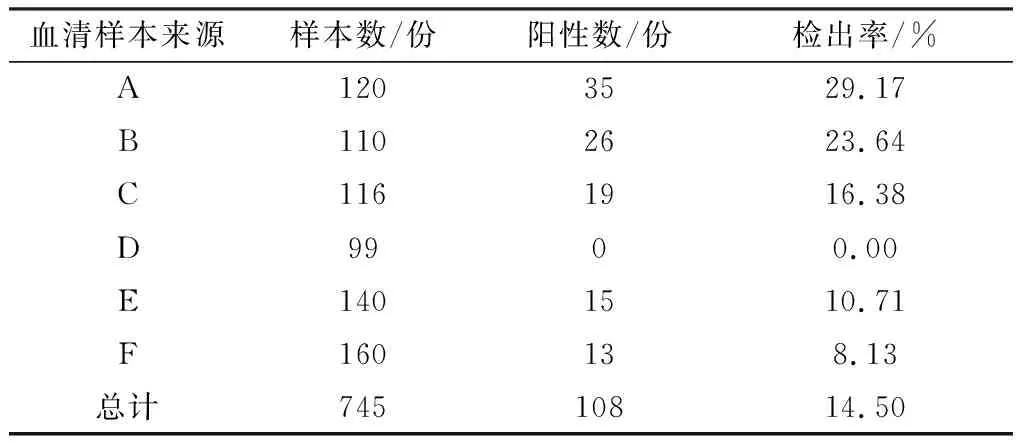
表3 临床CPIV3血清样本测试结果
3 讨论
改革开放以来,我国的畜牧业已成为农村经济的一个重要支柱产业。特别是近20年来,我国养羊业发展迅速,已跨入世界生产大国先列。目前,中国绵羊和山羊的饲养量、出栏量、羊肉产量、生绵山羊皮产量、山羊绒产量均居世界第一位。我国农业部规定上报的羊病种类一共有28种,其中一类病4种、二类病10种、三类病14种,每年因动物疾病给养羊产业造成巨大的经济损失。
副流感(parainfluenza)自20世纪50年代在美国首次被发现至今,给全世界各国畜牧养殖业特别是养牛业带来极大的经济损失,甚至给人类带来了严重的生命威胁,该疾病的防控现在仍然是世界性难题[10]。自我国首次分离到山羊副流感病毒JS2013株并证实分离株对豚鼠及山羊具有很强的致病性以来,国内也有一些学者对CPIV3进行过相关研究,但研究相对较少[5,11]。毛立[12]和周天赐[13]于2015年用纯化CPIV3全病毒抗原免疫小鼠后制备单克隆抗体,筛选到了对CPIV3具有阻断作用的2株单抗细胞株,建立了针对CPIV3的阻断ELISA抗体检测方法,并证实CPIV3在江苏、安徽、新疆等全国16个省份的羊群中普遍存在,并且具有较高的抗体阳性率。邓加武等[14]于2015年对CPIV3的HN基因进行了原核表达并纯化HN蛋白,最终筛选到了3株能够特异性识别CPIV3的单克隆抗体。这些研究均为副流感新型诊断技术的研究提供了物质基础。CPIV3还没有商品化的疫苗,抗体检测方法可以用于该病的快速诊断。酶联免疫吸附试验以其适于大量样本的快速检测得到广泛的应用。本试验选取了CPIV3核衣壳蛋白(NP)作为研究目的蛋白,因其具有高度保守性;同时为了增强方法的特异性,本试验利用生物信息学软件DNAstar对全长1 545 bp的NP基因进行了抗原分析,截取了抗原性最强的一段DNA作为目的基因(807 bp),进行克隆、表达纯化,作为检测方法的包被抗原,相对于全基因表达增加了检测方法的特异性。纯化的蛋白经dot-ELISA试验检测具有较好的抗原性,研究数据分析表明所建立的方法具有特异性强、敏感性高、稳定等优点;检测用时80 min,相比较阻断ELSIA方法具有省时的特点[3,12];采用该方法对临床送检的745份羊血清进行检测,其抗体阳性率为14.5%。本试验结果表明,所建立的间接ELISA检测方法可用于CPIV3抗体检测,为羊副流感3型的流行病学调查提供了技术支持。

