合成生物系统构建与绿色生物“智”造
秦磊,俞杰,宁小钰,孙文涛,李春,2
(1 北京理工大学化学与化工学院化学工程系生物化工研究所,北京100081; 2 清华大学化学工程系生物化工研究所/工业生物催化教育部重点实验室,北京100084)
引 言
化石资源短缺和环境破坏问题的日益加剧促使人们寻求一种绿色可持续的生物制造方式来生产燃料、药品、大宗化学品和精细化学品。微生物细胞工厂的出现为高效且可持续的生产提供了新方法。在代谢工程、合成生物学和系统生物学的协同发展下,通过微生物细胞工厂生产生物燃料、药品、精细化学品等均取得了重大进展[1−5],利用大肠杆 菌(Escherichia coli)[6−7]、谷 氨 酸 棒 杆 菌(Corynebacterium glutamicum)[8−9]及 酵 母(yeast)[10−14]等常用的微生物细胞工厂已实现了多种产品的生产。
目前,微生物细胞工厂的构建与优化仍存在着许多挑战。一方面,微生物目标合成途径的强化会受到细胞本身复杂的代谢调控网络的限制。无论是内源途径还是异源途径,常会遇到目标途径通量低、代谢通量不平衡、竞争途径抑制及有毒中间产物积累等问题,从而使细胞生长及生产受到抑制[15]。因此,对代谢途径进行动态调控使目标产物的产量最大化,是优化微生物细胞工厂的一致方向。另一方面,工业发酵环境存在各种胁迫因素,如高温、氧化、pH波动、高渗透压、有机溶剂、重金属等因素,都会对微生物的生长和生产造成影响[16−22]。工厂对发酵条件的严格控制虽然可以提高菌株生产的稳定性,但同时会增加大量成本,包括使用冷却水、酸碱、过滤装置等,并且增加了对环境的破坏。因此,提升工业菌株的鲁棒性是提高产量和降低成本的根本解决方案。
提高生物制造过程的智能性是解决上述问题的重要途径。生物“智”造,即智能化的生物制造,是指微生物根据发酵的环境变化或发酵的不同阶段进行基因、转录、翻译或蛋白质水平的调节,从而实现更好的生长或生产。生物制造的智能化可以使微生物动态地调整自身,使其向更有利的方向发展。例如,在发酵生产一些毒性产物的过程中,要使菌株在发酵前期积累生物量,从而尽量减少产物对细胞的毒害,在中后期再开始合成产物并提高产量。又如,面对工业发酵罐中温度和pH 等的局部波动,要使菌株在胁迫环境下抵抗干扰,而在无胁迫时减少抗逆系统的能量消耗。

图1 生物“智”造包括的主要内容Fig.1 The brief contents of intelligent biological manufacturing
本文将从蛋白质设计的智能化、生物传感的智能化、代谢调控的智能化、菌株进化的智能化及发酵过程的智能化五个方面来分别介绍(图1)。随着合成生物学和代谢工程的发展,生物“智”造的智能化程度也将逐步加深,为提高发酵产量和节能减排做出重要贡献。
1 蛋白质设计的智能化
通过定向进化获得目标功能的蛋白质有较强的随机性,而依靠计算机算法的蛋白质设计则体现出智能性。利用大分子建模软件Rosetta 等可以实现蛋白结构预测、分子对接、结构设计和实验数据建模等任务[23],并且随着软件功能的开发、计算机运算能力的提高以及设计方法的完善[24],模型预测的准确度也将进一步提高。受限于人们目前的知识水平,完全从头设计出目标催化功能的酶还无法实现,但从头设计出具有某些调节功能的调节蛋白已取得了一些重要突破。
1.1 蛋白质变构调节的智能化
蛋白质的变构调节功能在生物中广泛存在,在生物过程调控中起到非常重要的作用。Baker 等[25]以α−螺旋为结构单元设计出了一系列蛋白质调节元件。α−螺旋的模块化程度较高,因此便于从头设计和预测。通过Rosetta 设计的97对α−螺旋异源二聚体中,有65 对经实验验证形成了预期的二聚体[25],这表明尽管目前的计算机智能设计能够预测正确大部分结果,但方法和技术仍有待完善。
研究者基于α−螺旋的异源二聚体或同源三聚体结构,设计出了pH 调控的二/三聚体解聚过程:在α−螺旋中插入组氨酸残基,使组氨酸残基在酸性条件下质子化,增强了静电和空间排斥作用,从而使多聚体解聚[图2(a)];由于α−螺旋单体能够破坏磷脂膜,因此用该元件可实现pH 诱导的磷脂膜降解[26]。另外,对α−螺旋的长度和亲/疏水性进行设计,可实现酸性条件诱导α−螺旋在膜上聚合形成通道蛋白[27]。在自然界中也会发现一些pH 诱导的蛋白质变构。例如,李斯特菌溶血素O 是一种穿孔毒素,它的突变体Y406A 具有很强的pH 依赖性,只有在低pH 下才能形成通道[28]。通道的形成还受一些特异性蛋白的抑制,可受pH 和抑制蛋白的双重调节[29]。
在α−螺旋同源三聚体的基础上,研究者设计了一套蛋白质开关:通过加入“钥匙”释放“笼子”中的“门闩”[图2(b)]。将“门闩”替换为降解决定子(能够被泛素蛋白识别从而被降解),实现了目标蛋白的诱导降解,用此降解开关实现了转录因子、Cas 蛋白以及信号传递途径的调控[30−31]。

图2 蛋白质变构调节的从头设计(a)pH诱导的α−螺旋同源三聚体的解离[26];(b)基于α−螺旋的蛋白质开关[30]Fig.2 De novo design of tunable conformational changes of proteins(a)pH−induced dissociation of α−helix homotrimer[26];(b)α−helix based protein switch[30]
利用不同α−螺旋异源二聚体之间的正交性[25],研究者设计出了各种蛋白质的逻辑门[32],这些逻辑门的功能几乎不受宿主种类的影响,极大地丰富了合成生物学的可用元件。
1.2 酶催化的智能化
相较于α−螺旋的设计,酶的催化活性口袋的从头设计则困难得多,因为设计对于小分子配体具有高度亲和性和高度选择性的蛋白质仍无法十分精准。研究者根据配体结合蛋白的基本设计原则,得到了能够结合地高辛、孕酮和β −雌二醇的蛋白质[33]。
对天然的酶的智能化改造是目前更可行的方法。一些酶的杂泛性(promiscuity)使其催化的底物或产物不专一,使人们可以对其结构进行微调,实现利用不同的底物生产不同的产物。例如,植物P450 酶在微生物中表达时通常表现出杂泛的区域选择性和化学选择性,可同时氧化不同的底物合成多种结构类似物[34]。基于同源建模与分子对接分析的理性设计,利用一个杂泛性的P450酶构建了一系列具有特定功能的突变体,可识别具有不同性质的底物并具有可控的氧化过程,实现稀有甘草三萜的特异性合成。此外,对影响P450酶氧化选择性的关键因素进行了研究,实现了特定底物的自动选择和特定产物的选择性合成,从而为进一步实现酶活性口袋的智能设计提供了基础[图3(a)][35]。
另外,许多酶在细胞中都显现出多种催化活性,并且催化活性受一些环境因素的影响。例如,DesK 是枯草芽孢杆菌的一个膜蛋白,在低温(25°C)时,其细胞质催化结构域表现出蛋白激酶活性,将转录因子DesR 磷酸化;在高温(37°C)时,催化结构域表现出磷酸酶活性,将DesR 去磷酸化[图3(b)]。这是由于低温时细胞膜流动性差,高温时细胞膜流动性强,细胞膜的流动性使其厚度发生一些改变,影响蛋白的跨膜结构域及连接肽的构象变化,最终影响催化结构域的构象改变[36]。
2 生物传感的智能化
生物传感是菌株智能化的基础。合成生物学中的生物传感器(biosensor)是指能够感应某种物理、化学或生物信号的生物学元件。生物传感器具有两种功能,一是“传”,即传递信号,起到调节控制的作用,如转录调节元件和翻译调节元件;二是“感”,即感应信号,可以理解为信号的转换输出,如具有感应功能的荧光蛋白等。
2.1 转录调节元件作为生物传感器
启动子是调节基因表达的最主要最直接的调控元件,其与转录因子的相互作用可实现多种生物传感器的功能,实现对基因转录的开关或强度调节。下面介绍响应几种重要因素的转录调节元件类生物传感器。

图3 酶催化的智能化(a)利用酶的杂泛性合成不同产物[35];(b)通过调节温度改变酶的性质[36]Fig.3 Intelligence of enzymes(a)synthesis of various products by enzyme promiscuity[35];(b)changing properties of enzymes by regulating temperature[36]
2.1.1 糖或糖苷类 微生物中的碳源诱导机制常被用于基因表达的开关,例如,原核细胞中经典的异 丙 基 硫 代 半 乳 糖 苷(isopropyl β −D−thiogalactoside,IPTG)诱导[37]、阿拉伯糖诱导[38]、木糖诱导[39]等,酵母中经典的半乳糖诱导[40−41]等。这些调控元件强度高、稳定性好,但是在发酵过程中需要一定的操作,不适合大多数工业发酵的需求。
2.1.2 酸 在原核生物中,Pasr是常用的质子诱导的启动子,在大肠杆菌中受PhoQP−RstBA 信号延迟级联系统的调控,在pH 低于5时强度明显升高[42−43],对其转录因子结合位点保守序列的突变可获得一系列诱导强度不同的启动子库[44]。PcadBA是在大肠杆菌中发现的另一个酸诱导启动子,它受到膜信号蛋白CadC 的激活。在培养基中缺少赖氨酸时,赖氨酸转运蛋白LysP 与CadC 的跨膜域结合,抑制酸信号向启动子传递。因此,截除CadC的跨膜域可消除赖氨酸对PcadBA的干扰[45]。此外,研究者在大肠杆菌中开发了一个乙酸诱导的启动子PglnAP2s,通过对初始启动子+1 位置下游序列的截除提高了其严谨性和灵敏度[46]。
在酵母中,对转录调节元件类型的生物传感器的研究还较少。研究者表征了一些启动子对酸或高温的响应情况,但都缺乏较高的强度和严谨性[47]。通过人工启动子的设计和优化,研究者在一个酸诱导型启动子PYGP1的基础上进行改造,将核心启动子区进行替换以及将上游激活序列(upstream activating sequence,UAS)中的转录因子结合位点进行替换和插入,获得了一个在酸性条件下具有高强度的人工合成启动子PCCW14[48]。
2.1.3 代谢物 小分子代谢物的生物传感器可以通过理性设计的方法实现,主要思路是寻找能与目标代谢物产生相互作用的转录调节因子。研究者对转录调节因子进行了系统性的整理,在数据库中挖掘了一系列需要配体(小分子代谢物)参与的转录调节因子及其作用的启动子,通过验证得到了15种代谢物诱导的启动子,且验证了它们之间具有很好的正交性,并且在多种原核细胞中对它们进行了验证[49]。
研究者发现来自枯草芽孢杆菌的转录因子FapR对顺式调节元件fapO具有抑制作用,而对大肠杆菌的启动子PGAP有激活作用,并且丙二酰辅酶A可与FapR 结合分别抑制对fapO 和PGAP的作用,因此,分别得到了丙二酰辅酶A 诱导与抑制的启动子系统[50−51]。
PhucR是在耐辐射球菌(Deinococcus radiodurans)中发现的一个尿酸诱导启动子,尿酸能与HucR 结合,促进PhucR的转录。对HucR 结合口袋的关键位点进行饱和突变,筛选得到能够结合香草醛和阿魏酸的突变体HucR−V7,实现对香草醛和阿魏酸的感应。并对PhucR的−10区进行饱和突变,进一步提高了香草醛的诱导强度[52]。
Keasling 等[53]通过理性设计开发了响应萜类合成重要前体—— 异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)的人工生物传感器。在大肠杆菌中,用IPP 异构酶Idi与阿拉伯糖转录因子的DNA结合域(AraC−DBD)融合,在无IPP 时,此人工转录因子与阿拉伯糖结合并诱导启动子PBAD;在有IPP时,Idi形成二聚体,无法与启动子结合,基因停止表达。在酵母中,用Idi 与转录因子Gal4 的DNA 结合域(DBD)、DNA 激活域(AD)分别融合,在有IPP 时,Idi 二聚体使DBD 与AD 靠近,激活RNA 聚合酶使PGAL10启动[图4(a)][53]。由于酵母与大肠杆菌转录机制不同,在酵母中构建完整的系统更为困难。此方法可同样用于构建其他物质的人工生物传感器,但需要对灵敏度、严谨性和专一性进行精细的调节。利用蛋白质从头设计的方法,理论上可以得到任何目标化合物的传感器:将计算机设计的配体结合蛋白分别融合DBD和AD[54],用此方法实现了地高辛和孕酮的感应[55]。
另一种方法是从转录组学中挖掘响应的启动子。 研究者对积累法尼基焦磷酸(farnesyl pyrophosphate,FPP)的菌株及不积累FPP 的菌株进行转录组分析,发现一些显著上调与下调的基因,因此这些基因的启动子可作为天然的FPP生物传感器,例如PgadE为FPP 抑制,PyrbL和PrstA为FPP 诱导[56]。此思路可应用于挖掘各种诱导型转录调控元件。
2.1.4 温度 感应温度的启动子一般源于微生物自身的热激蛋白或冷激蛋白的启动子。在酿酒酵母(Saccharomyces cerevisiae)中,研究者表征了热激蛋白启动子PHSP12和PHSP26在高温等条件下的启动强度,其在某些条件下能够受到高温的诱导[47]。通过转录组挖掘到了一系列高温诱导型的启动子,提供了更为全面的启动子响应高温变化的数据库[57]。但是,若想在酿酒酵母中实现控制更加严谨的启动子,还需进一步对启动子进行人工改造与优化。
λ 噬菌体中的pL/pR−cI857 系统常被用作大肠杆菌中的温度诱导开关。在低温时,噬菌体蛋白cI857 形成二聚体,结合在启动子的oL 或oR 区域,阻碍RNA 聚合酶与启动子结合;在高温时,cI857 解离,使启动子开启转录[58]。
此外,研究者在大肠杆菌中构建了一个控制严谨的低温诱导系统。烟草花叶病毒蛋白酶TEV 能对特定的氨基酸序列进行切割,在来自于噬菌体434 的转录抑制因子cI434 中插入TEV 的切割位点。通过定向进化得到低温抑制的cI434 突变体及高温抑制的TEV 突变体。因此,在低温下,TEV 活性高,高效切割cI434,且cI434 活性低,不会抑制PR启动子,目标蛋白表达;在高温下,TEV 失活,且cI434 活性高,抑制PR启动子,目标蛋白不表达。在此基础上,对目标蛋白融合一个蛋白酶mf−Lon 靶向的标签,并且用启动子PR联合TetR 抑制因子抑制mf−Lon 的表达,这样使目标蛋白在高温下可被快速降解,使开关更加严谨[图4(b)][59]。
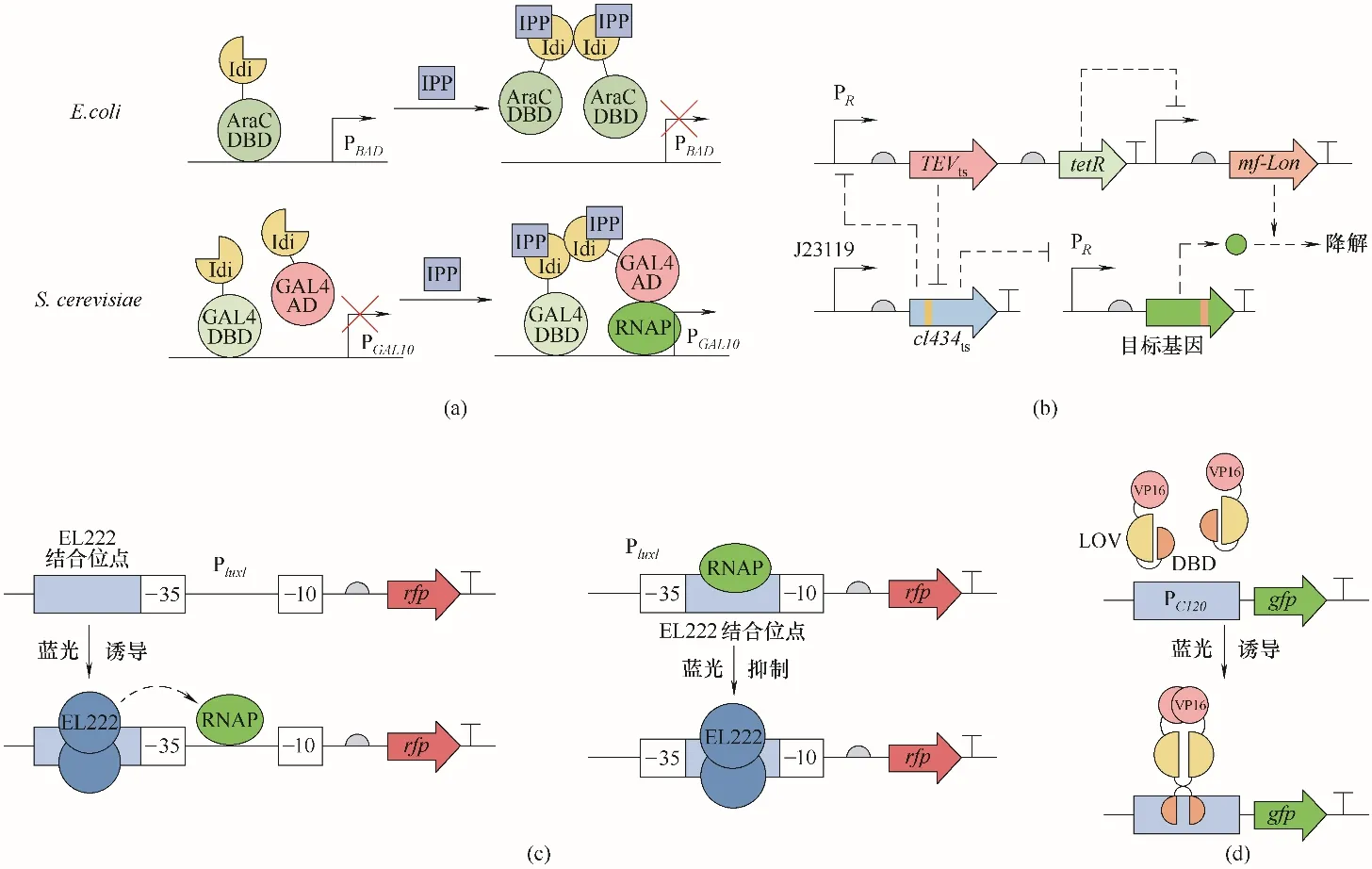
图4 转录调节元件作为生物传感器(a)感应IPP的转录调节元件的理性设计[53];(b)低温诱导表达系统[59];(c)大肠杆菌中光诱导和光抑制表达系统[64];(d)酿酒酵母中光诱导表达系统[65]Fig.4 Transcription regulatory elements as biosensors(a)rational design of IPP−response element[53];(b)cold−induced expression system[59];(c)light−induced and light−repressed expression system in E.coli[64];(d)light−induced expression system in S.cerevisiae[65]
2.1.5 细胞密度 群体感应(quorum sensing,QS)起到在细胞之间进行调控的作用。细胞分泌的信息素在达到一定浓度时会通过磷酸化级联传递到一些启动子,从而调控基因表达水平,例如枯草芽孢杆菌中发现的启动子PsrfA[60],对PsrfA保守序列的优化以及上游序列的替换和截除,可以提高启动子的诱导强度[39]。在微生物中常用海洋细菌费氏弧菌(Vibrio fischeri)中发现的LuxI−LuxR 系统进行群体感应调控。LuxI 可催化合成一种信号分子酰基高丝氨酸内酯(acylhomoserine lactone,AHL),随着AHL 浓度的升高,AHL 结合并激活转录调控因子LuxR,从而诱导启动子PluxR[61−62]。
2.1.6 光 在深海细菌斜视红杆菌(Erythrobacter litoralis)中存在一种光敏DNA 结合蛋白EL222,此蛋白包含N 端的光−氧−电压(light−oxygen−voltage,LOV)结构域和C 端的DNA 结合域,当接收蓝光时,EL222可形成二聚体并结合特定的DNA 序列[63]。研究者在大肠杆菌中构建了蓝光诱导的启动子系统。将PluxI启动子中的反向重复序列替换为EL222 的结合序列,因此EL222 二聚体可结合在PluxI的−35 区并招募RNA 聚合酶,开启转录。同时构建了蓝光抑制的 启 动 子 系 统,将PluxI的−35 至−10 序 列 替 换 为EL222 的结合序列,这样二聚体结合在此处抑制了RNA 聚合酶与启动子的结合[图4(c)][64]。研究者在酿酒酵母中也构建了光诱导和光抑制的系统。将EL222与转录激活蛋白VP16的转录激活域融合,当接收蓝光时,融合蛋白形成二聚体结合到启动子PC120上开启基因表达[图4(d)]。将此系统与半乳糖操纵子系统相结合,用蓝光诱导GAL80 的表达,Gal80 最终抑制PGAL1,实现蓝光抑制基因表达的效果[65]。同时,研究者还构建了红光诱导[66]及绿光诱导系统[67−68]。三个系统具有很好的正交性,可以满足多重诱导的需要。
2.2 翻译调节元件作为生物传感器
一些非编码RNA(non−coding RNA,ncRNA)可以对蛋白质翻译进行调控,它们一般会影响核糖体与mRNA 的结合,因此也被称作核糖体开关(riboswitch)。
2.2.1 温度诱导的核糖体开关 在原核生物中,一些ncRNA 形成的茎环结构可结合在一些基因的5′非翻译区(5′−untranslated region,5′UTR),阻碍核糖体的翻译进程,当温度升高后,ncRNA 与DNA 脱离,开启翻译过程。这种ncRNA可称作RNA温度计,解离温度与RNA 温度计的结构是相关的,因此通过设计不同结构的RNA 温度计实现了对不同温度的响应,从而实现在不同的培养温度下表达不同的蛋白[62,69]。
一些基因的5′UTR 本身也会受温度的影响而影响其翻译水平。例如,大肠杆菌中cspA 基因的5′UTR 二级结构受温度影响,在低温时,这段RNA的结构使核糖体更容易进行翻译;而在高温时,RNA的结构改变,使其难以结合核糖体进行翻译[70]。2.2.2 pH 诱导的核糖体开关 研究者在大肠杆菌中发现了一个pH 敏感的RNA 元件(pH−responsive RNA element,PRE),位于alx 基因上游的5′UTR。PRE在酸性条件下(pH5.0),其包含的核糖体结合位点(ribosome binding site,RBS)被覆盖在茎环结构内,无法结合核糖体进行翻译;在碱性条件下(pH8.0),PRE 的结构发生改变,使RBS 暴露出来并能够与核糖体结合,从而开启翻译[71−72]。通过对RBS 的替换和对RNA 聚合酶的优化使PRE 的作用强度更高、泄露表达更低、pH敏感性更高[73]。
2.3 蛋白质作为生物传感器
蛋白质类的生物传感器除了前文提到的pH 诱导的α−螺旋构象变化以外,还包括一些受信号分子调节的荧光蛋白,使其具有在线原位检测细胞内活性氧自由基(reactive oxygen species,ROS)、谷胱甘肽、NAD(P)H 等物质的功能。这些荧光蛋白探针为实时检测细胞生长状态、抗氧化水平和代谢平衡等生理指标提供了重要工具。关于这些荧光蛋白探针的综述可详见文献[74−76]。
另外,蛋白质类的生物传感器还包括光诱导型的蛋白质聚集/解离元件。来自拟南芥的Cry2 光解酶同源域可在蓝光激发下形成寡聚态,通过点突变得到的Cry2olig 可使其聚合度提高,此外,将Cry2 与FUS 蛋白的N 端无序区融合也可提高聚合度,最终得到的融合蛋白FUSN−Cry2olig 可实现灵敏的光诱导聚集[77−79]。通过FUSN−FusionRed−Cry2olig 的蛋白融合,使这一系统在酿酒酵母中可行且可视化[80]。在蓝藻(Synechocystis sp.)中发现的PixD和PixE蛋白组成了蓝光诱导的PixELL 系统。在无光时,PixD 和PixE 形成多聚物;蓝光诱导后,二者解离,PixE 形成单 体,PixD 形 成 二 聚 体[81−82]。在 酿 酒 酵 母 中,将FUSN−FusionRed−PixD 融 合,将FUSN−Citrine−PixE融合,获得了可视化的光诱导解离系统[80]。
3 代谢调控的智能化
代谢调控的智能化是依靠智能调节基因线路来实现的。智能调节基因线路主要由生物传感器和效应基因组成,生物传感器负责接收信号并将信号传递给效应基因,再由效应基因产生作用蛋白,从而实现对信号的反馈(震荡)、增强等调节,或实现其他生物过程。根据智能调节基因线路的作用可分为提高产物产量和提高菌株鲁棒性;根据智能调节基因线路的复杂程度可分为单一基因线路和逻辑门;根据智能调节基因线路的调控方式可分为一般动态调控和自主动态调控。
3.1 一般动态调控
一般动态调控是指在发酵过程中需要人工操作诱导条件来达到调控基因线路及细胞状态的过程。例如,用酸诱导启动子Pasr和低温诱导启动子PcspA分别调控转录因子基因invF 和分子伴侣基因sicA,InvF 与SicA 形成的复合物可激活启动子PsicA,在发酵过程中形成一个双重诱导的“与门”;而用PsicA调控目标基因的反义RNA,则可以抑制目标蛋白的翻译,形成一个“与非门”[44]。
CRISPRa/i 是目前常用于动态调控的工具。研究者在大肠杆菌中构建了由鼠李糖诱导型启动子PrhaPBAD诱导dCas9 来进行转录抑制的CRISPRi 系统。通过dCas9 抑制基因mvaE 和mvaK1 调节了甲羟戊酸途径的代谢通量,使番茄红素的产量增加了8倍[83]。研究者利用脱落酸介导的ABI−PYL1 蛋白质相互作用,设计了两个融合蛋白MCP−ABI和PYL1−VP64,通过添加脱落酸使MCP与VP64融合,进而招募RNA 聚合酶,实现CRISPRa 的动态调控过程[84]。另外,还可以在翻译水平对dCas9 的表达进行调控,在dCas9 基因中引入一个TAG 终止密码子,该位点可被翻译为一个合成型非天然氨基酸L−联苯丙氨酸(L−biphenylalanine,BipA)。当加入BipA 时,TAG可被翻译,从而产生完整的有功能的dCas9 蛋白;当没有BipA 时,翻译会在TAG 处中断,产生截短的无功能的dCas9 蛋白,从而失去对目标基因的抑制作用[85]。
但是,上述这种需要改变培养基成分的调控方式很难用于工业生产,因此需要一些可行的动态调控手段,如光诱导等。用蓝光调控酿酒酵母生产异丁醇,由于乙醇和异丁醇的合成存在竞争前体物丙酮酸的关系,需要抑制乙醇的产生,但乙醇合成途径中的丙酮酸脱羧酶是生长必需的,完全敲除会导致细胞无法生长。因此,设计用蓝光诱导丙酮酸脱羧酶表达,用蓝光抑制异丁醇合成关键基因ILV2 的表达,在发酵前期开启蓝光,使细胞生长,而在中后期关闭蓝光或根据生长提供脉冲光源,这种方法使异丁醇的产量提高了5倍[65]。
VioE 催化生成原脱氧紫色杆菌素(protodeoxyviolaceinate,PTDV),再经VioC 催化生成脱氧紫色杆菌素(deoxyviolacein,DV,粉色)。但PTDV 容易自发被氧化产生前脱氧紫色杆菌素(prodeoxyviolacein,PDV,绿色)。因此,要提高脱氧紫色杆菌素的产量就要精确控制VioE 和VioC。通过光诱导聚集,用Cry2olig 分别与VioE 和VioC 融合,蓝光诱导使VioE 和VioC 拉近距离,这样避免了PTDV 的积累,提高DV 的转化率;类似地,通过光诱导解离,将PixD 和PixE 分别与VioE和VioC融合,在无蓝光下PixD 与PixE 聚合,拉近VioE 和VioC 的距离。此方法使合成DV的特异性提高了18倍[80]。
调节反应温度和pH 等条件控制酶活,可以达到改变催化产物的目的。例如,在阿魏酸转化香草醛的过程中设计了新的不依赖辅酶的催化过程,通过酚酸脱羧酶Pad催化香草醛生成中间产物对乙烯基愈创木酚,再通过芳香双加氧酶Ado 催化产生香草醛。由于受细胞内源的乙醇脱氢酶影响,一部分香草醛转化为了香草醇,为防止这种副反应产生,将反应温度提高至50°C,可使大部分乙醇脱氢酶失活。在提高温度的同时提高pH 至9.5,由于Ado 催化的反应为限速步骤,Ado在碱性下活性更强,且碱性进一步降低乙醇脱氢酶活性,使目标产物香草醛的转化率明显提高。因此,实现了通过温度和pH的调节改变产物比例的目的[86]。
3.2 自主动态调控
自主动态调控是指在发酵过程中不需要人工操作干预,菌株可自动根据发酵条件变化调节自身状态的过程。
3.2.1 自主动态调控在产物合成中的应用 在产物合成的自主动态调控中,常会将积累量高的中间代谢物作为诱导物来负反馈抑制上游代谢途径的基因,正反馈诱导下游代谢途径的基因。例如,在青蒿素前体紫穗槐二烯的生物合成途径中,FPP 为毒性中间产物,它的积累导致细胞生长和生产受到影响。通过前文所述的FPP抑制的启动子和FPP诱导的启动子来分别调控FPP上游途径基因和下游途径基因,分别形成反馈抑制和反馈诱导,通过FPP的量诱导FPP自身的转化,降低了FPP的积累,提高了产物产量。此方法对比传统的利用IPTG 诱导的调控方法更加智能,调控更加准确,产量提高更明显[图5(a)][56]。类似地,在脂肪酸的合成途径中,利用丙二酰辅酶A诱导与抑制的启动子分别对其下游和上游基因进行调控,使丙二酰辅酶A 的积累量处于动态平衡,提高了脂肪酸的产量[50]。另外,在利用木糖合成1,2,4−丁三醇的途径中,木糖酸是一个毒性中间代谢物。利用酸诱导的启动子PcadBA与LacI 转录因子形成一个“非门”调控木糖酸合成基因xdh 和xylC,木糖酸浓度的提高会诱导PcadBA,进而抑制木糖酸合成基因的表达,形成反馈抑制[87]。研究者还挖掘到了木糖酸诱导的启动子PyjhI,用其诱导表达木糖酸下游途径的基因[88],这两种调节均降低了木糖酸的积累,提高了终产物的产量。
在阿魏酸转化香草醛的途径中,用香草醛诱导的启动子控制香草醛的合成基因,使其在发酵前期香草醛合成速率慢,随着香草醛量的增加,不断诱导香草醛的合成。这种方法使细胞在发酵前期避免香草醛的毒性,积累更高的生物量,而在发酵后期香草醛产量更高[52]。通过群体感应诱导系统也可以实现发酵前期积累生物量、发酵后期诱导产物高效合成的效果[89−90]。
另一方面是对竞争途径的自主动态调控。FPP是生产各种萜类物质的重要前体,在酿酒酵母中很大一部分的FPP 都被用于合成麦角固醇,用于维持细胞正常生长,但这与目标途径形成了竞争。完全敲除FPP 转化麦角固醇的基因ERG9 会导致细胞无法生长,因此一般都会考虑抑制ERG9 的转录水平。研究发现麦角固醇会对合成它的基因的启动子PERG1形成反馈抑制,因此可以用PERG1调控ERG9,使麦角固醇合成途径处于反馈调节的状态,这就减少了FPP 向麦角固醇的合成,使紫穗槐二烯的产量明显提高,并且同时维持菌株良好的生长[图5(b)][91]。
3.2.2 自主动态调控在提高细胞鲁棒性中的应用乙酸是对细胞毒性较强的代谢物之一,在乙酸合成过量的情况下需要抑制乙酸的合成途径。研究者利用乙酸诱导的启动子PglnAP2s、葡萄糖诱导的启动子PgluA7以及溶氧抑制的启动子PfnrF8构建了多种逻辑门,由于发酵过程中乙酸浓度、葡萄糖浓度和溶氧浓度均随时间变化,因此通过多种逻辑门可得到一系列不同的动态输出信号。根据发酵中后期抑制乙酸合成的要求,选择适当的逻辑门对乙酸合成基因进行了动态抑制,极大地降低了乙酸在细胞内的含量[46]。
热激蛋白起到防止蛋白质在高温下错误折叠或聚集的作用,而且不同的热激蛋白对不同温度下蛋白质的保护作用也是不同的。利用响应不同温度的RNA 温度计来调节不同热激蛋白的过表达,可实现热激蛋白的梯级表达,降低细胞的表达负担。另外,利用群体感应启动子调控自杀基因,可使细胞维持在一定的数量,防止细胞浓度过高导致产热效应和过早进入衰亡期[62]。
在细胞工厂中,异源表达往往对底盘细胞形成负担,使细胞生长水平降低。研究者在大肠杆菌中分析了表达异源基因对细胞转录组的影响,发现表达异源基因使大部分热激蛋白基因显著上调。据此构建了通过CRISPRi 自主调节细胞负担的系统,用上调最为显著基因的启动子PhtpG1控制靶向异源基因的gRNA,用组成型启动子表达dCas9,当异源基因表达过高时,gRNA 的表达也会提高,进而反馈抑制异源基因的表达,使细胞的生长和生产处于平衡状态,提高产物的产量[图5(c)][92]。利用转录组挖掘到的高温诱导启动子和乙酸诱导启动子分别对酿酒酵母谷胱甘肽抗氧化系统和乙酸降解途径进行强化,使ROS 和乙酸可以对启动子进行自主的反馈调节,不但提高了细胞鲁棒性和乙醇产量,还可以降低过表达造成的负担[图5(d)][57]。

图5 自主动态调控策略(a)FPP反馈抑制与反馈诱导提高紫穗槐二烯产量[56];(b)麦角固醇反馈抑制降低竞争途径通量[91];(c)转录负担诱导的CRISPRi反馈调节[92];(d)胁迫诱导的抗胁迫反馈调节[57];(e)二次酸感应细胞死亡系统[93]Fig.5 Autonomous dynamic regulations(a)FPP feedback inhibition and induction increase amorphadiene production[56];(b)ergosterol feedback inhibition decreases competitive pathway flux[91];(c)burden induced CRISPRi feedback regulation[92];(d)stress−driven feedback regulation of anti−stress system[57];(e)two count pH sensitive kill switch[93]
研究者构建了一个酸诱导的细胞死亡系统。用酸诱导启动子Pasr调控毒蛋白Doc 的表达。通过对启动子强度的优化使得细胞在pH7.0 稳定生长,而在pH5.0 时停止生长。在此基础上,通过复杂的基因线路实现了细胞在二次酸性下死亡的过程,基因线路包括触发线路和效应线路[图5(e)]。在初始的中性pH 环境中,cI抑制启动子PR和PRM;当菌株处于酸性胁迫下,诱导cro的表达,高浓度的cro可同时抑制PRM和PR,当pH 恢复到中性时,低浓度的cro 只抑制PRM,PR开启xis 和int 的表达。Xis−Int 可将attL和attR 之间的序列切除;在第二次酸诱导下,doc 可以表达,并抑制细胞生长[93]。将致死基因doc替换为荧光蛋白基因,可实现对酸胁迫的计数[93]。
3.2.3 自絮凝实现细胞分离的智能化 在酿酒酵母及运动发酵单胞菌(Zymomonas mobilis)等菌株中都存在细胞絮凝机制,在发酵后期开启细胞絮凝,可使细胞与发酵液自动分离,简化分离过程,降低生产成本[94]。在酿酒酵母中,用高温诱导型启动子PHSP30或乙醇诱导型启动子PTPS1强化絮凝基因FLO1/5/11 的表达,实现了细胞在发酵后期随着温度或乙醇浓度的升高自动絮凝[95−96]。
坎帕尼亚盐单胞菌(Halomonas campaniensis)的耐盐和耐碱性使其非常有望被用于工业,实现发酵废水的循环使用及开放的发酵模式。通过敲除电子传递链中的基因etf,提高细胞表面的疏水性,使细胞实现自絮凝过程,不仅实现了发酵废液的多次循环使用,还提高了发酵产物聚−3−羟基丁酸酯(poly−3−hydroxybutyrate,PHB)的产量[97]。
4 菌株的智能进化
除了理性地构建智能调控菌株以外,菌株进化过程的智能化也越来越多地被发现。智能进化可以分为基于生物传感器的自主进化和基于高通量突变体库的智能进化,前者相较于后者更加智能、更具针对性。以下将介绍一些经典的智能进化方法。
4.1 智能自主进化提高目标化合物产量
基于生物传感器的自主进化一般要求生物传感器的特异性较强,避免结构类似物对生物传感器和进化过程造成干扰。为了提高目标产物的产量,研究者发明了反馈调节的菌株进化系统(feedback−regulated evolution of phenotype,FREP)[53]。系 统 包括三个模块:①能够与产物结合并改变与启动子结合力的转录因子;②转录因子所调控的启动子;③诱变基因dnaQ。当产物浓度低时,无产物结合在转录因子上,启动子开启诱变基因表达,使基因组进行随机突变,基因组的突变可获得高产菌株,高产菌株中产物与转录因子相结合,从而抑制启动子,停止诱变基因的继续表达。研究者在大肠杆菌中用酪氨酸结合的转录因子TyrR调节启动子ParoF的开关,得到了高产酪氨酸的突变株[图6(a)][53]。用前文所述的IPP 响应元件控制诱变基因的表达,筛选得到了高产IPP和番茄红素的菌株[53]。
4.2 智能自主进化提高菌株鲁棒性
研究者在枯草芽孢杆菌中开发了一种自主进化 系 统(autonomous evolution mutation system,AEMS),成功提高了菌株耐受乙偶姻的水平。将群体感应诱导的启动子PsrfA与木糖诱导系统组合成“与门”开关,用其控制ssbA、bstG(诱变基因)和sspB(识别ssrA 标签并降解此标记蛋白)。另一条基因线路中用IPTG 诱导系统控制融合ssrA 标签的mutL和alkA(编码高保真修复酶)。在自主进化的开始加入IPTG 和木糖,高保真修复酶表达,使细胞正常生长到一定密度,之后高密度诱导诱变基因表达,并降解高保真修复酶,使基因组突变[图6(b)]。在高浓度乙偶姻下筛选得到耐受菌株[39]。此方法实现了菌株自发的突变,不需要控制外部条件,避免了传统诱变致死率高、效率低等问题。
类似地,研究者利用前文所述的pH 调节的核糖体开关PRE 也实现了菌株的自主进化,提高了菌株在酸性条件下的鲁棒性。用PRE 调控基因int2(编码一个整合酶使attB 和attP 之间的序列翻转)的表达,在attB 和attP 之间插入一个组成型启动子,而在attB 和attP 两侧分别是诱变基因ednaQ 和荧光蛋白基因rfp。当细胞处于酸性环境时,PRE 处于关闭状态,ednaQ 表达并引起基因组突变,当突变株获得了抵抗酸性的能力时,细胞质的pH 上升,使PRE 开启int2 的表达,从而使启动子方向发生改变,开启rfp 的表达[图6(c)]。通过挑选带有红色荧光的菌落,即可得到耐酸的菌株[73]。
4.3 基于高通量突变体库的智能进化
研究者发明了一种在体内合成CRISPR RNA(crRNA)文库的方法(CRISPR adaptation−mediated library manufacturing,CALM)。利用产脓链球菌Streptococcus pyogenes 自身的CRISPR 防御机制,将合成crRNA 的基因元件移植到其他菌株中,其中包括间隔重复序列,反义crRNA 以及Cas 蛋白基因hdcas9、cas1、cas2和csn2[98]。将目标基因组的碎片转化到此工程菌中,可使工程菌自动获得crRNA 文库,测序表明文库覆盖了约95%可靶向的位置。用此方法筛选得到耐受氨基糖苷类抗生素的菌株[99]。

图6 基于生物传感器的智能自主进化策略(a)FREP[53];(b)AEMS[39];(c)利用pH感应的核糖体开关的自主进化[73]Fig.6 Intelligent autonomous evolutions(a)FREP[53];(b)AEMS[39];(c)autonomous evolution based on pH−sensitive riboswitch[73]
人工合成酵母基因组(Sc2.0)通过在基因的3′UTR 处插入loxPsym 序列使得人工合成的基因组容易 编 辑 与 进 化[100−102]。 SCRaMbLE(synthetic chromosome rearrangement and modification by loxP−mediated evolution)就是通过重组酶Cre 的介导使两个loxPsym 之间的序列发生删除、倒置或翻倍等事件(图7)。通过用半乳糖和β−雌二醇构成的“与门”开关提高Cre 表达的严谨性,使得SCRaMbLE 能够被精确控制[103]。另外,光控诱导Cre 重组酶的表达可以使诱导更严谨、强度更高、开关更可控[104]。研究者在SCRaMbLE 处理后筛选到耐碱性的菌株[105]。通过将合成型染色体酵母与其他单倍体酵母杂交形成杂合二倍体,再进行SCRaMbLE,可以更快速和高效地筛选得到耐高温和耐咖啡因的菌株,这种方法降低了SCRaMbLE的致死率[106]。研究者开发了反向双筛选标记的SCRaMbLE 系统ReSCuES(reporter of SCRaMbLEd cells using efficient selection),这种方法避免了假阳性菌落的出现,通过此方法筛选得到耐受乙醇、耐受高温以及耐受乙酸的菌株[107]。SCRaMbLE 同样可以应用于生产异源天然产物中,可以将外源途径的基因线路通过质粒[108−109]或基因组整合[103,110−111]的方式构建到合成型染色体酵母中,开启SCRaMbLE 后筛选高产菌株,并测序研究合成型染色体基因型的变化与表型的关系。目前通过SCRaMbLE 已成功提高了β−胡萝卜素、紫色杆菌素及桦木酸的产量。进一步,研究者还开发了SCRaMbLE−in 的策略,即在体外首先构建好代谢途径的文库,再通过转化和SCRaMbLE 同时进行使基因线路文库整合到合成型染色体上,实现外源基因线路与合成型染色体的共同进化,此方法比整合到基因组单拷贝位点的产量提高了2~10倍[112]。
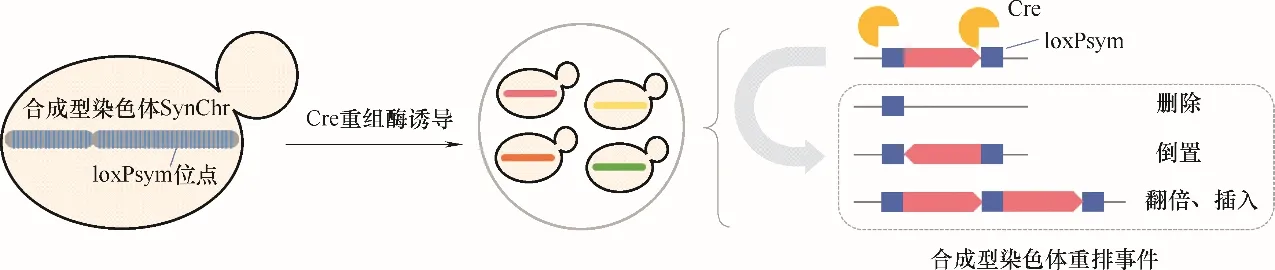
图7 SCRaMbLE作用原理Fig.7 Mechanism of SCRaMbLE
5 发酵过程的智能化
发酵过程的智能化主要体现在发酵工厂的在线控制和实验室研究中的微流控两方面。
5.1 发酵控制的智能化
发酵过程中的数据采集和自动化控制是决定其智能程度的关键(图8)。通过越来越多的在线传感器的开发,计算机可以获得更多的发酵过程参数,并利用大数据分析来更好地控制发酵条件。除了常规的发酵参数,近年来还开发了能够检测发酵尾气(氧气和二氧化碳等)、活细胞数量、小分子代谢物等参数的在线传感器[113]。通过多尺度、在线的参数检测和控制,可以提高产物在中试以及工业级规模发酵罐中的产量[114−115]。
工业发酵罐中控制参数的不均一性和时变性给发酵控制增加了难度,并且细胞未处于发酵最佳条件严重降低了发酵产量。通过基于神经网络的在线自学习的温度控制方法,可以提高发酵罐中温度控制的精确程度,并且使多段温度控制更加稳定[116]。发酵过程的补料策略同样影响发酵产量,例如,如何添加甘油使1,3−丙二醇的产量最大化,研究者通过将蒙特卡罗抽样与路径积分相结合的改进粒子群算法来优化控制方法,提高了产物的浓度[117]。
5.2 微流控技术
近年来,微流控技术被广泛应用于微型发酵实验以及高通量筛选和高通量测序,具有可控性强、自动化和通量高的特点。目前能够实现利用全自动的微流控操作平台进行单细胞的筛选和检测[118−119]。微流控技术与单细胞测序技术相结合[120−121]不仅提高了测序通量,而且可以解决微生物培养中的细胞分化、混菌互作关系等难以解决的科学问题。
6 结论与展望
智能化的生物制造逐渐地受到人们的关注,其对工业发酵生产过程将起到革命性的作用。本文从蛋白质设计、生物传感器、基因线路、菌株进化和发酵过程五个层面对智能生物制造进行了介绍和解析。在蛋白质设计的智能化层面,调节蛋白的设计取得了一些重要突破,获得了大量调节蛋白用于细胞调控。而要想实现任意功能的酶的从头设计这一终极目标,继续发展计算机的智能设计方法将是必经之路。对酶的催化选择性、条件选择性机制的解析可以帮助人们更深入地理解酶分子设计,实现酶的智能设计。在生物传感器的智能化层面,已经开发了多种响应不同信号的生物传感器,包括转录调节、翻译调节相关的以及蛋白质类的生物传感器。生物传感器的稳定性、严谨性、灵敏度、检测范围等指标是评价其能否被应用到实际生产中的重要标准。对生物传感器响应信号的拓展以及性能的优化将是实现智能生物制造过程的重要基础。在代谢调控的智能化层面,细胞完全自主的动态调控优于传统的动态调控方式。在各种生物传感器的基础上,实现对代谢途径或鲁棒性的自主调节,将对降低发酵过程的生产成本和提高产量起到重要作用。在菌株的智能进化层面,基于生物传感器的自主进化一般要求生物传感器的特异性较强,避免结构类似物对生物传感器和进化过程造成干扰。因此,开发重要产物的生物传感器是至关重要的。另外,借助智能化高通量的机器人,烦琐的高重复度的生化实验将逐渐被智能化机器人取代。高通量组装与筛选平台已越来越多地被应用[22,122],并且高通量的化合物检测平台[111]的应用也是替代生物传感器的一种方案,并且更具普适性。在发酵过程的智能化层面,工业级发酵的多参数在线传感器、大数据分析和优化控制方法,以及实验室规模下微流控发酵技术的发展将是未来智能发酵过程的发展方向。
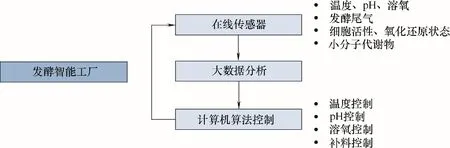
图8 发酵工厂的智能化Fig.8 Intelligence of fermentation control

