内质网应激在氧化低密度脂蛋白诱导的人RPE细胞凋亡中的作用
吴 桐,党宽荣,苏静波,吕葆真,陆新婷,惠延年,杜红俊
0引言
年龄相关性黄斑变性(age-related macular degeneration, ARMD)是老年人不可逆盲的最主要原因。按照病理变化不同,ARMD可以分为干性和湿性两种类型。干性ARMD的主要病理改变之一是视网膜色素上皮(retinal pigment epithelium, RPE)细胞的凋亡和由此导致的感光细胞死亡,而氧化应激损伤是主要原因[1]。内质网应激(endoplasmic reticulum stress, ERS)是近年来发现的一种新的凋亡机制,它通过影响细胞内促存活和促凋亡途径相关基因的表达,维持细胞内代谢平衡,以及PERK-eLF2-ATF4-CHOP、IRE1-XBP1和ATF6三种经典的信号途径发挥作用[2]。既往研究中已证实氧化低密度脂蛋白(oxidized low-density lipoprotein, OxLDL)可引起RPE细胞凋亡,但其参与凋亡的具体机制以及ERS是否参与其中尚不明确[3-4]。本研究采用不同浓度的OxLDL作用于人RPE细胞,观察对细胞活力和凋亡的影响,同时观察ERS相关蛋白及凋亡相关酶的变化,探讨ERS在OxLDL诱发的人RPE细胞凋亡中的作用和机制。
1材料和方法
1.1材料人RPE细胞系ARPE19(中国科学院细胞库)、胎牛血清(Hyclone,澳大利亚)、低糖DMEM(Corning,美国)、胰酶(Gibco,美国)、青霉素/链霉素(Gibco,美国)、OxLDL、LDL、Dil-OxLDL(翊圣生物,中国)、Annexin V-FITC/PI 细胞凋亡双染试剂盒(碧云天,中国)、CCK8(七海生物,中国)、BCA蛋白定量试剂盒、小鼠源Caspase-12抗体、小鼠源β-actin抗体(CST,美国)、兔源CHOP抗体、兔源GRP78抗体、兔源XBP-1抗体、兔源ATF6抗体(Proteintech,中国)、兔源RPE65抗体(Abcam,美国)、Alexa Fluor 488标记的山羊抗兔IgG二抗、辣根过氧化酶(HRP)标记的山羊抗小鼠IgG二抗、HRP标记的山羊抗兔IgG二抗(翊圣生物,中国)、DAPI(Invitrogen,美国)、SDS-PAGE凝胶配制试剂盒(碧云天,中国)、ECL超敏发光底物(四正柏,中国)。主要仪器设备:CO2培养箱(上海力申科学仪器)、倒置显微镜(Olympus,日本)、FSX100荧光显微镜(Olympus,日本)、SDS-PAGE 电泳仪、电泳槽及化学发光仪(Bio-Rad,美国)、流式细胞仪(Becton-Dickinson,美国)。
1.2方法
1.2.1细胞培养ARPE19采用低糖DMEM培养基(含10%胎牛血清、1×105U/L 青霉素和100mg/L链霉素)在37°C、5% CO2饱和湿度的培养箱中常规培养。取生长状态良好的细胞进行后续实验。
1.2.2 RPE细胞吞噬检测将对数生长期的ARPE19接种于24孔板细胞爬片,常规培养至50%融合状态后,加入25μg/mL红色荧光探针Dil标记的OxLDL(Dil-OxLDL)培养8h,4%PFA固定后免疫荧光染色,加入RPE65抗体4℃过夜,洗涤后与Alexa Fluor 488标记的山羊抗兔IgG二抗室温孵育2h,DAPI染色并封片。使用激光共聚焦显微镜观察RPE细胞吞噬Dil-OxLDL情况并拍照。
1.2.3实验分组和细胞活力测定将对数生长期的ARPE19接种于96孔细胞培养板,实验分为(1)对照组:完全培养基常规培养;(2)OxLDL组:完全培养基中加入不同浓度 (5、10、25、50、100μg/mL)OxLDL;(3)LDL组:完全培养基中加入不同浓度(5、10、25、50、100μg/mL)LDL。根据我组前期实验方法[5],继续培养24h后收集细胞,采用CCK8法评价OxLDL对细胞活力的影响。各组细胞活力以其吸光度(optical density, OD)值占正常对照组OD值的百分比表示,公式为:细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%;As:实验孔吸光度(含细胞、培养基、CCK8溶液和OxLDL/LDL);Ac:对照孔吸光度(含细胞、培养基、CCK8溶液,不含药物);Ab:空白孔吸光度(含培养基、CCK8溶液,不含细胞、药物)。
1.2.4 Annexin V-FITC/PI 双染色法检测细胞凋亡根据文献报道[6-7],采用25μg/mL的OxLDL处理人RPE细胞24h后,收集细胞重悬于500μL上样缓冲液,与Annexin V-FITC 和PI各5μL室温避光孵育15min,然后采用流式细胞仪(Becton-Dickinson, 美国)分析测定细胞凋亡率。细胞总细胞凋亡率(%)=早期凋亡率(Annexin V+/PI-)+晚期凋亡率(Annexin V+/PI+)。

图1 RPE细胞吞噬Dil-OxLDL 细胞免疫荧光染色结果(×200) Merge图像为共定位;蓝色为DAPI染细胞核;绿色荧光为RPE65;红色荧光为吞噬的Dil-OxLDL。
1.2.5 Western blotting分析根据CCK8实验结果所选浓度,将细胞分为对照组、OxLDL组(25μg/mL)、LDL组(25μg/mL)。按照本实验室报道的方法[8]提取蛋白,等量的各组总蛋白经SDS-PAGE凝胶电泳分离后转移到PVDF膜上,经封闭、洗涤后加入一抗小鼠源Caspase-12抗体(1∶1000)、兔源CHOP抗体(1∶1000)、兔源GRP78抗体(1∶1000)、兔源XBP-1抗体(1∶1000)、兔源ATF6抗体(1∶1000)、小鼠源β-actin抗体(1∶1000),4°C过夜,β-actin作为内参。洗膜后与HRP标记的山羊抗小鼠IgG二抗、HRP标记的山羊抗兔IgG二抗室温孵育2h。抗原-抗体复合物以ECL发光底物显示,应用化学发光成像仪(美国Bio-Rad公司,Bio-Rad ChemiDoc XRS+型)采集图像,用Image J软件分析蛋白条带灰度值,以靶蛋白灰度值/β-actin灰度值的比值反应靶蛋白相对水平。
统计学分析:采用SPSS 22.0软件进行统计学分析,数据使用均数±标准差表示。多个样本均数之间的比较采用单因素方差分析,组间比较采用LSD-t检验。双侧检验以P<0.05为差异有统计学意义。
2结果
2.1 RPE细胞吞噬OxLDL情况激光共聚焦显微镜观察结果显示,细胞RPE65染色阳性,细胞内可见大量吞噬的Dil-OxLDL,证明OxLDL可被RPE吞噬而进入细胞,发挥进一步作用,见图1。
2.2 CCK8检测细胞活力结果对照组细胞活力为(100±5.637)%,与对照组比较,OxLDL组经5、10、25、50和100μg/mL处理24h后细胞活力分别为(105.298±9.395)%、(97.106±5.417)%、(77.015±4.055)%、(67.613±3.853)%和(43.872±9.532)%,各组之间比较差异有统计学意义(F=38.45,P<0.05),与对照组相比,25、50和100μg/mL OxLDL组差异有统计学意义(均P<0.05),即OxLDL在低浓度(<25μg/mL)时不影响细胞活力,而高浓度时(>25μg/mL)则可降低细胞的活力(P<0.05)。而5、10、25、50和100μg/mL LDL处理24h对细胞活力无影响,差异无统计学意义(P>0.05),各组细胞活力分别为(97.55±6.217)%、(99.640±3.586)%、(90.495±2.786)%、(83.552±9.171)%和(90.910±1.429)%,见图2。
2.3 Annexin V-FITC/PI双染色法检测细胞凋亡情况因浓度大于25μg/mL的OxLDL会降低细胞活力,因此我们采用25μg/mL处理RPE细胞, Annexin V-FITC/PI染色和流式细胞仪检测细胞凋亡水平,结果显示:对照组、OxLDL组和LDL组凋亡率分别是(5.271±0.519)%、(41.23±1.686)%和(13.07±2.579)%,差异有统计学意义(F=329.8,P<0.01)。且OxLDL组相比LDL组和对照组,以及LDL组相比对照组,差异均有统计学意义(P< 0.05),见图3。

图2 CCK8检测各组细胞活力。
2.4 Western blotting检测ERS相关蛋白表达结果对照组、OxLDL组、LDL组5种ERS相关蛋白的表达水平差异均有统计学意义(P<0.05)。OxLDL组ERS相关蛋白表达均高于对照组和LDL组,差异均有统计学意义(P<0.05),见表1,图4。
3讨论
ARMD是视网膜黄斑区的一种慢性退行性病变,在临床上主要分为干性(萎缩型)和湿性(渗出或出血型)两种。其中干性ARMD占确诊病例的80%以上,其主要特征是早期玻璃膜疣(drusen)的形成、RPE细胞的变性死亡和由此引起的视网膜外屏障破坏、感光细胞的死亡,进而造成严重的视力损伤。而在此过程中,年龄引起的黄斑部的氧化应激起着重要作用[9-11]。随着RPE细胞的衰老和感光细胞的更新,RPE细胞消化OxLDL的能力降低,过多的OxLDL在RPE细胞内堆积,细胞内活性氧(reactive oxygen species, ROS)和非自由基物质增加,最终导致了RPE细胞的死亡[12-13]。临床试验已经证明服用抗氧化剂可以减小ARMD进展的风险,这也证明了氧化应激在ARMD发病中的关键作用[14-15]。
细胞凋亡是细胞死亡方式的一种程序性,通常和早期疾病的发生密切相关。经典的细胞凋亡通路包括:死亡受体活化(外源性)途径即细胞表面死亡受体接受胞外死亡信号而激活细胞内的凋亡;线粒体损伤(内源性)途径即线粒体通过释放凋亡诱导因子(apoptosis-inducing factor,AIF)等激活Caspase通路导致细胞凋亡。而ERS引起的凋亡是近年来发现的一种新的凋亡方式。内质网是膜相关蛋白和分泌蛋白折叠和组装的主要细胞内位点。内质网功能障碍可导致蛋白质折叠能力落后于蛋白质折叠负荷。大量错误折叠的蛋白质给内质网带来压力,进而导致细胞凋亡[16-17]。ERS主要有PERK-eLF2-ATF4-CHOP、IRE1-XBP1和ATF6三种经典的信号途径参与,其中后两个途径主要调控内质网伴侣蛋白,例如GRP78,从而增加了蛋白质折叠的能力[18]。虽然PERK的早期激活增加了eIF2α的磷酸化,降低了蛋白质翻译速率,从而使内质网从压力中恢复。但持续的ERS会激活PERK通路的下游因子CHOP,导致细胞凋亡和死亡[19-20]。

图3 流式细胞仪检测各组细胞凋亡率 A:细胞凋亡流式图;B:细胞凋亡率统计图;aP<0.05 vs 对照组;cP<0.05 vs LDL组。
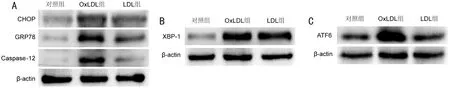
图4 Western blotting检测ERS相关蛋白表达结果 A:各组细胞中CHOP、GRP78和Caspase-12蛋白表达结果;B:各组细胞中XBP-1蛋白表达结果;C:各组细胞中ATF6蛋白表达结果。
表1 各组中CHOP、GRP78、Caspase-12、XBP-1和ATF6蛋白表达情况
以往有研究证实OxLDL可通过激活ERK-Bax/Bcl-2信号通路导致RPE细胞凋亡[3],但ERS是否参与尚未见文献报道。本研究结果显示,浓度大于25μg/mL的OxLDL作用于RPE细胞可引起细胞活力降低。进一步通过Annexin V-FITC/PI染色和流式细胞仪检测发现,OxLDL处理组的RPE细胞凋亡比例增加。 Western blotting检测结果显示凋亡相关酶Caspase-12在OxLDL作用下表达增加同时ERS相关蛋白CHOP、GRP78、XBP-1和ATF6表达上调。提示除了经典的凋亡通路,OxLDL还可以通过ERS途径引起RPE细胞凋亡。
综上所述,本次研究证实一定浓度OxLDL可通过ERS途径导致RPE细胞凋亡,而通过调控ERS减少RPE细胞凋亡可能达到控制ARMD进展的目的。
——疾病防治的新靶标

